Эпоксид

В органической химии эпоксид — это циклический эфир , где эфир образует трехатомное кольцо : два атома углерода и один атом кислорода . Эта треугольная структура имеет значительную кольцевую деформацию , что делает эпоксиды более реакционноспособными , чем другие простые эфиры. Они производятся в больших масштабах для многих применений. Обычно эпоксиды с низкой молекулярной массой бесцветны, неполярны и часто летучи . [ 1 ]
Номенклатура
[ редактировать ]Соединение, содержащее эпоксидную функциональную группу, можно назвать эпоксидом, эпоксидом, оксираном и этоксилином. Простые эпоксиды часто называют оксидами. Таким образом, эпоксид этилена (C 2 H 4 ) представляет собой оксид этилена (C 2 H 4 O). Многие соединения имеют тривиальные названия; например, оксид этилена называется «оксираном». Некоторые названия подчеркивают наличие эпоксидной функциональной группы , как в соединении 1,2-эпоксигептана , который также можно назвать оксидом 1,2-гептена .
Полимер , образованный из предшественников эпоксидов, называется эпоксидной смолой . Однако лишь немногие из эпоксидных групп смолы выдерживают процесс отверждения .
Синтез
[ редактировать ]В промышленности преобладающими эпоксидами являются оксид этилена и оксид пропилена , объемы производства которых составляют примерно 15 и 3 миллиона тонн в год соответственно. [ 2 ]
Помимо оксида этилена, большинство эпоксидов образуется, когда пероксидированные реагенты отдают один атом кислорода алкену . Соображения безопасности влияют на эти реакции, поскольку органические пероксиды склонны к самопроизвольному разложению или даже возгоранию.
И гидропероксид трет-бутила , и гидропероксид этилбензола можно использовать в качестве источников кислорода во время окисления пропилена (хотя также требуется катализатор, и вместо этого большинство промышленных производителей используют дегидрохлорирование). [ 3 ]
Окисление этилена
[ редактировать ]Промышленность по производству этиленоксида производит продукцию в результате реакции этилена и кислорода . модифицированные гетерогенные серебряные катализаторы. Обычно используются [ 4 ] По механизму реакции, предложенному в 1974 г. [ 5 ] по крайней мере, одна молекула этилена полностью окисляется на каждые шесть молекул, превращающихся в оксид этилена:
Только этилен образует эпоксид при неполном сгорании . Другие алкены не вступают в полезную реакцию, даже пропилен катализаторы на носителе TS-1 , хотя Au- могут избирательно эпоксидировать пропилен. [ 6 ]
Органические пероксиды и металлические катализаторы
[ редактировать ]Комплексы металлов являются полезными катализаторами эпоксидирования с участием пероксида водорода и алкилгидропероксидов. Эпоксидирование, катализируемое металлами, было впервые исследовано с использованием гидропероксида трет-бутила (TBHP). [ 7 ] При ассоциации ТБГП с металлом (М) образуется пероксикомплекс активного металла, содержащий группу МООР, который затем передает О-центр алкену. [ 8 ]
Оксид ванадия(II) катализирует эпоксидирование специфически менее замещенных алкенов. [ 9 ]
Нуклеофильное эпоксидирование
[ редактировать ]Электронодефицитные олефины, такие как еноны и производные акрила, можно эпоксидировать с использованием нуклеофильных кислородных соединений, таких как пероксиды. Реакция представляет собой двухстадийный механизм. Сначала кислород осуществляет присоединение нуклеофильного конъюгата с образованием стабилизированного карбаниона. Затем этот карбанион атакует тот же атом кислорода, вытесняя из него уходящую группу, замыкая эпоксидное кольцо.
Переход от пероксикарбоновых кислот
[ редактировать ]Пероксикарбоновые кислоты, которые более электрофильны, чем другие пероксиды, превращают алкены в эпоксиды без вмешательства металлических катализаторов. В специализированных применениях диоксирановые реагенты (например, диметилдиоксиран ) действуют аналогично , но более взрывоопасны.
В типичных лабораторных операциях используется реакция Прилежаева . [ 10 ] [ 11 ] Этот подход включает окисление алкена пероксикислотой, такой как м -CPBA . Показательным является эпоксидирование стирола до пербензойной кислотой оксида стирола : [ 12 ]
Стереохимия реакции весьма чувствительна. В зависимости от механизма реакции и геометрии исходного алкена цис- и/или транс -эпоксидные диастереомеры могут образовываться . Кроме того, если в исходном материале присутствуют другие стереоцентры, они могут влиять на стереохимию эпоксидирования.
Реакция протекает по механизму, широко известному как «механизм бабочки». [ 13 ] Пероксид рассматривается как электрофил , а алкен – как нуклеофил . Реакцию считают согласованной. Механизм «бабочка» обеспечивает идеальное позиционирование O−O Орбиталь сигма-звезды для C−C π-электроны для атаки. [ 14 ] Поскольку две связи разрываются и образуются кислород эпоксида, это формально является примером коарктатного переходного состояния .
Асимметричные эпоксидирования
[ редактировать ]Хиральные эпоксиды часто могут быть получены энантиоселективно из прохиральных алкенов. Многие металлокомплексы дают активные катализаторы, но наиболее важными являются титан , ванадий и молибден . [ 15 ] [ 16 ]
Гидропероксиды также используются в каталитическом энантиоселективном эпоксидировании, таком как эпоксидирование Шарплесса и эпоксидирование Якобсена . Вместе с эпоксидированием Ши эти реакции полезны для энантиоселективного синтеза хиральных эпоксидов. Оксазиридиновые реагенты также можно использовать для получения эпоксидов из алкенов.
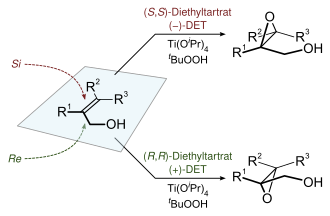
Реакция эпоксидирования Шарплесса — одна из важнейших энантиоселективных химических реакций . Применяется для получения 2,3-эпоксиспиртов из первичных и вторичных аллильных спиртов . [ 17 ] [ 18 ]
Дегидрогалогенирование и другие исключения γ
[ редактировать ]
Галогенгидрины реагируют с основанием с образованием эпоксидов. [ 20 ] Реакция является спонтанной, поскольку энергетические затраты на введение кольцевой деформации (13 ккал/моль) компенсируются большей энтальпией вновь введенной связи CO (по сравнению с энтальпией расщепленной связи C-галоген).
Предполагается, что образование эпоксидов из вторичных галогидринов будет происходить быстрее, чем из первичных галогидринов, из-за увеличения энтропийных эффектов во вторичном галогидрине, а третичные галогидрины реагируют (если вообще реагируют) чрезвычайно медленно из-за стерического скученности. [ 21 ]
Начиная с пропиленхлоргидрина , большая часть мировых поставок оксида пропилена приходится на этот путь. [ 3 ]

Реакция внутримолекулярного образования эпоксида — одна из ключевых стадий реакции Дарценса .
В реакции Джонсона-Кори-Чайковского эпоксиды образуются из карбонильных групп и илидов сульфония . В этой реакции уходящей группой вместо хлорида является сульфоний.
Биосинтез
[ редактировать ]Эпоксиды в природе встречаются редко. Они возникают обычно за счет оксигенации алкенов под действием цитохрома Р450 . [ 22 ] (но см. также короткоживущие эпоксиэйкозатриеновые кислоты , которые действуют как сигнальные молекулы. [ 23 ] и аналогичные эпоксидокозапентаеновые кислоты и эпоксиэйкозатетраеновые кислоты .)
Оксиды арен являются промежуточными продуктами окисления аренов цитохромом Р450 . Для прохиральных аренов ( нафталина , толуола , бензоатов , бензопирена ) эпоксиды часто получаются с высокой энантиоселективностью.
Реакции
[ редактировать ]Реакции раскрытия цикла доминируют в реакционной способности эпоксидов.
Гидролиз и присоединение нуклеофилов
[ редактировать ]Эпоксиды реагируют с широким кругом нуклеофилов, например со спиртами, водой, аминами, тиолами и даже галогенидами. Имея два часто почти эквивалентных места атаки, эпоксиды служат примером «окружающих субстратов». [ 24 ] раскрытия цикла Региоселективность в асимметричных эпоксидах обычно соответствует образцу атаки S N 2 по наименее замещенному углероду, [ 25 ] но на него может влиять стабильность карбокатионов в кислых условиях. [ 26 ] Этот класс реакций лежит в основе эпоксидных клеев и производства гликолей. [ 19 ]
Литийалюминийгидрид или гидрид алюминия восстанавливают H эпоксиды посредством простого нуклеофильного присоединения гидрида ( − ); они производят соответствующий спирт . [ 27 ]
Полимеризация и олигомеризация
[ редактировать ]Полимеризация эпоксидов дает простые полиэфиры . Например, оксид этилена полимеризуется с образованием полиэтиленгликоля , также известного как полиэтиленоксид. Реакция спирта или фенола с оксидом этилена — этоксилирование — широко используется для получения поверхностно-активных веществ: [ 28 ]
- ROH + n C 2 H 4 O → R(OC 2 H 4 ) n OH
Эпоксиды с ангидридами дают полиэфиры. [ 29 ]
Металлирование и дезоксигенация
[ редактировать ]Литиирование расщепляет кольцо до β-литиоалкоксидов. [ 30 ]
Эпоксиды можно дезоксигенировать с использованием оксофильных реагентов с потерей или сохранением конфигурации. [ 31 ] Соединение гексахлорида вольфрама и н -бутиллития дает алкен . [ 32 ] [ 33 ]
При обработке тиомочевиной эпоксиды превращаются в эписульфид (тиираны).
Другие реакции
[ редактировать ]- Эпоксиды подвергаются реакциям расширения кольца, иллюстрируемым присоединением диоксида углерода с образованием циклических карбонатов .
- Эпоксид, соседний со спиртом, может подвергаться перегруппировке Пейна в основании.
Использование
[ редактировать ]-
Диглицидиловый эфир бисфенола является компонентом обычной бытовой «эпоксидной смолы».
-
Химическая структура эпоксида глицидола , обычного химического промежуточного соединения.
-
Эпотилоны представляют собой эпоксиды природного происхождения.
-
3,4-Эпоксициклогексилметил-3',4'-эпоксициклогексанкарбоксилат , предшественник покрытий. [ 34 ]
-
Эпоксидированный линолеин , основной компонент эпоксидированного соевого масла (ESBO), коммерчески важный пластификатор .
-
Оксид бензола существует в равновесии с изомером оксепина.
Оксид этилена широко используется для получения моющих средств и поверхностно-активных веществ путем этоксилирования . Его гидролиз дает этиленгликоль . Его также используют для стерилизации медицинских инструментов и материалов.
Реакция эпоксидов с аминами лежит в основе образования эпоксидных клеев и конструкционных материалов. Типичным аминным отвердителем является триэтилентетрамин (ТЭТА).
Безопасность
[ редактировать ]Эпоксиды являются алкилирующими агентами , что делает многие из них высокотоксичными. [ 35 ]
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Массингилл, Дж. Л.; Бауэр, Р.С. (1 января 2000 г.). «Эпоксидные смолы» . В Крейвере, Клара Д.; Каррахер, Чарльз Э. (ред.). Прикладная наука о полимерах: 21 век . Оксфорд: Пергамон. стр. 393–424. дои : 10.1016/b978-008043417-9/50023-4 . ISBN 978-0-08-043417-9 . Проверено 20 декабря 2023 г.
Ссылки
[ редактировать ]- ^ Гюнтер Зинель; Роберт Рит; Кеннет Т. Роуботтом. «Эпоксиды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a09_531 . ISBN 978-3527306732 .
- ^ Зигфрид Ребсдат; Дитер Майер. «Окись этилена». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a10_117 . ISBN 978-3527306732 .
- ^ Jump up to: а б Дитмар Калих, Уве Вихерн, Йорг Линднер «Оксид пропилена» в Энциклопедии промышленной химии Ульмана, 2002 г., издательство Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a22_239
- ^ Сайковски, диджей; Будар, М. (1987). «Структурная чувствительность каталитического окисления этилена серебром». Обзоры катализа . 29 (4): 325–360. дои : 10.1080/01614948708078611 .
- ^ Килти, Пенсильвания; Захтлер WMH (1974). «Механизм селективного окисления этилена в оксид этилена». Обзоры катализа: наука и техника . 10 :1–16. дои : 10.1080/01614947408079624 .
- ^ Нейхейс, Т. Александр; Макки, Мишель; Мулин, Джейкоб А.; Векхейзен, Берт М. (1 мая 2006 г.). «Производство оксида пропена: каталитические процессы и последние разработки». Исследования в области промышленной и инженерной химии . 45 (10): 3447–3459. дои : 10.1021/ie0513090 . hdl : 1874/20149 . S2CID 94240406 .
- ^ Обвинитель Н., Брилл В.Ф. (1965). «Эпоксидирование олефинов трет-бутилгидропероксидом, катализируемое ацетилацетонатом металла». Дж. Орг. Хим . 30 (6): 2074. doi : 10.1021/jo01017a520 .
- ^ Тиль В.Р. (1997). «Металлокатализируемое окисление. Часть 5. Каталитическое эпоксидирование олефинов семикоординационными оксобиспероксомолибденовыми комплексами: механистическое исследование». Журнал молекулярного катализа A: Химический . 117 : 449–454. дои : 10.1016/S1381-1169(96)00291-9 .
- ^ Табер, Дуглас (25 сентября 2006 г.). «Селективные реакции алкенов» . Основные моменты органической химии .
- ^ Марш, Джерри. 1985. Передовая органическая химия, реакции, механизмы и структура . 3-е изд. Джон Уайли и сыновья. ISBN 0-471-85472-7 .
- ^ Николай Прилешаев (1909). «Окисление ненасыщенных соединений органическими пероксидами». Отчеты Немецкого химического общества (на немецком языке). 42 (4): 4811–4815. дои : 10.1002/cber.190904204100 .
- ^ Гарольд Хибберт и Полин Берт (1941). «Оксид стирола» . Органические синтезы ; Сборник томов , т. 1, с. 494 .
- ^ Пол Д. Бартлетт (1950). «Недавние работы по механизмам перекисных реакций». Отчет о химическом прогрессе . 11 : 47–51.
- ^ Джон О. Эдвардс (1962). Механизмы пероксидной реакции . Интерсайенс, Нью-Йорк. стр. 67–106.
- ^ Беррисфорд, диджей; Болм, К.; Шарплесс, КБ (2003). «Лиганд-ускоренный катализ». Энджью. хим. Межд. Эд. англ . 95 (10): 1059–1070. дои : 10.1002/anie.199510591 .
- ^ Шелдон Р.А. (1980). «Синтетические и механистические аспекты катализируемого металлами эпоксидирования гидропероксидами». Журнал молекулярного катализа . 1 : 107–206. дои : 10.1016/0304-5102(80)85010-3 .
- ^ Кацуки, Т.; Шарплесс, КБ (1980). «Первый практический метод асимметричного эпоксидирования». Дж. Ам. хим. Соц. 102 (18): 5974–5976. дои : 10.1021/ja00538a077 .
- ^ Хилл, Дж.Г.; Шарплесс, КБ ; Экзон, СМ; Реженье, Р. Орг. Синтез. , Колл. Том. 7, с. 461 (1990); Том. 63, с. 66 (1985). ( Статья заархивирована 27 сентября 2013 г. в Wayback Machine )
- ^ Jump up to: а б Фам, Ха К.; Маркс, Морис Дж. (2005). «Эпоксидные смолы». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.a09_547.pub2 . ISBN 978-3527306732 .
- ^ Коппенхёфер, Б.; Шуриг, В. (1993). «(R)-Алкилоксираны высокой энантиомерной чистоты из (S)-2-хлоралкановых кислот через (S)-2-хлор-1-алканолы: (R)-метилоксиран» . Органические синтезы ; Сборник томов , т. 8, с. 434 .
- ^ Сильва, П.Дж. (2023). «Вычислительные данные о спонтанности образования эпоксида из галогенгидринов и других механистических деталях синтеза эфира Уильямсона» . хим. Дж. Молд . 18 (2): 87–95. дои : 10.19261/cjm.2023.1083 .
- ^ Тибодо CJ (2012). «Ферментативная химия биосинтеза циклопропана, эпоксида и азиридина» . хим. Преподобный . 112 (3): 1681–1709. дои : 10.1021/cr200073d . ПМЦ 3288687 . ПМИД 22017381 .
- ^ Бор ВФ (2003). Медицинская физиология: клеточный и молекулярный подход . Эльзевир/Сондерс. п. 108. ИСБН 978-1-4160-2328-9 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 517, ISBN 978-0-471-72091-1
- ^ Уоррен, Стюарт; Вятт, Пол (2008). Органический синтез: подход к отключению (2-е изд.). Уайли. п. 39.
- ^ Рзепа, Генри (28 апреля 2013 г.). «Как предсказать региоселективность раскрытия эпоксидного кольца» . Химия с изюминкой .
- ^ Брюс Рикборн и Уоллес Э. Ламке (1967). «Восстановление эпоксидов. II. Литийалюминийгидрид и смешанное гидридное восстановление оксида 3-метилциклогексена». Дж. Орг. хим. 32 (3): 537–539. дои : 10.1021/jo01278a005 .
- ^ Коссвиг, Курт (2002). «Поверхностно-активные вещества». В Элверсе, Барбара; и др. (ред.). Энциклопедия промышленной химии Ульмана . Вайнхайм, Германия: Wiley-VCH. дои : 10.1002/14356007.a25_747 . ISBN 978-3527306732 .
- ^ Джули М. Лонго; Мария Дж. Сэнфорд; Джеффри В. Коутс (2016). «Сополимеризация с раскрытием цикла эпоксидов и циклических ангидридов с дискретными металлокомплексами: взаимосвязь структура-свойство». хим. Преподобный . 116 (24): 15167–15197. doi : 10.1021/acs.chemrev.6b00553 . ПМИД 27936619 .
- ^ Б. Мудрик; Т. Коэн (1995). «1,3-Диолы из β-литиоалкоксидов лития, полученных восстановительным литированием эпоксидов: 2,5-диметил-2,4-гександиол». Орг. Синтез . 72 : 173. дои : 10.15227/orgsyn.072.0173 .
- ^ Такуя Накагири; Масахито Мурай; Казухико Такай (2015). «Стереоспецифическое дезоксигенирование алифатических эпоксидов в алкены при рениевом катализе». Орг. Летт . 17 (13): 3346–9. doi : 10.1021/acs.orglett.5b01583 . ПМИД 26065934 .
- ^ К. Барри Шарплесс , Марта А. Умбрейт (1981). «Деоксигенирование эпоксидов галогенидами вольфрама низшей валентности: транс -циклододецен». Орг. Синтез. 60:29 . дои : 10.15227/orgsyn.060.0029 .
- ^ К. Барри Шарплесс ; Марта А. Умбрейт; Марджори Т. Ние; Томас К. Флуд (1972). «Низшие валентные галогениды вольфрама. Новый класс реагентов для деоксигенации органических молекул». Дж. Ам. хим. Соц. 94 (18): 6538–6540. дои : 10.1021/ja00773a045 .
- ^ Сасаки, Хироши (февраль 2007 г.). «Отверждающие свойства циклоалифатических эпоксидных производных». Прогресс в области органических покрытий . 58 (2–3): 227–230. doi : 10.1016/j.porgcoat.2006.09.030 .
- ^ Нидерер, Кристиан; Бера, Рената; Хардер, Анджела; Шварценбах, Рене П.; Эшер, Беате И. (2004). «Механистические подходы к оценке токсичности реакционноспособных хлорорганических соединений и эпоксидов в зеленых водорослях». Экологическая токсикология и химия . 23 (3): 697–704. дои : 10.1897/03-83 . ПМИД 15285364 . S2CID 847639 .








![3,4-Эпоксициклогексилметил-3',4'-эпоксициклогексанкарбоксилат, предшественник покрытий.[34]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Diepoxyester.svg/175px-Diepoxyester.svg.png)

