Тиомочевина
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Тиомочевина [1] | |
| Другие имена Тиокарбамид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 605327 | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.494 |
| 1604 | |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 2811 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| СК( NH2 ) 2 | |
| Молярная масса | 76.12 g·mol −1 |
| Появление | белое твердое вещество |
| Плотность | 1405 г/мл |
| Температура плавления | 182 ° С (360 ° F; 455 К) |
| 142 г/л (25 °С) | |
| −4.24 × 10 −5 см 3 /моль | |
| Опасности | |
| СГС Маркировка : | |
   | |
| Предупреждение | |
| Х302 , Х351 , Х361 , Х411 | |
| P201 , P202 , P264 , P270 , P273 , P281 , P301+P312 , P308+P313 , P330 , P391 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения | Мочевина Селеномочевина |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тиомочевина ( / ˌ θ aɪ . oʊ j ʊəˈr iː . ə , - ˈ jʊər i -/ ) [2] [3] [4] представляет собой соединение формулы сероорганическое SC(NH 2 ) 2 и структура ЧАС 2 N-C(=S)-NH 2 . Структурно он похож на мочевину ( H 2 N-C(=O)-NH 2 ), за исключением того, что атом кислорода заменен атомом серы (как подразумевается префиксом тио- ); однако свойства мочевины и тиомочевины существенно различаются. Тиомочевина — реагент в органическом синтезе . Тиомочевины представляют собой широкий класс соединений с общей структурой R 2 N-C(=S)-NR 2 .
Структура и связь
[ редактировать ]Тиомочевина представляет собой плоскую молекулу. Расстояние связи C=S составляет 1,71 Å. Расстояния CN в среднем составляют 1,33 Å. [5] На ослабление связи CS пи-связью CN указывает короткая связь C=S в тиобензофеноне , равная 1,63 Å.
Тиомочевина встречается в двух таутомерных формах, из которых тионовая в водных растворах преобладает форма. Константа равновесия рассчитана как K eq равна 1,04 × 10 −3 . [6] Тиоловая соли форма, также известная как изотиомочевина, может встречаться в замещенных соединениях, таких как изотиурония .
Производство
[ редактировать ]Мировое годовое производство тиомочевины составляет около 10 000 тонн. Около 40% производится в Германии, еще 40% — в Китае и 20% — в Японии. Тиомочевину можно получить из тиоцианата аммония , но чаще всего ее получают реакцией сероводорода с цианамидом кальция в присутствии углекислого газа . [7]
- CaCN 2 + 3 H 2 S → Ca(SH) 2 + (NH 2 ) 2 CS
- 2 CaCN 2 + Ca(SH) 2 + 6 H 2 O → 2 (NH 2 ) 2 CS + 3 Ca(OH) 2
- Са(ОН) 2 + СО 2 → СаСО 3 + Н 2 О
Приложения
[ редактировать ]предшественник тиокса
[ редактировать ]Тиомочевина сама по себе имеет мало применений. В основном он используется в качестве предшественника диоксида тиомочевины , который является распространенным восстановителем при обработке текстиля. [7]
Удобрения
[ редактировать ]Недавно тиомочевину исследовали на предмет ее многочисленных полезных свойств в качестве удобрения, особенно в условиях экологического стресса. [8] Его можно применять в различных целях, например, для предварительной обработки семян (для грунтования), опрыскивания листьев или подкормки среды.
Другое использование
[ редактировать ]Другие промышленные применения тиомочевины включают производство огнезащитных смол и ускорителей вулканизации . Тиомочевина является строительным материалом для пиримидина производных . Таким образом, тиомочевины конденсируются с β-дикарбонильными соединениями. [9] Аминогруппа тиомочевины первоначально конденсируется с карбонилом, после чего следует циклизация и таутомеризация. Десульфурация дает пиримидин. Фармацевтические препараты тиобарбитуровая кислота и сульфатиазол получают с использованием тиомочевины. [7] 4-Амино-3-гидразино-5-меркапто-1,2,4-триазол получают реакцией тиомочевины и гидразина .
Тиомочевина используется в качестве вспомогательного вещества в диазобумаге, светочувствительной фотокопировальной бумаге и почти во всех других типах копировальной бумаги.
Его также используют для тонирования серебряно-желатиновых фотоотпечатков (см. Тонирование сепией ).
Тиомочевина используется в процессах блестящей и полублестящей гальваники Clifton-Phillips и Beaver. [10] Он также используется в растворе с хлоридом олова (II) в качестве раствора для химического лужения медных печатных плат .
Тиомочевины используются (обычно в качестве катализаторов-доноров водородных связей ) в теме исследований, называемой органокатализом тиомочевины . [11] Тиомочевины часто оказываются более сильными донорами водородных связей ( т.е. более кислыми), чем мочевины . [12] [13]
Реакции
[ редактировать ]Материал обладает необычным свойством превращаться в тиоцианат аммония при нагревании выше 130 °C . При охлаждении соль аммония снова превращается в тиомочевину. [ нужна ссылка ]
Восстановитель
[ редактировать ]Тиомочевина восстанавливает пероксиды до соответствующих диолов . [14] Промежуточным продуктом реакции является нестабильный эндопероксид .

Тиомочевина также используется при восстановительной обработке озонолиза с получением карбонильных соединений. [15] Диметилсульфид также является эффективным реагентом для этой реакции, но он очень летуч (температура кипения 37 ° C ) и имеет неприятный запах, тогда как тиомочевина не имеет запаха и практически нелетучая (что отражает ее полярность).

Источник сульфида
[ редактировать ]Тиомочевина используется в качестве источника сульфида, например, для преобразования алкилгалогенидов в тиолы. Реакция основана на высокой нуклеофильности серного центра и легком гидролизе промежуточной изотиурониевой соли :
- CS(NH 2 ) 2 + RX → RSC(NH 2 ) + 2 X −
- РСК(NH 2 ) + 2 Х − + 2 NaOH → RNa + OC(NH 2 ) 2 + NaX + H 2 O
- RSNa + HCl → RSH + NaCl
В этом примере этан-1,2-дитиол получают из 1,2-дибромэтана : [16]
- C 2 H 4 Br 2 + 2 SC(NH 2 ) 2 → [C 2 H 4 (SC(NH 2 ) 2 ) 2 ]Br 2
- [C 2 H 4 (SC(NH 2 ) 2 ) 2 ]Br 2 + 2 KOH → C 2 H 4 (SH) 2 + 2 OC(NH 2 ) 2 + 2 KBr
Как и другие тиоамиды , тиомочевина может служить источником сульфида при реакции с ионами металлов. Например, сульфид ртути образуется при обработке солей ртути в водном растворе тиомочевиной:
- ртуть 2+ + SC(NH 2 ) 2 + H 2 O → HgS + OC(NH 2 ) 2 + 2 H +
Эти реакции сульфидирования, которые применялись для синтеза многих сульфидов металлов, требуют воды и, как правило, некоторого нагрева. [17] [18]
Предшественник гетероциклов
[ редактировать ]Тиомочевины являются строительными блоками производных пиримидина . Таким образом, тиомочевины конденсируются с β-дикарбонильными соединениями. [19] Аминогруппа тиомочевины первоначально конденсируется с карбонилом, после чего следует циклизация и таутомеризация. Десульфурация дает пиримидин.
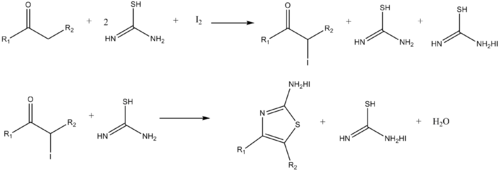
Аналогичным образом аминотиазолы могут быть синтезированы реакцией α-галогенкетонов и тиомочевины. [20]
Фармацевтические препараты тиобарбитуровая кислота и сульфатиазол получают с использованием тиомочевины. [7] 4-Амино-3-гидразино-5-меркапто-1,2,4-триазол получают реакцией тиомочевины и гидразина .
Полировка серебра
[ редактировать ]Согласно этикетке на потребительских товарах TarnX [21] и Серебряный Дип , [22] жидкие средства для чистки серебра содержат тиомочевину, а также имеется предупреждение о том, что тиомочевина является химическим веществом, внесенным в . список канцерогенов Калифорнии [23] Выщелачиватель для выщелачивания золота и серебра можно создать путем селективного окисления тиомочевины, минуя стадии использования цианида и плавки. [24]
Реакция Курнакова
[ редактировать ]Тиомочевина является важным реагентом в тесте Курнакова, используемом для дифференциации цис- и транс -изомеров некоторых плоских квадратных платины комплексов . Реакция была открыта в 1893 году русским химиком Николаем Курнаковым и до сих пор используется для анализа соединений этого типа. [25]
Безопасность
[ редактировать ]LD 125 50 для тиомочевины составляет мг/кг для крыс (перорально). [26]
эффекте (увеличении щитовидной железы) при хроническом воздействии, что отражает способность тиомочевины препятствовать поглощению йода. зобогенном Сообщалось о [7]
Циклическое производное тиомочевины под названием Тиамазол используется для лечения гиперактивности щитовидной железы.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Фавр, Анри А.; Пауэлл, Уоррен Х. (2014). Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . стр. 98, 864. doi : 10.1039/9781849733069 . ISBN 9780854041824 . OCLC 1077224056 .
- ^ «тиомочевина» . Lexico Британский словарь английского языка . Издательство Оксфордского университета . Архивировано из оригинала 22 марта 2020 г.
- ^ «тиомочевина» . Словарь Merriam-Webster.com . Проверено 21 января 2016 г.
- ^ «тиомочевина» . Dictionary.com Полный (онлайн). nd
- ^ Д. Маллен; Э. Хеллнер (1978). «Простое уточнение распределения плотности связывающих электронов. IX. Распределение плотности электронов связи в тиомочевине, CS(NH 2 ) 2 , при 123 К». Акта Кристаллогр . Б34 (9): 2789–2794. Бибкод : 1978AcCrB..34.2789M . дои : 10.1107/S0567740878009243 .
- ^ Аллегретти, ЧП; Кастро, Э.А.; Ферлонг, JJP (март 2000 г.). «Таутомерное равновесие амидов и родственных соединений: теоретические и спектральные доказательства». Журнал молекулярной структуры: THEOCHEM . 499 (1–3): 121–126. дои : 10.1016/S0166-1280(99)00294-8 .
- ^ Jump up to: а б с д и Мерченк, Бернд; Бек, Фердинанд; Бауэр, Вольфганг (2002). «Тиомочевина и производные тиомочевины». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.a26_803 . ISBN 3527306730 .
- ^ Вахид, Абдул (1 августа 2017 г.). «Тиомочевина: молекула, имеющая огромное биологическое значение для растений» (PDF) . Международный журнал сельского хозяйства и биологии . 19 (4): 911–920. дои : 10.17957/ijab/15.0464 . ISSN 1560-8530 . Архивировано (PDF) из оригинала 15 февраля 2020 г. Проверено 9 декабря 2020 г.
- ^ Фостер, HM; Снайдер, HR (1955). «4-Метил-6-гидроксипиримидин». Органические синтезы . 35 : 80. дои : 10.15227/orgsyn.035.0080 .
- ^ «81-е универсальное руководство по чистовой обработке металлов» . Отделка металла, путеводитель и справочник . Журнал Metal Finishing : 285. Осень 2013 г. ISSN 0026-0576 . Архивировано из оригинала 17 ноября 2017 г. Проверено 11 октября 2016 г.
- ^ Р. Шрайнер, Питер (2003). «Безметалловый органокатализ посредством явных взаимодействий водородных связей». хим. Соц. Преподобный . 32 (5): 289–296. дои : 10.1039/b107298f . ПМИД 14518182 .
- ^ Якаб, Гергеи; Танкон, Карло; Чжан, Чжиго; Липперт, Катарина М.; Шрайнер, Питер Р. (2012). «(Тио)мочевинный органокатализатор, равновесные кислоты в ДМСО». Органические письма . 14 (7): 1724–1727. дои : 10.1021/ol300307c . ПМИД 22435999 .
- ^ Ньюланд, Селин; Фонсека Герра, Селия (2022). «Как размер атома халькогена определяет способность карбоксамидов, тиоамидов и селеноамидов быть донорами водородных связей» . Химия – Европейский журнал . 28 (31): e202200755. дои : 10.1002/chem.202200755 . ПМЦ 9324920 . ПМИД 35322485 .
- ^ Канеко, К.; Сугиморо, А.; Танака, С. (1974). «Простой одностадийный синтез цис -2-циклопентена и цис -2-циклогексен-1,4-диолов из соответствующих циклодиенов» . Синтез . 1974 (12): 876–877. дои : 10.1055/s-1974-23462 . S2CID 93207044 . Архивировано из оригинала 12 июня 2021 г. Проверено 18 июня 2022 г.
- ^ Гупта Д., Соман Г. и Дев С. (1982). «Тиомочевина – удобный реагент для восстановительного расщепления продуктов озонолиза олефинов». Тетраэдр . 38 (20): 3013–3018. дои : 10.1016/0040-4020(82)80187-7 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Специале, AJ (1963). «Этандитиол» . Органические синтезы ; Сборник томов , т. 4, с. 401 .
- ^ Лян, Ю.; и др. (2016). «Эффективный предшественник для синтеза различных наноструктур FeS2 с помощью простого метода гидротермального синтеза». CrystEngComm . 18 (33): 6262–6271. дои : 10.1039/c6ce01203e .
- ^ Бао, Н.; и др. (2007). «Простой термолизный синтез комплекса Cd-тиомочевины фазово-контролируемых нанокристаллов CdS для фотокаталитического производства водорода в видимом свете». Журнал физической химии C. 111 (47): 17527–17534. дои : 10.1021/jp076566s .
- ^ Фостер, Х.М., и Снайдер, Х.Р. (1963). «4-Метил-6-гидроксипиримидин» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 4, с. 638 . - ^ Додсон, Р.М. и Кинг, Л.К. (1945). «Реакция кетонов с галогенами и тиомочевиной». Дж. Ам. хим. Соц. 67 (12): 2242–2243. дои : 10.1021/ja01228a059 . ПМИД 21005695 .
- ^ «Средство для удаления потускнения Tarn-X PRO» (PDF) . The Betty Mills Company, Inc. Архивировано (PDF) оригиналом 6 июня 2021 г. Проверено 6 июня 2021 г.
- ^ «Серебряный соус Хагерти» . JL Smith & Co. Архивировано из оригинала 6 июня 2021 г. Проверено 6 июня 2021 г.
- ^ Ускоренные значения канцерогенности и предлагаемые уровни регулирования для некоторых канцерогенов согласно Предложению 65 (PDF) (Отчет). Апрель 1992 г. Архивировано (PDF) из оригинала 21 января 2022 г. Проверено 18 июня 2022 г.
- ^ Эспозито, Энтони (13 июля 2007 г.). «Пеньолес и UAM представили пилотную установку по выщелачиванию тиомочевины Au-Ag в Мексике» . Деловые новости Америки. Архивировано из оригинала 17 февраля 2009 года.
- ^ Кауфман, Джордж Б. (январь 1983 г.). «Николай Семенович Курнаков, реакция (1893) и человек (1860–1941) девяностолетняя ретроспектива» . Многогранник . 2 (9): 855–863. дои : 10.1016/S0277-5387(00)81400-X . ISSN 0277-5387 . Архивировано из оригинала 28 марта 2021 г. Проверено 9 декабря 2020 г.
- ^ «Тиомочевина и ее свойства» . 11 сентября 1986 года. Архивировано из оригинала 27 мая 2010 года . Проверено 6 января 2012 г.
Дальнейшее чтение
[ редактировать ]- Патай, Саул (1977). Химия функциональных групп с двойной связью . Нью-Йорк, штат Нью-Йорк: Джон Уайли и сыновья. стр. 1355 –1496. ISBN 9780471924937 . OCLC 643207498 .