Органолитный реагент
В органометаллической химии реагенты органолита представляют собой химические соединения , которые содержат углерода - литий (C - LI) связи . Эти реагенты важны для органического синтеза и часто используются для переноса органической группы или атома лития в субстраты синтетическими этапами, посредством нуклеофильного добавления или простого депротонирования . [ 1 ] Органолитные реагенты используются в промышленности в качестве инициатора анионной полимеризации , что приводит к производству различных эластомеров . Они также были применены в асимметричном синтезе в фармацевтической промышленности. [ 2 ] Благодаря большой разнице в электроотрицательности между атомом углерода и атомом лития, связь C -LI очень ионная . Благодаря полярной природе связи C -Li, органолитные реагенты являются хорошими нуклеофилами и сильными основаниями. Для лабораторного органического синтеза многие реагенты органолита имеют коммерчески доступны в форме раствора. Эти реагенты очень реактивны и иногда являются пирофорическими .


История и развитие
[ редактировать ]Исследования реагентов органолита начались в 1930 -х годах и были впервые представлены Карлом Циглером , Георгом Виттигом и Генри Гилманом . По сравнению с реагентами Grignard (магний) , реагенты органолита часто могут выполнять те же реакции с увеличением скорости и более высокими урожаями, например, в случае металлации . [ 3 ] С тех пор реагенты органолита обогнали реагенты Grignard в общем использовании. [ 4 ]
Структура
[ редактировать ]Хотя простые виды алкиллития часто представлены как мономер RLI, они существуют как агрегаты ( олигомеры ) или полимеры. [ 5 ] Степень агрегации зависит от органического заместителя и наличия других лигандов. [ 6 ] [ 7 ] Эти структуры были выяснены различными методами, в частности 6 ЧТО, 7 Ли и 13 C ЯМР-спектроскопия и рентгеновский дифракционный анализ. [ 1 ] Вычислительная химия поддерживает эти задания. [ 5 ]
Природа углеродной линии связи
[ редактировать ]
Относительная электроотрицательность углерода и лития предполагает, что связь C -LI будет очень полярной. [ 8 ] [ 9 ] [ 10 ] Тем не менее, некоторые соединения организма обладают свойствами, такими как растворимость в неполярных растворителях, которые усложняют проблему. [ 8 ] В то время как большинство данных предполагают, что связь C -LI по существу является ионной, в ней были споры о том, сколько в ней существует ковалентный характер. [ 9 ] [ 10 ] Одна оценка устанавливает процент ионного характера соединений алкиллития со скоростью 80-88%. [ 11 ]
В литиевых соединениях литий -катион координируется на поверхности углеродной π -связи в η 3 Мода вместо локализованного карбанионического центра, таким образом, аллиллиты часто менее агрегируются, чем алкиллиты. [ 6 ] [ 12 ] В комплексах ариллития литий -катион координирует в одном центре Карбаниона через связь типа Li -C σ. [ 6 ] [ 13 ]
Структура твердого состояния
[ редактировать ]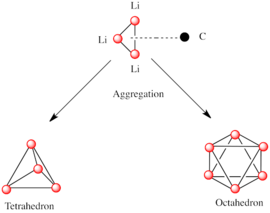
Как и другие виды, состоящие из полярных субъединиц, агрегируют виды организма. [ 7 ] [ 14 ] На формирование агрегатов влияет электростатические взаимодействия, координация между литием и окружающими молекулами растворителя или полярными добавками, а также стерические эффекты. [ 7 ]
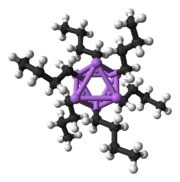
Основным строительным блоком к созданию более сложных структур является карбанионовый центр, взаимодействующий с треугольником Li 3 в η 3 - мода. [ 5 ] В простых алкиллитиальных реагентах эти треугольники объединяются с образованием тетраэдровских или октаэдровых структур. Например, метиллитий , этиллитий и террт -бутиллит все существуют в тетрамере [rli] 4 . Метиллитий существует в виде тетрамеров в кластере кубинного типа в твердом состоянии, с четырьмя литийными центрами образуются тетраэдр. Каждый метанид в тетрамере в метиллите может иметь агостическое взаимодействие с катионами литиевых катионов в соседних тетрамерах. [ 5 ] [ 7 ] Этиллития и трет -бутиллит, с другой стороны, не демонстрируют это взаимодействие и, таким образом, растворимы в неполярных углеводородных растворителях. Другой класс алкиллития принимает гексамерные структуры, такие как n -бутиллит , изопропипиллит и циклогексанллит. [ 5 ]
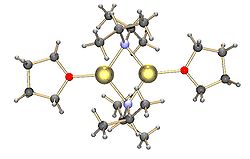
Общие амиды лития, например, литий -бис (триметилсилил) амид и литий -диизопропиламид , также подвержены агрегации. [ 15 ] Литийские амиды принимают структуры типа полимерной базы в неординирующем растворителе в твердом состоянии, и они обычно существуют в виде димеров в эфирных растворителях. В присутствии сильно пожертвовавших лигандов образуются три- или тетрамерные литий-центры. [ 16 ] Например, LDA существует в основном как димеры в THF. [ 15 ] Структуры общих литий -амидов, таких как литий -диизопропиламид (LDA) и гексаметидизилазид лития и литий -гексаметидизилазид (LIHMDS), были тщательно изучены колламом и коллегами с использованием ЯМР -спектроскопии . [ 17 ] Другим важным классом реагентов являются силиллиты, широко используемые в синтезе органометаллических комплексов и полисилановых дендримеров . [ 7 ] [ 18 ] В твердом состоянии, в отличие от реагентов алкиллития, большинство силиллитов, как правило, образуют мономерные структуры, координированные с молекулами растворителя, такими как THF, и только несколько силиллитов были охарактеризованы как более высокие агрегаты. [ 7 ] Это различие может возникнуть из -за метода приготовления силиллитов, стерического препятствия, вызванного громоздкими алкильными заместителями на кремнии, и менее поляризованной природы связей Si -Li. Добавление сильно пожертвовавших лигандов, таких как TMEDA и (-)- Спартейн , может вытеснить координирующие молекулы растворителя в силиллитах. [ 7 ]
Структура решения
[ редактировать ]Это возможно для органолитических реагентов, принимающих структуры в растворе, которые отличаются от твердого состояния. [ 6 ] [ 19 ] ЯМР -спектроскопия стала мощным инструментом для исследований агрегатов организма в растворе. Для видов алкиллития, C -Li J -сочетание часто может использовать для определения количества лития, взаимодействующего с центром карбаниона, и являются ли эти взаимодействия статическими или динамичными. [ 6 ] Отдельные сигналы ЯМР также могут дифференцировать наличие нескольких агрегатов от общей мономерной единицы. [ 20 ]
Соединения органолита связывают основания Льюиса, такие как тетрагидрофуран (ТГФ), диэтиловый эфир (ET 2 O), тетраметилэтиленамин (TMEDA) или гексаметилфосфорамид (HMPA). [ 5 ] Метиллитий является особым случаем: его тетрамерная структура не зависит от эфира или даже HMPA. [ 7 ] С другой стороны, THF Deaggregerte Hexameric Bityl Lithium: тетрамер является основным видом, а Δg для взаимосвязи между тетрамером и димером составляет около 11 ккал/моль. [ 21 ] TMEDA также может хелатировать до катионов лития в N -бутиллитии и сольватированных димерах, таких как [(tmeda) Libu -N)] 2 . [ 5 ] [ 6 ] Было показано, что фениллитий существует в виде искаженного тетрамера в кристаллизованном эфирном сольвате и в качестве смесь димера и тетрамера в эфирном растворе. [ 6 ]
| Алкильная группа | Растворитель | Структура |
|---|---|---|
| метил | ТГФ | тетрамер |
| Эфир/HMPA | тетрамер | |
| n -бутил | Пентатан | гексамер |
| эфир | тетрамер | |
| ТГФ | тетрамер-димер | |
| Sec - бутил | Пентатан | Гексамер-тетрамер |
| изопропил | Пентатан | Гексамер-тетрамер |
| Терт -бутил | Пентатан | тетрамер |
| ТГФ | мономер | |
| фенил | эфир | тетрамер-димер |
| Эфир/HMPA | димер |
Структура и реактивность
[ редактировать ]По мере того, как структуры реагентов органолита меняются в соответствии с их химической средой, так и их реактивность и селективность. [ 7 ] [ 22 ] Один вопрос, окружающий структурно-реактивность, заключается в том, существует ли корреляция между степенью агрегации и реакционной способностью органолитов. Первоначально было предложено, чтобы нижние агрегаты, такие как мономеры, более реактивны в алкиллициях. [ 23 ] Однако пути реакции, в которых димер или другие олигомеры являются реактивными видами, также были обнаружены, были обнаружены, [ 24 ] и для литий-амидов, таких как LDA, распространены реакции на основе димеров. [ 25 ] Серия исследований кинетики растворов в LDA-опосредованных реакциях позволяет предположить, что более низкие агрегаты энолятов не обязательно приводят к более высокой реактивности. [ 17 ]
Кроме того, некоторые базы Льюиса повышают реакционную способность органических соединений. [ 26 ] [ 27 ] Однако, функционируют ли эти добавки как сильные хелатирующие лиганды, и то, как наблюдаемое повышение реакционной способности связано со структурными изменениями в агрегатах, вызванных этими добавками, не всегда ясно. [ 26 ] [ 27 ] Например, TMEDA увеличивает скорости и эффективность во многих реакциях с участием органолитных реагентов. [ 7 ] На пути к реагентам на алкиллитие TMEDA функционирует как донорский лиганд, уменьшает степень агрегации, [ 5 ] и увеличивает нуклеофильность этих видов. [ 28 ] Тем не менее, TMEDA не всегда функционирует как донорский лиганд для литий -катиона, особенно в присутствии анионных центров кислорода и азота. Например, он только слабо взаимодействует с LDA и LIHMDS даже в углеводородных растворителях без конкурирующих донорских лигандов. [ 29 ] В литиации имине, в то время как ТГФ действует как сильный пожертвований лиганда для лигандов, слабо координируя TMEDA легко диссоциирует от лихмдов, что приводит к образованию димеров LIHMDS, что является более реактивным видом. Таким образом, в случае LIHMDS TMEDA не увеличивает реактивность за счет снижения состояния агрегации. [ 30 ] Кроме того, в отличие от простых алкиллитийных соединений, TMEDA не дезагреет литио-ацетофенолат в растворе ТГФ. [ 6 ] [ 31 ] Добавление HMPA к литий -амидам, таким как LIHMDS и LDA, часто приводит к смесью агрегатов димер/мономера в THF. Однако отношение видов димер/мономера не изменяется с увеличением концентрации HMPA, поэтому наблюдаемое повышение реакционной способности не является результатом деаггации. Механизм того, как эти добавки повышают реактивность, все еще исследуются. [ 22 ]
Реакционная способность и приложения
[ редактировать ]Связь C -Li в реагентах органолита сильно поляризована. В результате углерод привлекает большую часть плотности электронов в связи и напоминает карбанион. Таким образом, реагенты органолита сильно являются основными и нуклеофильными. Некоторые из наиболее распространенных применений реагентов организма в синтезе включают их использование в качестве нуклеофилов, сильные основания для депротонирования, инициатор полимеризации и начальный материал для приготовления других органометаллических соединений.
Как нуклеофил
[ редактировать ]Реакции карболитиации
[ редактировать ]Как нуклеофилы, реагенты органолита подвергаются реакциям карболетиации, в результате чего углеродная связь добавляет через углеродную - углеродную двойную или тройную связь, образуя новые виды органолита. [ 32 ] Эта реакция является наиболее широко используемой реакцией органических соединений. Карболетиация является ключевым в процессах анионной полимеризации, и N -бутиллит используется в качестве катализатора для инициирования полимеризации стирола , бутадиена или изопрена или их смесей. [ 33 ] [ 34 ]
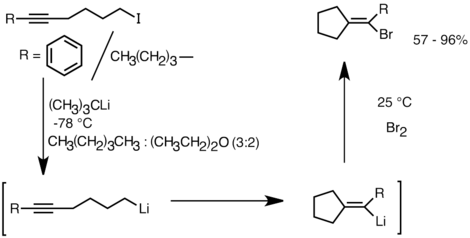
Другим применением, которое использует эту реакционную способность, является образование карбоциклических и гетероциклических соединений с помощью внутримолекулярной карболетиации. [ 32 ] В качестве формы анионной циклизации реакции внутримолекулярной карболетиации предлагают несколько преимуществ по сравнению с радикальной циклизацией . Во -первых, для продукта циклических видов органолита реагируют с электрофилами, тогда как часто трудно поймать радикальный промежуток соответствующей структуры. Во-вторых, анионные циклизации часто более регио- и стереоспецифической, чем радикальная циклизация, особенно в случае 5-гексениллитов. Внутримолекулярная карболетиация позволяет добавлять алкил-, виниллитиум в тройные связи и моно-алкильные двойные связи. Ариллиты также могут подвергаться дополнению, если образуется кольцо с 5 членами. Ограничения внутримолекулярной карболетиации включают в себя сложность образования 3 или 4-членных колец, поскольку промежуточные виды циклического организма часто имеют тенденцию подвергаться кольцам. [ 32 ] Ниже приведен пример внутримолекулярной реакции карболетиации. Виды лития, полученные в результате обмена литий-галогенов, циклизовались, чтобы сформировать виниллит через закрытие кольца с 5 экзо-обработкой. Виды винллитов дополнительно реагируют с электрофилами и производят функционализированные циклопентилиденные соединения. [ 35 ]
Дополнение к карбонильным соединениям
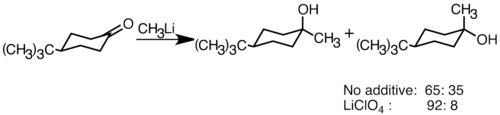
[ редактировать ]Нуклеофильные органолитические реагенты могут добавить к электрофильным карбонильным двойным связям с образованием углеродных связей . Они могут реагировать с альдегидами и кетонами на производство спиртов . Добавление происходит в основном через полярное добавление, при котором я нуклеофильные виды органолита атакуют с экваториального направления и производит осевой спирт. [ 36 ] Добавление литиевых солей, таких как LICLO 4 , может улучшить стереоселективность реакции. [ 37 ]
Когда кетон стерильно затруднен, использование реагентов Grignard часто приводит к снижению карбонильной группы вместо добавления. [ 36 ] Тем не менее, реагенты алкиллития с меньшей вероятностью снижают кетон и могут использоваться для синтеза замещенных спиртов. [ 38 ] Ниже приведен пример дополнения этиллитию к адамантону для получения третичного алкоголя. [ 39 ]
Органолитные реагенты также лучше, чем реагенты Grignard в их способности реагировать с карбоновыми кислотами с образованием кетонов. [ 36 ] Эта реакция может быть оптимизирована, тщательно контролируя количество добавления органолитового реагента или с использованием триметилсилил хлорид для гашения избыточного литийного реагента. [ 40 ] Более распространенным способом синтеза кетонов является добавление органолитных реагентов к амидам Вайнреб ( N -метокси -н -метилмиды). Эта реакция обеспечивает кетоны, когда реагенты организма используются в избытке из -за хелатирования иона лития между N -метокси кислородом и карбонильным кислородом, который образует тетраэдрический промежуточный соединение, которое рушится кислой работой. [ 41 ]
Органолитные реагенты также реагируют с углекислым газом для формирования после образования, карбоновые кислоты . [ 42 ]
В случае субстратов enone , где возможны два участка нуклеофильного добавления (1,2 добавления карбонильного углерода или 1,4 конъюгатного добавления к β -углероду), наиболее высокореактивные виды органолита способствуют добавлению 1,2, однако,, однако,, однако,, однако,, как Существует несколько способов продвижения реагентов органолита, чтобы пройти сопряжение. Во -первых, поскольку аддукт 1,4, вероятно, будет более термодинамически благоприятным видом, добавление конъюгата может быть достигнуто за счет уравновешивания (изомеризации двух продуктов), особенно когда литий -нуклеофил является слабым, а добавление 1,2 обратимо. Во-вторых, добавление донорских лигандов в реакцию образует гетероатомом, стабилизированные видами лития, что способствует 1,4 конъюгату добавления. В одном примере добавление низкого уровня HMPA к растворителю способствует добавлению 1,4. В отсутствие донорского лиганда литий -катион тесно скоординируется с атомом кислорода, однако, когда литий -катион сольволируется HMPA, координация между карбонильным кислородом и ионом лития ослаблена. Этот метод, как правило, не может быть использован для влияния на региоселективность реагентов алкил- и ариллития. [ 43 ] [ 44 ]
Органолитные реагенты также могут выполнять энантиоселективное нуклеофильное дополнение к карбонилу и его производным, часто в присутствии хиральных лигандов. Эта реакционная способность широко применяется в промышленных синтезах фармацевтических соединений. Примером является синтез Merck и Dupont Efavirenz , мощного ВИЧ ингибитора обратной транскриптазы . Литий ацетилд добавляется к прочиральному кетону, чтобы получить хиральный алкогольный продукт. Структуру промежуточного соединения активной реакции определяли исследованиями ЯМР-спектроскопии в состоянии раствора и рентгеновской кристаллографией твердого состояния, которое является тетрамером кубического 2: 2. [ 45 ]
S N 2 реакции типа
[ редактировать ]Органолитные реагенты могут служить нуклеофилами и выполнять реакции типа S 2 с алкильными или аллиловыми галогенками. [ 46 ] Хотя они считаются более реактивными, чем реагенты Grignard в алкилировании, их использование по -прежнему ограничено из -за конкурирующих побочных реакций, таких как радикальные реакции или обмен галогенами металла . Большинство реагентов органолитов, используемых в алкилированиях, являются более стабилизированными, менее базовыми и менее агрегированными, такие как гетероатом, стабилизированные, реагенты алил или аллиллит. [ 6 ] Было показано, что HMPA увеличивает скорость реакции и урожайность продукта, а реакционная способность реагентов ариллития часто увеличивается за счет добавления алкоксидов калия. [ 36 ] Органолитные реагенты также могут проводить нуклеофильные атаки с эпоксидами с образованием спиртов.
Как база
[ редактировать ]Органолитные реагенты обеспечивают широкий спектр основной основы . Терт -бутиллитий , с тремя слабыми электронами, пожертвовающими алкильные группы, является наиболее прочной базой, имеющейся в продаже ( PKA = 53). В результате кислые протоны на -OH, -NH и -SH часто защищены в присутствии органолитных реагентов. Некоторые обычно используемые литийные основания представляют собой виды алкиллития, такие как N -бутиллит и литий -диалкиламиды (LINR 2 ). Реагенты с громоздкими R -группами, такими как литий -диизопропиламид (LDA) и литий -бис (тримитилсилил) амид (LIHMD), часто стерически затруднены для нуклеофильного добавления и, таким образом, более селективны к депротонированию. Литий -диалкиламиды (LINR 2 ) широко используются в образовании еноляции и реакции альдола . [ 47 ] На реакционную способность и селективность этих оснований также влияют растворители и другие противоположные ионы.
Металлы
[ редактировать ]Металлотация с реагентами организма, также известным как литирование или обмен литий-гидрогенами, достигается, когда реагент органолита, чаще всего алкиллит, абстрагирует протон и образует новые виды организма.
| ( 1 ) |
Общие металлевые реагенты - это бутиллиты. Терт -бутиллит и сек -бутиллит, как правило, более реактивны и имеют лучшую селективность, чем n -бутиллит, однако они также более дороги и трудно справиться. [ 47 ] Метазация является распространенным способом приготовления универсальных органолитовых реагентов. Положение металла в основном контролируется кислотностью связи СН. Литиация часто встречается в положении α в группы снятия электронов, поскольку они хорошо стабилизируют электронную плотность аниона. Направление групп по ароматическим соединениям и гетероциклам обеспечивает региоселективные места металлов; Режиссер -орто -металлуация является важным классом реакций на металлы. Металлированные сульфоны, ацильные группы и α-металко-амиды являются важными промежуточными звенами в синтезе химии. Металлация аллильного эфира с алкиллитом или LDA образует анион α для кислорода и может перейти к перестройке 2,3-шишки . Добавление донорских лигандов, таких как TMEDA и HMPA, может увеличивать скорость металлов и расширить объем субстрата. [ 48 ] Хиральные органолитические реагенты можно получить через асимметричную металлацию. [ 49 ]
Направленная орто -металлургия является важным инструментом в синтезе региоспецифических заменяемых ароматических соединений. Такой подход к литиации и последующему гашению промежуточных видов лития с помощью электрофила часто лучше, чем электрофильная ароматическая замещение из -за его высокой региоселективности. Эта реакция проходит посредством депротонирования реагентами органолита в положениях α в группу прямых металлов (DMG) на ароматическом кольце. DMG часто является функциональной группой, содержащей гетероатом , который является базовым Lewis, и может координироваться с литий-катинией Льюиса. Это генерирует комплексный эффект близости, который направляет депротонирование в положении α с образованием вида ариллития, который может в дальнейшем реагировать с электрофилами. Некоторые из наиболее эффективных DMG - амиды, карбаматы , сульфоны и сульфонамиды . Это сильные группы электронов, которые увеличивают кислотность альфа-протонов на ароматическом кольце. В присутствии двух DMG металлы часто встречаются в отношении более сильной режиссерской группы, хотя также наблюдаются смешанные продукты. Ряд гетероциклов, которые содержат кислые протоны, также могут подвергаться орто-отображению. Тем не менее, для гетероциклов, бедных электронами, обычно используются литиевые амидные основания, такие как LDA, поскольку, как наблюдалось алкиллит, выполняет дополнение к гетероциклам с бедными электронами, а не депротонированием. В определенных комплексах переходных металлов, таких как Фероцен , переходный металл привлекает электронную плотность из Арен, что делает ароматические протоны более кислыми и готовыми к орто-металанации. [ 50 ]
Супербазы
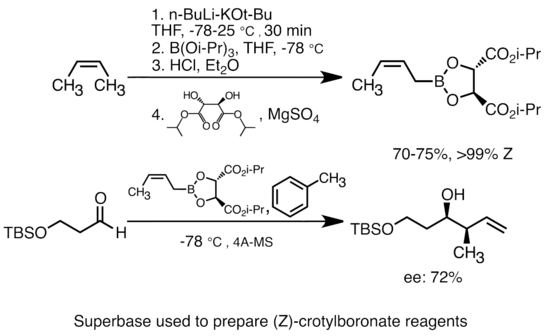
[ редактировать ]Добавление калия алкаксида к алкиллитию значительно увеличивает основность видов органолита. [ 51 ] Наиболее распространенная «супербаза» может быть сформирована путем добавления котбу к бутиллитию, часто сокращенной как реагенты "ликир". Эти «супербазы» являются очень реактивными и часто стереоселективными реагентами. В приведенном ниже примере основание Lickor генерирует стереоспецифические виды кротилбоната посредством металлаций и последующего обмена литием-металлоида. [ 52 ]
Асимметричная металла
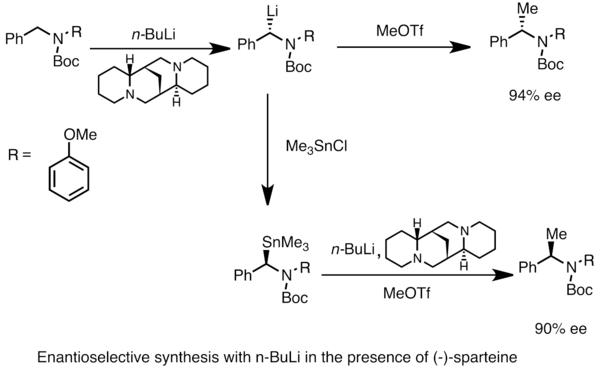
[ редактировать ]Enantioenriched Force Voics можно получить посредством асимметричной металлы прочеральных субстратов. Асимметричная индукция требует наличия хирального лиганда, такого как (-)- Спартейн . [ 49 ] Энантиомерное соотношение видов хирального лития часто зависит от различий в скоростях депротонирования. В приведенном ниже примере лечение N -boc -n -бензиламина с n -бутиллитом в присутствии ( -) -Спартейн дает один энантиомер продукта с высоким энантиомерным избытком . Трансмитация с триметилтинхлоридом дает противоположный энантиомер. [ 53 ]
Формирование эннелята
[ редактировать ]лития Эноляты образуются путем депротонирования связи C -H с карбонильной группой видами организма. Эноляты лития широко используются в качестве нуклеофилов в реакциях формирования углеродных связей , таких как конденсация альдола и алкилирование. Они также являются важным промежуточным звеном в формировании эфира силила enol .
Образование энолата лития может быть обобщено в виде кислотной реакции , в которой относительно кислотный протон α к карбонильной группе (PK = 20-28 в ДМСО) реагирует с основанием организма. Как правило, используются сильные некулеофильные основания, особенно литийные амиды, такие как LDA, LIHMD и LITMP. ТГФ и ДМСО являются общими растворителями в реакциях лития энолята. [ 54 ]
Стереохимия и механизм формирования энолята вызвали большой интерес к химическому сообществу. Многие факторы влияют на исход стереохимии еноляции, такие как стерические эффекты, растворитель, полярные добавки и типы оснований организма. Среди множества моделей, используемых для объяснения и прогнозирования селективности в стереохимии литиевых энолятов, является модель Ирландии. [ 55 ]
В этом предположении мономерный LDA реагирует с карбонильным субстратом и образует циклическое переходное состояние типа Циммермана - Traxler . (E) -енолят предпочитается из-за неблагоприятного син-пентанского взаимодействия в переходном состоянии (z)-экнолят. [ 54 ]
Добавление полярных добавок, таких как HMPA или DMPU, способствует образованию (z) enolates. Модель Ирландии утверждает, что эти донорские лиганды координируются с катионами литий, в результате чего карбонильный кислород и литиевый взаимодействие уменьшается, а переходное состояние не так тесно связано, как шести членов. Процент (z) enolates также увеличивается, когда используются литийные основания с более крупными боковыми цепями (например, LIHMDS). [ 54 ] Тем не менее, механизм того, как эти добавки обратной стереоселективности все еще обсуждаются.
Были некоторые проблемы с моделью Ирландии, поскольку она изображает виды лития как мономер в переходном состоянии. В действительности, различные литиевые агрегаты часто наблюдаются в растворах энолятов лития, и в зависимости от конкретного субстрата, растворителя и условий реакции может быть трудно определить, какой агрегат является фактическим реактивным видом в растворе. [ 54 ]
Обмен литий -галогенами
[ редактировать ]Обмен литий -галогенами включает обмен гетероатомом между органогалидом и органолитом.
| ( 2 ) |
Обмен литий -галогенами очень полезен при приготовлении новых органолитических реагентов. Применение обмена литий -галогенами иллюстрируется циклизацией Пархама. [ 56 ]
Передача
[ редактировать ]Органолитные реагенты часто используются для приготовления других органометаллических соединений путем передачи. Соединения органокоппера, органотина , органозиликона, органоборона, органофосфора, органоцериума и органосульфура часто получают с помощью реагентов органолитов с соответствующими электрофилами.
| ( 3 ) |
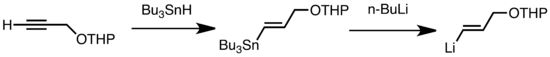
Общие типы передачи включают обмен LI/SN, LI/HG и LI/TE, которые быстро при низкой температуре. [ 47 ] Преимущество обмена LI/SN состоит в том, что предшественники триолкилстаннана подвергаются мало побочным реакциям, поскольку получающие результаты побочных продуктов N-Bu 3 SN не реагируют в отношении реагентов алкиллитию. [ 47 ] В следующем примере винилстанан, полученный гидростанилированием терминального алкина, образует виниллит посредством трансмутации с n-були. [ 57 ]
Органолиний также можно использовать для приготовления органических соединений посредством трансмитации со солями цинка. [ 58 ]
Литий -диорганокурации могут образовываться путем реагирования видов алкильного лития с медовой (i) галогенидом. Полученные органокудраты, как правило, менее реагируют на альдегиды и кетоны, чем реагенты для органолитов или реагенты Grignard. [ 59 ]
Подготовка
[ редактировать ]Наиболее простые реагенты алкиллития и общие литий -амиды коммерчески доступны в различных растворителях и концентрациях. Органолитные реагенты также могут быть приготовлены в лаборатории. Ниже приведены некоторые общие методы для приготовления органолитных реагентов.
Реакция с литием -металлом
[ редактировать ]Снижение алкилгалогенида металлическим литием может позволить себе простые алкил и арилгармолитные реагенты. [ 36 ]
| ( 4 ) |
Промышленное препарат реагентов органолита достигается с использованием этого метода путем обработки алкилхлорида металлом, содержащим 0,5 - 2% натрия . Преобразование очень экзотермическое . Натрий инициирует радикальный путь и увеличивает скорость. [ 60 ] Сокращение проходит через радикальный путь. Ниже приведен пример приготовления функционализированного литийного реагента с использованием восстановления литиевым металлом. [ 61 ] Иногда литий-металл в виде мелких порошков используется в реакции с определенными катализаторами, такими как нафталин или 4,4'-di-t-бутилбифенил (DTBB). Другим субстратом, который может быть уменьшен с помощью литий -металлов для генерации алкиллитиальных реагентов, является сульфиды. Снижение сульфидов полезно при образовании функционализированных органолитических реагентов, таких как альфа-литио-эфиры, сульфиды и силаны. [ 62 ]
Металлы
[ редактировать ]Вторым методом приготовления органолитных реагентов является металл (обмен литий -водородом). Относительная кислотность атомов водорода контролирует положение литирования.
Это наиболее распространенный метод для приготовления алкиниллитийных реагентов, потому что терминальный водород, связанный с углеродом SP , очень кислый и легко депротонирован. [ 36 ] Для ароматических соединений положение литирования также определяется направляющим эффектом заместительных групп. [ 63 ] Некоторые из наиболее эффективных режиссерских заместительных групп - это алкокси, амидо, сульфоксид, сульфонил. Металлирование часто встречается в положении в отношении этих заместителей. В гетероароматических соединениях металлы обычно встречаются в положении или гетероатоме. [ 36 ] [ 63 ]
Обмен литий -галогенами
[ редактировать ]См. Обмен литий -галогенами (в рамках реактивности и применения)
Третий метод приготовления органолитных реагентов - это обмен литийными галогенами.
Терт- бутиллитий или н- бутиллитий являются наиболее часто используемыми реагентами для создания новых видов органолита посредством обмена галогенами лития. Обмен литий -галогена в основном используется для преобразования арила и алкениловых йодидов и бромидов с углеродами SP2 в соответствующие соединения организма. Реакция чрезвычайно быстрая и часто продолжается при -60 до -120 ° C. [ 48 ]
Передача
[ редактировать ]Четвертый метод приготовления органолитных реагентов - это трансмутация. Этот метод может быть использован для подготовки виниллита.
Реакция Шапиро
[ редактировать ]В реакции Шапиро два эквивалента сильного основания алкиллития реагируют с соединениями п-тозилгидразона для получения виниллития или при гашении продукта олефина.
Умение обращаться
[ редактировать ]Соединения органолита являются высокореактивными видами и требуют специализированных методов обработки. Они часто являются коррозионными, легковоспламеняющимися, а иногда и пирофорическими (спонтанное зажигание при воздействии воздуха или влаги). [ 64 ] Реагенты алкиллития также могут подвергаться термическому разложению, образуя соответствующие алкильные виды и гидрид лития. [ 65 ] Органолитные реагенты обычно хранятся ниже 10 ° C. Реакции проводятся с использованием методов без воздуха . [ 64 ] Концентрация реагентов алкиллития часто определяется титрованием . [ 66 ] [ 67 ] [ 68 ]
Органолитные реагенты реагируют, часто медленно, с эфирами, которые, тем не менее, часто используются в качестве растворителей. [ 69 ]
| Растворитель | Температура | N-Bul | Общеизвестный | Театр | Корабль | D 2 = c (oet) -li | Ch 2 = c (sime 3 ) -li |
|---|---|---|---|---|---|---|---|
| ТГФ | −40 ° C. | 338 мин | |||||
| ТГФ | −20 ° C. | 42 мин | |||||
| ТГФ | 0 ° C. | 17 часов | |||||
| ТГФ | 20 ° C. | 107 мин | > 15 ч | 17 часов | |||
| ТГФ | 35 ° C. | 10 мин | |||||
| THF/TMEDA | −20 ° C. | 55 часов | |||||
| THF/TMEDA | 0 ° C. | 340 мин | |||||
| THF/TMEDA | 20 ° C. | 40 мин | |||||
| Эфир | −20 ° C. | 480 мин | |||||
| Эфир | 0 ° C. | 61 мин | |||||
| Эфир | 20 ° C. | 153 ч | <30 мин | 17 д | |||
| Эфир | 35 ° C. | 31 ч | |||||
| Ether/tmeda | 20 ° C. | 603 мин | |||||
| DME | −70 ° C. | 120 мин | 11 мин | ||||
| DME | −20 ° C. | 110 мин | 2 мин | ≪2 мин | |||
| DME | 0 ° C. | 6 мин |
Смотрите также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Рейх, HJ; Борст, Дж. П; Dykstra, RR; Грин, П.Д. (1993). «Спектроскопическая техника ядерного магнитно -резонанса для характеристики структур литий -ионных пар в растворе THF и THF/HMPA». J. Am. Химический Соц 115 (19): 8728–8741. doi : 10.1021/ja00072a028 .
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Забики, Джейкоб (2009). «Аналитические аспекты органических соединений». Химия функциональных групп Патая . John Wiley & Sons, Ltd. Doi : 10.1002/9780470682531.PAT0304 . ISBN 9780470682531 .
- ^ Wu, G.; Хуан, М. (2006). «Реагенты организма в фармацевтических асимметричных процессах». Химический Преподобный 106 (7): 2596–2616. doi : 10.1021/cr040694k . PMID 16836294 .
- ^ Эйш, Джон Дж. (2002). «Генри Гилман: американский пионер в росте органометаллической химии в современной науке и технике †». Органометаллики . 21 (25): 5439–5463. doi : 10.1021/om0109408 . ISSN 0276-7333 .
- ^ Rappoport, Z.; Марек И., ред. (2004). Химия органических соединений (2 части) . John Wiley & Sons, Ltd. ISBN 978-0-470-84339-0 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Стей, Томас; STALKE, DIETMAR (2009). «Священные структуры в литии органической химии». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0298 . ISBN 9780470682531 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Рейх, Ханс Дж. (2013). «Роль агрегатов организма и смешанных агрегатов в механизмах органолита». Химические обзоры . 113 (9): 7130–7178. doi : 10.1021/cr400187u . PMID 23941648 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Strohmann, C; и др. (2009). «Принципы формирования структуры и реакционная способность органических соединений» (PDF) . Химический Евро. Дж . 15 (14): 3320–3334. doi : 10.1002/chem.200900041 . PMID 19260001 .
- ^ Jump up to: а беременный Джеммис, изд; Гопакумар, Г. (2009). «Теоретические исследования по химии органолита». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0297 . ISBN 9780470682531 .
- ^ Jump up to: а беременный Streiwieser, A. (2009). «Перспективы вычислительной органической химии» . J. Org. Химический 74 (12): 4433–4446. doi : 10.1021/jo900497s . PMC 2728082 . PMID 19518150 .
- ^ Jump up to: а беременный Bickelhaupt, FM; и др. (2006). «Ковалента в высокополярных связях. Структура и связь метилалкалиметальных олигомеров (CH3M) N (M = Li -RB; n = 1, 4)». J. Chem. Теория Comput . 2 (4): 965–980. doi : 10.1021/ct050333s . PMID 26633056 .
- ^ Вайс, Эрвин (ноябрь 1993 г.). «Структуры комплексов металловых щелочных металлов и связанных соединений». Angewandte Chemie International Edition на английском языке . 32 (11): 1501–1523. doi : 10.1002/anie.199315013 . ISSN 0570-0833 .
- ^ Fraenkel, G.; Цю, Файанг (1996). «Наблюдение за частично делокализованным аллиличным литием и динамики его 1,3 литий -сигматропного сдвига». J. Am. Химический Соц 118 (24): 5828–5829. doi : 10.1021/ja960440j .
- ^ Фраенкель. G; и др. (1995). «Углеродная связь в мономерном арллите: динамика обмена, релаксации и вращения». J. Am. Химический Соц 117 (23): 6300–6307. doi : 10.1021/ja00128a020 .
- ^ Власть, стр; Надежда Х. (1983). «Изоляция и кристаллические структуры эфирных эфирных комплексов фенида и галогенидов [(phli.et2o) 4] и [(phli.et2o) 3. libr]». Журнал Американского химического общества . 105 (16): 5320–5324. doi : 10.1021/ja00354a022 .
- ^ Jump up to: а беременный Виллиард, PG; Salvino, JM (1993). «Синтез, выделение и структура комплекса LDA-THF». Журнал органической химии . 58 (1): 1–3. doi : 10.1021/jo00053a001 .
- ^ Хилмерссон, Горан; Грандер, Йохан (2009). «Структура и динамика хиральных литий -амидов». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0342 . ISBN 9780470682531 .
- ^ Jump up to: а беременный Коллум, дБ; и др. (2007). «Литий -диизопропиламид: кинетика раствора и последствия для органического синтеза». Ангев. Химический Инт. Редакция 49 (17): 3002–3017. doi : 10.1002/anie.200603038 . PMID 17387670 .
- ^ Sekiguchi, Akira.; и др. (2000). «Lithiosilanes и их применение к синтезу полисилановых дендримеров». Координат Химический Преподобный 210 : 11–45. doi : 10.1016/s0010-8545 (00) 00315-5 .
- ^ Коллум, дБ; и др. (2008). «Структуры раствора литий-энолятов, фенолатов, карбоксилатов и алкоксидов в присутствии N, N, N ', N'-тетраметилэтилендиамин: распространенность циклических димеров» . J. Org. Химический 73 (19): 7743–7747. doi : 10.1021/jo801532d . PMC 2636848 . PMID 18781812 .
- ^ Рейх, HJ; и др. (1998). «Агрегация и реакционная способность растворов фениллития». J. Am. Химический Соц 120 (29): 7201–7210. doi : 10.1021/ja980684z .
- ^ McGarrity, JF; Огл, Калифорния (1985). «Высокое протоновое исследование ЯМР агрегации и комплексообразования N-бутиллития в тетрагидрофуране». J. Am. Химический Соц 107 (7): 1805–1810. doi : 10.1021/ja00293a001 .
- ^ Jump up to: а беременный Рейх, HJ (2012). «Что происходит с этими литийными реагентами». J. Org. Химический 77 (13): 5471–5491. doi : 10.1021/jo3005155 . PMID 22594379 .
- ^ Wardell, JL (1982). «Глава 2». В Wilinson, G.; Камень, FGA; Абель, EW (ред.). Комплексная органометаллическая химия, вып. 1 (1 -е изд.). Нью -Йорк: Пергамон. ISBN 978-0080406084 .
- ^ Strohmann, C.; Gessner, VH (2008). «Кристаллические структуры аддуктов N-були с (r, r) -tmcda и последствия для депротонирования бензола». J. Am. Химический Соц 130 (35): 11719–11725. doi : 10.1021/ja8017187 . PMID 18686951 .
- ^ Коллум, дБ; и др. (2007). «Литий -диизопропиламид: кинетика раствора и последствия для органического синтеза». Ангев. Химический Инт. Редакция 46 (17): 3002–3017. doi : 10.1002/anie.200603038 . PMID 17387670 .
- ^ Jump up to: а беременный Мел, AJ; Hoogeboom, TJ (1968). «Кольцевая металла толуола с помощью бутиллития в присутствии N, N, N ', N'-тетраметилэтилендиамин». J. Organomet. Химический 11 : 615–618. doi : 10.1016/0022-328x (68) 80091-9 .
- ^ Jump up to: а беременный Рейх, HJ; Грин, DP (1989). «Спектроскопические и реакционные исследования литий -реагента - комплексы HMPA». Журнал Американского химического общества . 111 (23): 8729–8731. doi : 10.1021/ja00205a030 .
- ^ Виллиард, PG; Николс, М.А. (1993). «Твердовые структуры комплексов n-butillithium-tmeda, -thf и -dme». Журнал Американского химического общества . 115 (4): 1568–1572. doi : 10.1021/ja00057a050 .
- ^ Коллум, Д.Б. (1992). «Является ли N, N, N, N-тетраметилентилендиамин хорошим лигандом для лития?». Акк. Химический Резерв 25 (10): 448–454. doi : 10.1021/ar00022a003 .
- ^ Бернштейн, депутат; Коллум, Д.Б. (1993). «Растворитель и субстрат-зависимые скорости металлов имин с помощью литий-диизопропиламида: понимание механизмов, лежащих в основе Крела». J. Am. Химический Соц 115 (18): 8008–8010. doi : 10.1021/ja00071a011 .
- ^ Seebach, D (1988). «Структура и реакционная способность литиевых энолятов. От пинкаколона до селективных C-алкилирования пептидов. Трудности и возможности, предоставляемые сложными структурами» (PDF) . Ангев. Химический Инт. Редакция 27 (12): 1624–1654. doi : 10.1002/anie.198816241 .
- ^ Jump up to: а беременный в Фананас, Франциско; Санз, Роберто (2009). «Реакции внутримолекулярной карболетиации». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0341 . ISBN 9780470682531 .
- ^ Heinz-Dieter Brandt, Wolfgang Nentwig1, Никола Руни, Рональд Т. Лафлэр, Уте У. Вольф, Джон Даффи, Джудит Э. Пуши, Габор Касзас, Марк Дрюитт, Стефан Гландер "Резиновая, 5. Решения" Раунт Уллманн Промышленная химия, 2011, Wiley-VCH, Вайнхайм. Два : 10.1002/14356007.O23_O02
- ^ Баскаран, Д.; Müller, AH (2010). «Анионная виниловая полимеризация». Контролируемые и живые полимеризации: от механизмов до применений . Вейнхейм, Германия: Wiley-VCH Verlag Gmbh & Co. KGAA. doi : 10.1002/9783527629091.CH1 . ISBN 9783527629091 .
- ^ Бейли, WF; и др. (1989). «Подготовка и легкая циклизация 5-алкин-1-юллий». Тетраэдр Летт . 30 (30): 3901–3904. doi : 10.1016/s0040-4039 (00) 99279-7 .
- ^ Jump up to: а беременный в дюймовый и фон глин Кэри, Фрэнсис А. (2007). «Органометаллические соединения металлов группы I и II». Усовершенствованная органическая химия: реакция и синтез Pt. B (Kindle ed.). Спрингер. ISBN 978-0-387-44899-2 .
- ^ Эшби, ЕС; У Noding, SR (1979). «Влияние добавленных солей на стереоселективность и скорость добавления органометаллического соединения к кетонам». J. Org. Химический 44 (24): 4371–4377. doi : 10.1021/jo01338a026 .
- ^ Яматака, Хироши (2009). «Добавление органолитических реагентов к двойным связям». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0310 . ISBN 9780470682531 .
- ^ Ланда, с.; и др. (1967). «О Адамантане и его производных ix. В 2 -м положении деривативы заменили». Сбор Чехословацких химических коммуникаций . 72 (2): 570–575. Doi : 10.1135/cccc19670570 .
- ^ Rubottom, GM; Ким, С. (1983). «Приготовление метилкетонов последовательной обработкой карбоновых кислот метиллитием и хлоротриметилсиланом». J. Org. Химический 48 (9): 1550–1552. doi : 10.1021/jo00157a038 .
- ^ Zadel, G.; Breitmaier, E. (1992). «Синтез кетонов и альдегидов с одним POT из углекислого диоксида и органических соединений». Ангев. Химический Инт. Редакция 31 (8): 1035–1036. doi : 10.1002/anie.199210351 .
- ^ Рональд, RC (1975). «Метоксиметиловые эфиры. Активирующая группа для быстрой и региоселективной металлов». Тетраэдр Летт . 16 (46): 3973–3974. doi : 10.1016/s0040-4039 (00) 91212-7 .
- ^ Охота, да (1989). «Майкл добавление органических соединений. Обзор». Орг Подготовка Прокурор Инт . 21 (6): 705–749. doi : 10.1080/00304948909356219 .
- ^ Рейх, HJ; Sikorski, WH (1999). «Региоселективность добавления органолитных реагентов к Enones: роль HMPA». J. Org. Химический 64 (1): 14–15. doi : 10.1021/jo981765g . PMID 11674078 .
- ^ Коллум, дБ; и др. (2001). «ЯМР-спектроскопические исследования смешанных агрегатов, лежащих в основе высокоэнантиоселективных 1,2-атмосферов лития циклопропилацетилида к хиназолинонам». J. Am. Химический Соц 123 (37): 9135–9143. doi : 10.1021/ja0105616 . PMID 11552822 .
- ^ Sommmmer, LH; Корте, WD (1970). «Стереоспецифические реакции связи между органолитными реагентами и вторичными галогенками». J. Org. Химический 35 : 22–25. doi : 10.1021/jo00826a006 .
- ^ Jump up to: а беременный в дюймовый Органолитные реагенты Reich, HJ 2002 https://organicchemistrydata.org/hansreich/resources/organolithium/organolithium_data/orgli-primer.pdf
- ^ Jump up to: а беременный Приготовление органолитовских реагентов и промежуточных звено Leroux.f., Schlosser. М., Зохар. Э., Марек. I., Wiley, Нью -Йорк. 2004. ISBN 978-0-470-84339-0
- ^ Jump up to: а беременный Хоппе, Дитер; Кристоф, Гвидо (2009). «Асимметричная депротонирование с помощью алкиллития-(-)-спартейна». Химия функциональных групп Патая . John Wiley & Sons, Ltd. doi : 10.1002/9780470682531.pat0313 . ISBN 9780470682531 .
- ^ Клейден, Джонатан (2009). «Передача металлизации ароматических соединений». Химия функциональных групп Патая . John Wiley & Sons, Ltd. Doi : 10.1002/9780470682531.PAT0306 . ISBN 9780470682531 .
- ^ Schlosser, M (1988). «Супербазы для органического синтеза» . Чистое приложение. Химический 60 (11): 1627–1634. doi : 10.1351/pac198860111627 .
- ^ Roush, WR; и др. (1988). «Энантиоселективный синтез с использованием модифицированного диизопропил тартрата (e)- и (z) -кротилбонатов: реакции с ахиральными альдегидами». Тетраэдр Летт . 29 (44): 5579–5582. doi : 10.1016/s0040-4039 (00) 80816-3 .
- ^ Парк, YS; и др. (1996). «(-)-Спартейн-опосредованная α-литиация N-Boc-N- (P-метоксифенил) бензиламина: энантиоселективные синтезы (S) и (R) моно- и диспрессируемых N-бок-бензиламинов». J. Am. Химический Соц 118 (15): 3757–3758. doi : 10.1021/ja9538804 .
- ^ Jump up to: а беременный в дюймовый Вално, Жан-Ив; Маддалуно, Жак (2009). «Аспекты синтеза, структуры и реакционной способности литиевых эунолятов». Химия функциональных групп Патая . John Wiley & Sons, Ltd. Doi : 10.1002/9780470682531.PAT0345 . ISBN 9780470682531 .
- ^ Ирландия. Re; и др. (1976). «Перестановка эфирного эульжа. J. Am. Химический Соц 98 (10): 2868–2877. doi : 10.1021/ja00426a033 .
- ^ Parham, WP; Брэдшер, К.К. (1982). «Ароматические органолитические реагенты, несущие электрофильные группы. Приготовление с помощью обмена галогеновой линий». Акк. Химический Резерв 15 (10): 300–305. doi : 10.1021/ar00082a001 .
- ^ Кори, EJ; Wollenberg, RH (1975). «Полезные новые органометаллические реагенты для синтеза аллильных спиртов с помощью нуклеофильного винилирования». J. Org. Химический 40 (15): 2265–2266. doi : 10.1021/jo00903a037 .
- ^ Ридер, мистер; и др. (2003). «Улучшенный метод реакции перекрестного связывания палладия производных оксазол-2-илзинка с арил бромидами». Орг Процесс Res. Девчонка 7 (5): 696–699. doi : 10.1021/op034059c .
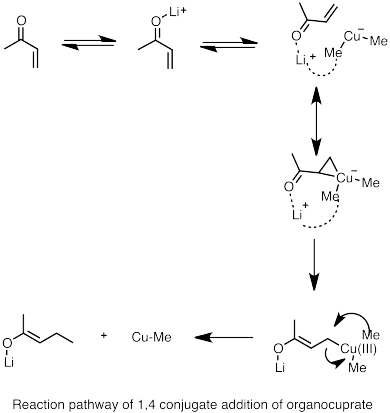
- ^ Накамура, E.; и др. (1997). «Путь реакции конъюгатного добавления литий -органокуратных кластеров к акролеину». J. Am. Химический Соц 119 (21): 4900–4910. doi : 10.1021/ja964209h .
- ^ «Органометаллики в органическом синтезе», Schlosser, M., Ed, Wiley: New York, 1994. ISBN 0-471-93637-5
- ^ Si-Fodil, M.; и др. (1998). «Получение 2,2- (диэтокси) винилового лития и 2-метил-4-этокси-бутадиенилового лития путем арена-литирования соответствующих производных хлоро. Синтетические применения». Тетраэдр Летт . 39 (49): 8975–8978. doi : 10.1016/s0040-4039 (98) 02031-0 .
- ^ Коэн, т; Бхупатия. М (1989). «Соединенные органы с помощью радикального аниона, индуцированного восстановительным металлом фенилтиоэтер». Акк. Химический Резерв 22 (4): 152–161. doi : 10.1021/ar00160a006 .
- ^ Jump up to: а беременный Snieckus, V (1990). «Режиссер-орто-металлы. Директора третичного амида и O-карбамата в синтетических стратегиях для полисабстит-ароматики». Химический Преподобный 90 (6): 879–933. doi : 10.1021/cr00104a001 .
- ^ Jump up to: а беременный Schwindeman, James A.; Вольтерманн, Крис Дж.; Летчфорд, Роберт Дж. (2002). «Безопасная обработка органических соединений в лаборатории». Химическое здоровье и безопасность . 9 (3): 6–11. doi : 10.1016/s1074-9098 (02) 00295-2 . ISSN 1074-9098 .
- ^ Геллерт, ч; Циглер К. (1950). «Органолкальские соединения. XVI. Термическая стабильность литиевых алкил». Либигс Энн. Химический 567 : 179–185. doi : 10.1002/jlac.19505670110 .
- ^ Juaristi, E.; Martínez-Richa, A.; García-Rivera, A.; Cruz-Sánchez, JS (1983). «Использование 4-бифенилметанол, 4-бифенилаксусной кислоты и 4-бифенилкарбоновой кислоты/трифенилметана в качестве показателей при титровании литий-алкил. Исследование дианиона 4-бифенилметанола». Журнал органической химии . 48 (15): 2603–2606. doi : 10.1021/jo00163a038 .
- ^ «Титрующие растворимые RM, R2NM и ROM реагенты» (PDF) . Получено 2014-06-04 .
- ^ «Методы стандартизации реагентов алкиллития (литература до 2006 года)» (PDF) . Получено 2014-06-04 .
- ^ Stanetty, P.; Коллер, Х.; Миховилович, М. (1992). «Направленная орто-литиация фенилкарбамной кислоты 1, L-диметилэтилового эфира (N-BOC-анилин). Пересмотр и улучшения». J. Org. Химический 57 (25): 6833–6837. doi : 10.1021/jo00051a030 .