Силиленоловый эфир

В кремнийорганической химии эфиры силиленола представляют собой класс органических соединений , имеющих общую функциональную группу. R 3 Si-O-CR=CR 2 , состоящий из енолята ( R 3 C-O-R ), связанный с силаном ( SiR 4 ) через кислородный конец и этиленовую группу ( R 2 C=CR 2 ) в качестве его углеродного конца. Они являются важными промежуточными продуктами органического синтеза . [ 1 ] [ 2 ]
Синтез
[ редактировать ]Эфиры силилинола обычно получают путем взаимодействия енолизируемого карбонильного соединения с силилэлектрофилом и основанием или просто взаимодействия енолята с силилэлектрофилом. [ 3 ] Поскольку силильные электрофилы твердые , а связи кремний-кислород очень прочные, кислород (карбонильного соединения или енолята) действует как нуклеофил , образуя одинарную связь Si-O. [ 3 ]
Наиболее часто используемый силильный электрофил — триметилсилилхлорид . [ 3 ] Чтобы увеличить скорость реакции, триметилсилилхлорида можно также использовать триметилсилилтрифлат в качестве более электрофильного субстрата. вместо [ 4 ] [ 5 ]
При использовании несимметричного енолизируемого карбонильного соединения в качестве субстрата выбор условий реакции может помочь контролировать, будет ли преимущественно образовываться кинетический или термодинамический эфир силиленола. [ 6 ] Например, при использовании диизопропиламида лития (LDA) , сильного и стерически затрудненного основания, при низкой температуре (например, -78°C) преимущественно образуется кинетический эфир силиленола (с менее замещенной двойной связью) из-за стерических свойств. [ 6 ] [ 7 ] При использовании триэтиламина , слабого основания, предпочтительным является термодинамический эфир силиленола (с более замещенной двойной связью). [ 6 ] [ 8 ] [ 9 ]


Альтернативно, довольно экзотический способ получения эфиров силиленола заключается в перегруппировке Брука соответствующих субстратов. [ 10 ]
Реакции
[ редактировать ]Общий профиль реакции
[ редактировать ]Эфиры силиленола представляют собой нейтральные, мягкие нуклеофилы (более мягкие, чем енамины ), которые реагируют с хорошими электрофилами, такими как альдегиды (с катализом кислотой Льюиса ) и карбокатионами . [ 11 ] [ 12 ] [ 13 ] [ 14 ] Эфиры силиленола достаточно стабильны, чтобы их можно было выделить, но обычно их используют сразу после синтеза. [ 11 ]
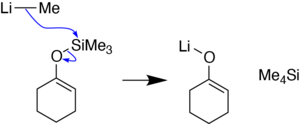
Получение енолята лития
[ редактировать ]Еноляты лития, один из предшественников эфиров силилиленола, [ 6 ] [ 7 ] также может быть получен из эфиров силилинола с использованием метиллития . [ 15 ] [ 3 ] Реакция протекает посредством нуклеофильного замещения кремния в эфире силиленола с образованием енолята лития и тетраметилсилана . [ 15 ] [ 3 ]
Образование связи C–C
[ редактировать ]Эфиры силиленола используются во многих реакциях, приводящих к алкилированию , например, альдольном присоединении Мукаямы реакциях Михаэля и реакциях, катализируемых кислотой Льюиса, с SN , 1 -реактивными электрофилами (например, третичными , аллильными или бензиловыми алкилгалогенидами ). [ 16 ] [ 17 ] [ 18 ] [ 13 ] [ 12 ] Алкилирование эфиров силилинолов особенно эффективно третичными алкилгалогенидами, которые образуют стабильные карбокатионы в присутствии кислот Льюиса, таких как TiCl 4 или SnCl 4 . [ 12 ]



Галогенирование и окисление
[ редактировать ]Галогенирование эфиров силиленолов дает галокетоны . [ 19 ] [ 20 ]

Ацилоины образуются при окислении органических веществ электрофильным источником кислорода, таким как оксазиридин или mCPBA . [ 21 ]
При окислении Саэгуса-Ито некоторые эфиры силиленола окисляются до енонов ацетатом палладия (II) .
Сульфенилирование
[ редактировать ]Реакция силиленольного эфира с PhSCl, хорошим и мягким электрофилом, дает карбонильное соединение, сульфенилированное по альфа-углероду . [ 22 ] [ 20 ] В этой реакции триметилсилильная группа эфира силиленола удаляется хлорид- ионом, высвобождаемым из PhSCl при атаке его электрофильного атома серы. [ 20 ]

Гидролиз
[ редактировать ]Гидролиз эфира силиленола приводит к образованию карбонильного соединения и дисилоксана . [ 23 ] [ 24 ] В этой реакции вода действует как нуклеофил кислорода и атакует кремний эфира силиленола. [ 23 ] Это приводит к образованию карбонильного соединения и промежуточного триметилсиланола , который подвергается нуклеофильному замещению у кремния (другим триметилсиланолом) с образованием дисилоксана. [ 23 ]

Кольцевое сжатие
[ редактировать ]Циклические эфиры силиленола подвергаются региоконтролируемому сжатию одноуглеродного кольца. [ 25 ] [ 26 ] В этих реакциях используются электронодефицитные сульфонилазиды, которые подвергаются хемоселективному, некатализируемому [3+2] циклоприсоединению к эфиру силиленола с последующей потерей динитрога и миграцией алкила с образованием продуктов с суженным кольцом с хорошим выходом. Эти реакции могут направляться стереохимией субстрата, приводя к образованию стереоселективных продуктов с суженным кольцом.
Силилкетенацетали
[ редактировать ]Силиленоловые эфиры сложных эфиров ( −OR ) или карбоновые кислоты ( −COOH ) называются силилкетенацеталями. [ 13 ] и имеют общую структуру R 3 Si-O-C(OR)=CR 2 . Эти соединения более нуклеофильны, чем силиленольные эфиры кетонов ( >С=О ). [ 13 ]

Ссылки
[ редактировать ]- ^ Питер Браунбридж (1983). «Синтез силиленоловых эфиров - Часть I». Синтез . 1983 : 1–28. дои : 10.1055/s-1983-30204 .
- ^ Ян Флеминг (2007). «Букварь по кремнийорганической химии». Симпозиум 121 Фонда Ciba - Биохимия кремния . Симпозиумы Фонда Новартис. Том. 121. Уайли. стр. 112–122. дои : 10.1002/9780470513323.ch7 . ISBN 978-0-470-51332-3 . ПМИД 3743226 .
- ^ Jump up to: а б с д и Клейден Дж., Гривз Н. и Уоррен С. (2012). Эфиры силиленолов. В органической химии (Второе изд., стр. 466-467). Издательство Оксфордского университета.
- ^ Клейден Дж., Гривз Н. и Уоррен С. (2012). Нуклеофильное замещение у кремния. В органической химии (Второе изд., стр. 669-670). Издательство Оксфордского университета.
- ^ Юнг, М.Э., и Перес, Ф. (2009). Синтез 2-замещенных 7-гидроксибензофуран-4-карбоксилатов добавлением эфиров силиленолов к эфирам о -бензохинона. Органические письма , 11 (10), 2165–2167. дои: 10.1021/ol900416x
- ^ Jump up to: а б с д Чан, Т.-Х. (1991). Реакции образования и присоединения эфиров енолов. В комплексном органическом синтезе (стр. 595–628). Эльзевир. doi:10.1016/B978-0-08-052349-1.00042-1
- ^ Jump up to: а б Клейден Дж., Гривз Н. и Уоррен С. (2012). Кинетически контролируемое образование енолятов. В органической химии (Второе изд., стр. 600-601). Издательство Оксфордского университета.
- ^ Клейден Дж., Гривз Н. и Уоррен С. (2012). Термодинамически контролируемое образование енолята. В органической химии (Второе изд., стр. 599-600). Издательство Оксфордского университета.
- ^ Клейден Дж., Гривз Н. и Уоррен С. (2012). Создание более замещенного эквивалента енолята: термодинамических енолятов. В органической химии (Второе изд., стр. 636). Издательство Оксфордского университета.
- ^ Клайв, Деррик Л.Дж. и Сунаси, Раджеш (2007). «Образование бензоконденсированных карбоциклов путем формальной радикальной циклизации на ароматическом кольце». Орг. Летт. 9 (14): 2677–2680. дои : 10.1021/ol070849l . ПМИД 17559217 .
- ^ Jump up to: а б Клейден Дж., Гривз Н. и Уоррен С. (2012). Эфиры силиленолов в альдольных реакциях. В органической химии (Второе изд., стр. 626-627). Издательство Оксфордского университета.
- ^ Jump up to: а б с Клейден Дж., Гривз Н. и Уоррен С. (2012). Эфиры силиленола алкилируются SN 1 -реакционноспособными электрофилами в присутствии кислоты Льюиса. В органической химии (Второе изд., стр. 595). Издательство Оксфордского университета.
- ^ Jump up to: а б с д Клейден Дж., Гривз Н. и Уоррен С. (2012). Сопряженное присоединение простых эфиров силилинола приводит к получению силиленольного эфира продукта. В органической химии (Второе изд., стр. 608-609). Издательство Оксфордского университета.
- ^ Квирк, Р.П. и Пикель, Д.Л. (2012). Эфиры силиленолов. В книге «Контролируемая функционализация конечных групп (включая телехелики)» (стр. 405-406). Эльзевир. doi:10.1016/B978-0-444-53349-4.00168-0
- ^ Jump up to: а б Хаус, ХО, Галл, М. и Олмстед, Х.Д. (1971). Химия карбанионов. XIX. Алкилирование енолятов из несимметричных кетонов. Журнал органической химии , 36 (16), 2361–2371. дои: 10.1021/jo00815a037
- ^ Мацуо Дж. и Мураками М. (2013). Реакция Мукаяма-Альдола: 40 лет непрерывного развития. Angewandte Chemie International Edition , 52 (35), 9109–9118. doi:10.1002/anie.201303192
- ^ Нарасака К., Соаи К., Айкава Ю. и Мукаяма Т. (1976). Реакция Михаэля силиленоловых эфиров с α, β-ненасыщенными этотонами и ацеталями в присутствии тетраалкоксида титана и тетрахлорида титана. Бюллетень Химического общества Японии , 49 (3), 779-783. doi:10.1246/bcsj.49.779
- ^ М. Т. Ритц и А. Яннис (1981) Альфа-тиоалкилирование кетонов, опосредованное кислотой Льюиса, Synthetic Communications, 11: 4, 315-322, doi: 10.1080/00397918108063611
- ^ Теруо Умемото; Кёичи Томита; Косуке Кавада (1990). «Трифлат N-фторпиридиния: электрофильный фторирующий агент». Органические синтезы . 69 : 129. дои : 10.1002/0471264180.os069.16 . ISBN 0-471-26422-9 .
- ^ Jump up to: а б с Клейден Дж., Гривз Н. и Уоррен С. (2012). Реакции эфиров силилинолов с галогеновыми и серными электрофилами. В органической химии (Второе изд., стр. 469-470). Издательство Оксфордского университета.
- ^ Органические синтезы , Сб. Том. 7, с.282 (1990); Том. 64, с.118 (1986) Ст .
- ^ Чибале, К., и Уоррен, С. (1996). Кинетическое разрешение в асимметричных антиальдольных реакциях рацемических 2-фенилсульфанилальдегидов с разветвленной и прямой цепью: асимметричный синтез циклических эфиров и лактонов путем миграции фенилсульфанила. Журнал Химического общества, Perkin Transactions 1 , (16), 1935–1940. doi:10.1039/P19960001935
- ^ Jump up to: а б с Клейден Дж., Гривз Н. и Уоррен С. (2012). Гидролиз эфиров енолов. В органической химии (Второе изд., стр. 468-469). Издательство Оксфордского университета.
- ^ Гупта, С.К., Сарджент, младший, и Вебер, WP (2002). Синтез и фотоокислительная деградация 2,6-бис-[ω-триметилсилоксиполидиметилсилокси-2'-диметилсилилэтил]ацетофенона. Полимер , 43 (1), 29-35. doi:10.1016/S0032-3861(01)00602-4
- ^ (а) Воль, Р. Хелв. хим. Закон 1973 , 56 , 1826. (b) Сюй, Ю. Сюй, Г.; Чжу, Г.; Цзя, Ю.; Хуанг, QJ . Fluorine Chem. 1999 , 96 , 79 .
- ^ Митчелтри, MJ; Конст, ЗА; Герзон, СБ Тетраэдр 2013 , 69 , 5634.
