Мукаяма альдольное дополнение
| выводит |
|---|
 альдегид ( R 1 = Алкил, Арил) или форматировать ( R 1 = ИЛИ) |
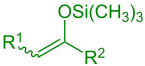 силиленоловый эфир ( R 1 = Алкил, Арил, Н; Р 2 = Алкил, Арил, H, OR, SR) |
В органической химии присоединение альдолов Мукаямы представляет собой органическую реакцию и тип альдольной реакции между эфиром силиленола ( R 2 C=CR-O-Si(CH 3 ) 3 ) и альдегид ( R-CH=O ) или формиат ( R-O-CH=O ). [1] Реакцию открыл Теруаки Мукаяма в 1973 году. [2] Его выбор реагентов позволяет осуществить перекрестную альдольную реакцию между альдегидом и кетоном ( >C=O ) или другой альдегид без самоконденсации альдегида. По этой причине реакция широко используется в органическом синтезе .
Общая схема реакции
[ редактировать ]Альдольное присоединение Мукаямы представляет собой кислотой Льюиса ( опосредованное присоединение енолсиланов к карбонилу, C=O ) соединения. В этой реакции можно использовать соединения с различными органическими группами (см. Эдукты). [3] Базовая версия ( R 2 = H) без присутствия хиральных катализаторов показано ниже.

рацемическая смесь энантиомеров . Построена Если в этой реакции используются Z- или E-енолсиланы, образуется смесь четырех продуктов с образованием двух рацематов.

Будет ли антидиастереомер , во многом или синдиастереомер построен зависит от условий реакции, субстратов и кислот Льюиса.
Типичная реакция - это реакция силиленолового эфира циклогексанона . (CH 2 ) 5 CO , с бензальдегидом , С 6 Н 5 ЧО . При комнатной температуре он образует диастереомерную смесь трео (63%) и эритро (19%) β- гидроксикетона , а также 6% экзоциклического конденсации енона продукта . В своем первоначальном применении кислота Льюиса ( тетрахлорид титана , TiCl 4 ) использовался в стехиометрических количествах, но существуют и истинно каталитические системы. Реакция также оптимизирована для асимметричного синтеза .

Механизм
[ редактировать ]Ниже механизм реакции показан с помощью R 2 = Ч:
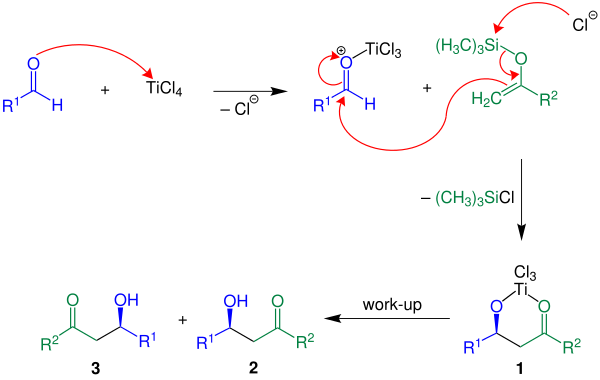
кислота Льюиса TiCl 4 В приведенном примере используется . Сначала кислота Льюиса активирует альдегидный компонент с последующим образованием углерод-углеродной связи между енолсиланом и активированным альдегидом.При потере хлорсилана соединение 1 образуется . Желаемый продукт, рацемат 2 и 3 , получают водной обработкой. [3]
Стереоселекция
[ редактировать ]Альдольная реакция Мукаямы не соответствует модели Циммермана-Тракслера. Каррейра описал особенно полезную асимметричную методологию с силилкетенацеталями, примечательную своим высоким уровнем энантиоселективности и широким спектром субстратов. [4] Этот метод работает с неразветвленными алифатическими альдегидами, которые часто являются плохими электрофилами для каталитических асимметричных процессов. Это может быть связано с плохой электронной и стерической дифференциацией их энантиофасов .

Аналогичный винилологичный альдольный процесс Мукаямы также можно сделать каталитическим и асимметричным. Пример, показанный ниже, эффективно работает для ароматических (но не алифатических) альдегидов, и считается, что механизм включает хиральный диенолат, связанный с металлом. [5] [6]

Объем
[ редактировать ]Типичная реакция с участием двух кетонов — это реакция между ацетофеноном в виде енола и ацетоном : [7]

Кетоновые реакции этого типа требуют более высоких температур реакции. Для этой работы Мукаяма был вдохновлен более ранней работой Георга Виттига в 1966 году по скрещенным альдольным реакциям с литированными иминами . [8] [9] Конкурирующая работа по альдольным реакциям енолята лития была опубликована также в 1973 году Гербертом О. Хаусом. [10]
Мукаяма применил в своей интерпретации полного синтеза таксола (1999) два альдольных присоединения: [11] [12] один с силилацеталем кетена и избытком бромида магния :

и второй с аминохиральным лигандом и катализатором на основе трифлатной соли :

Использование хиральных комплексов кислот Льюиса и оснований Льюиса в асимметричных каталитических процессах является наиболее быстрорастущей областью использования альдольной реакции Мукаямы. [3]
Ссылки
[ редактировать ]- ^ Мукаяма, Т.; Кобаяши, С. (1994). «Еноляты олова (II) в реакциях Альдола, Михаэля и родственных им». Орг. Реагировать. 46 : 1. doi : 10.1002/0471264180.or046.01 . ISBN 0471264180 .
- ^ Реакция нового альдольного типа Теруаки Мукаяма, Коичи Нарасака и Кадзуо Банно Chemistry Letters Vol.2 ( 1973 ), № 9, стр. 1011–1014 дои : 10.1246/кл.1973.1011
- ^ Jump up to: а б с Курти, Ласло; Чако, Барбара (2005). Стратегическое применение названных реакций в органическом синтезе: предпосылки и детальные механизмы . Эльзевир Академик Пресс. стр. 298–299 . ISBN 978-0-12-429785-2 .
- ^ Каррейра ЕМ; Певица РА; Ли WS (1994). «Каталитическое, энантиоселективное присоединение альдолов к метил- и этилацетатным O -силиленолятам - хира; тридентатный хелат в качестве лиганда титана (IV)» (PDF) . Журнал Американского химического общества . 116 (19): 8837–8. дои : 10.1021/ja00098a065 .
- ^ Крюгер Дж.; Каррейра Э.М. (1998). «Очевидное каталитическое образование хиральных енолятов металлов: энантиоселективное присоединение диенолятов к альдегидам, опосредованное фторидными комплексами центра Tol-BINAP Cu (II)». Журнал Американского химического общества . 120 (4): 837–8. дои : 10.1021/ja973331t .
- ^ Пагенкопф Б.Л.; Крюгер Дж.; Стоянович А.; Каррейра Э.М. (1998). «Механистическое понимание асимметричных альдольных реакций, катализируемых Cu: химические и спектроскопические данные о промежуточном металлоеноляте». Энджью. хим. Межд. Эд . 37 (22): 3124–6. doi : 10.1002/(SICI)1521-3773(19981204)37:22<3124::AID-ANIE3124>3.0.CO;2-1 . ПМИД 29711324 .
- ^ Органические синтезы , Сб. Том. 8, с. 323 (1993); Том. 65, с. 6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
- ^ Виттиг, Г.; Сучанек, П. (январь 1966 г.). «О целевых альдоконденсациях — II». Тетраэдр . 22 :347-358. дои : 10.1016/S0040-4020(01)82193-1 .
- ^ НАПРАВЛЕННАЯ АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ: Органический синтез β-ФЕНИЛЦИНАМАЛЬДЕГИДА, Coll. Том. 6, с. 901 (1988); Том. 50, с. 66 (1970). Г. Виттиг, А. Гессе, Аллан Й. Тераниши и Герберт О. Хаус http://www.orgsynth.org/orgsyn/prep.asp?prep=cv6p0901
- ^ Хаус, Герберт О.; Крамрин, Дэвид С.; Тераниши, Аллан Ю.; Олмстед, Хью Д. (май 1973 г.). «Химия карбанионов. XXIII. Использование металлокомплексов для управления альдольной конденсацией». Журнал Американского химического общества . 95 (10): 3310–3324. дои : 10.1021/ja00791a039 .
- ^ Мукаяма, Исаму, Хаято; Нисимура, Тошихиро; Сако, Хироки; Тани, Хасегава, Ямада, Кодзи; 4 января 1999 г.). «Асимметричный полный синтез таксола \ R» . Европейский журнал . 5 (1): 121–161. doi : 10.1002/(SICI)1521-3765(19990104)5:1<121:: AID-CHEM121>3.0.CO;2-O .
- ^ TBS = трет-бутилдиметилсилил, Bn = бензил, PMB = п-метоксибензиловый эфир