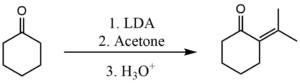Самообслуживание
При органической химии самоконденсация является органической реакцией , в которой химическое соединение, содержащее карбонильную группу ( C = O ) действует как электрофил , так и нуклеофил в конденсации альдола . Он также называется симметричной конденсацией альдола, в отличие от смешанной конденсации альдола , при которой электрофил и нуклеофил являются разными видами.
Например, две молекулы ацетона конденсируются до одного составного оксида мезитила в присутствии ионной обменной смолы : [ 1 ]
- 2 Ch 3 Coch 3 → (Ch 3 ) 2 C = CH (CO) CH 3 + H 2 O
Для синтетических применений это, как правило, нежелательная, но спонтанная и предпочтительная побочная реакция смешанной конденсации альдола, и для ее предотвращения необходимы специальные меры предосторожности.
Предотвращение самообслуживания
[ редактировать ]Во многих случаях самоконденсация является нежелательной побочной реакцией. Следовательно, химики приняли много способов предотвращения этого при выполнении пересеченной реакции Альдола.
Использование более реактивного электрофила и неэнолизируемого партнера
[ редактировать ]Если ацетофенон и бензальдегид собираются в присутствии водного NaOH , образуется только один продукт:
Это происходит из -за того, что бензальдегид не имеет каких -либо энолизируемых протонов, поэтому он не может образовывать энолат, а бензальдегид гораздо более электрофильный, чем любой неэнолизированный ацетофенон в растворе. Следовательно, энолат, образованный из ацетофенона, всегда будет преимущественно атаковать бензальдегид на другую молекулу ацетофенона. [ 2 ]
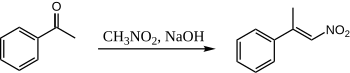
Создание ионо -ионо
[ редактировать ]Когда нитрометан и ацетофенон объединяются с использованием водного NaOH, образуется только один продукт:
Здесь ацетофенон никогда не получает шанса конденсироваться с собой, потому что нитрометан настолько же кислый, что нитро «энолят» производится количественно. Не существует известной опубликованной процедуры конденсации между ацетофеноном и нитрометаном.
Аналогичный процесс также может быть использован для предотвращения самоконденсации между двумя кетонами. В этом случае, однако, используемая база должна быть более мощной. Обычным основанием используется литий -диизопропиловый амид (LDA). Здесь он используется для выполнения скрещенной конденсации между ацетоном и циклогексаноном . [ 3 ]
Стадия депротонирования с использованием LDA настолько быстрое, что образованный энолят никогда не получает шанс реагировать с какими -либо непрореагированными молекулами циклогексанона. Затем энолят быстро реагирует с ацетоном.
Формирование эфира Силил Энол
[ редактировать ]Использование LDA не будет работать при попытке сделать ион Enolate из альдегидов. Они настолько реагируют, что возникнет самообслуживание. Один из способов обойти это - превратить альдегид в эфир силил -энола, используя триметилсилил хлорид и основание, например, триэтиламин , а затем выполнить конденсацию альдола. Здесь эта тактика используется в конденсации ацетальдегида и бензальдегида . Кислота Льюиса, такая как TICL 4 , должна использоваться для содействия конденсации. [ 4 ]
Ссылки
[ редактировать ]- ^ Кетоновые конденсации с использованием ионной обменной смолы сульфоновой кислоты N. Lorette; J. Org. Химический ; 1957; 22 (3); 346-347.
- ^ Клейден, Джонатан. Органическая химия. Издательство Оксфордского университета, Оксфорд, Нью-Йорк, с. 689-720. ISBN 978-0-19-850346-0
- ^ Клейден, Джонатан. Органическая химия. Издательство Оксфордского университета, Оксфорд, Нью-Йорк, с. 689-720. ISBN 978-0-19-850346-0
- ^ Клейден, Джонатан. Органическая химия. Издательство Оксфордского университета, Оксфорд, Нью-Йорк, с. 689-720. ISBN 978-0-19-850346-0