Ацилоин

В органической химии ацилоины или α -гидроксикетоны. [1] представляют собой класс органических соединений общего вида R-C(=O)-CR'(OH)-R" состоит из гидроксильной группы ( −OH ) рядом с кетоновой группой ( >С=О ). Название ацилоины происходит от того факта, что они формально образуются в результате восстановительного сочетания карбоксильных ацильных групп ( R−C(=O)− ). [1] Они представляют собой один из двух основных классов гидроксикетонов , отличающихся положением гидроксильной группы относительно кетона; в этой форме гидрокси находится на альфа-углероде , что объясняет вторичное название α-гидроксикетона .
Синтез
[ редактировать ]Существуют классические органические реакции синтеза ацилоинов.
- Ацилоиновая конденсация представляет собой восстановительную реакцию сложных эфиров.
- Бензоиновая конденсация — это реакция конденсации альдегидов, катализируемая нуклеофилом .
- Окисление карбонилов возможно молекулярным кислородом, но не избирательно.
- Лучшей альтернативой является окисление соответствующих эфиров силиленола м- ХПБА в процессе окисления Руботтома.
- MoOPH Окисление карбонилов представляет собой систему с молибдена пероксидом , пиридином и гексаметилфосфорамидом .
- Семейство стереоселективных синтезов окисляет in situ енолы до нитрозоэквивалентов . В простейшем варианте нитрозобензол окисляет карбонил до α-гидроксиламина с помощью пролинового органокализатора для энантиоселективности . [2] В более сложной версии еноляты могут окисляться сульфонилоксазиридинами . [3] [4]
Окисление сульфонилоксаридинами
[ редактировать ]Когда сульфонилоксазиридины окисляют енолы(аты), последний реагирует путем нуклеофильного замещения по электронодефицитному кислороду оксазиридинового кольца.
Этот тип реакции расширяется до асимметричного синтеза за счет использования хиральных оксазиридинов, полученных из камфоры (камфорсульфонилоксазиридин). Каждый изомер дает исключительный доступ к одному из двух возможных энантиомеров . Эта модификация применяется при полном синтезе таксола Холтона .
При енолятном окислении циклопентаенона ниже [5] с любым энантиомером камфоры получается транс -изомер , поскольку доступ гидроксильной группы в цис -положении ограничен. Использование стандартного оксазиридина не привело к образованию ацилоина.
Реакции
[ редактировать ]- Восстановление ацилоинов дает диолы .
- Окисление ацилоинов дает дионы .
- α-гидроксикетоны дают положительную реакцию Толленса и Фелинга .
- Некоторые ацилоины перестраиваются, меняя позиции под влиянием основания в преобразовании Лобри – де Брюйна – Ван Экенштейна.
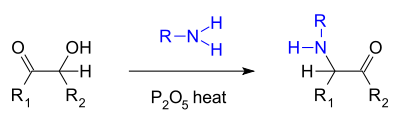
- Подобная реакция представляет собой так называемое аминирование Фойгта. [6] где ацилоин реагирует с первичным амином и пятиокисью фосфора с образованием α-кетоамина: [7]
- Синтез индола, [8] сравнить Бишлер – Мёлау
См. также
[ редактировать ]- Гликолальдегид , родственная молекула, эквивалентная ацилоину с обеими R-группами в качестве водорода (и, следовательно, альдегидом, а не кетоном).
Ссылки
[ редактировать ]- ^ Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Ацилоины ». дои : 10.1351/goldbook.A00126
- ^ Табер, Дуглас Ф. (26 января 2004 г.). «Каталитический энантиоселективный синтез» . Портал органической химии . Основные моменты органической химии . Проверено 7 июня 2024 г.
- ^ Дэвис, Франклин А.; Вишвакарма, Лал К.; Биллмерс, Джоан Г.; Финн, Джон (1984). «Синтез α-гидроксикарбонильных соединений (ацилоинов): прямое окисление енолятов с использованием 2-сульфонилоксазиридинов». Дж. Орг. хим. 49 (17): 3241–3243. дои : 10.1021/jo00191a048 .
- ^ Дэвис, ФА; Хак, MS; Улатовский, Т.Г.; Таусон, Дж. К. (1986). «Асимметричное окисление енолятов эфиров и амидов с использованием новых (камфорилсульфонил)оксазиридинов». Дж. Орг. хим. 51 (12): 2402. doi : 10.1021/jo00362a053 .
- ^ Перейти обратно: а б Хьюз, Чемберс К.; Миллер, Обри К.; Траунер, Дирк (2005). «Электрохимический подход к гуанакастепенам» (PDF) . Орг. Летт. 7 (16): 3425–3428. дои : 10.1021/ol047387l . ПМИД 16048308 . Архивировано из оригинала (PDF) 4 сентября 2006 года.
- ^ Мейер, Э.; Фойгт, Карл (1886). «О влиянии первичных ароматических аминов на бензоин» . Дж. Практика. Хим. (на немецком языке). 34 (1): 1–27. дои : 10.1002/prac.18860340101 .
- ^ Лоуренс, Стивен А. (2004). Амины: синтез, свойства и применение . Издательство Кембриджского университета . ISBN 978-0-521-78284-5 .
- ^ Рот, Лепке (1972). «Синтез производных индола и карбазола из α-гидроксикетонов и ароматических аминов». Архивы аптеки (на немецком языке). 305 (3): 159–171. дои : 10.1002/ardp.19723050302 . ПМИД 5048240 . S2CID 84990819 .
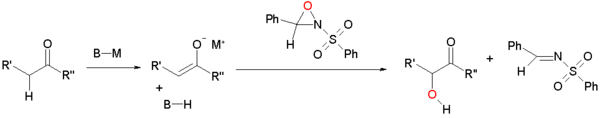

![Пример окисления енолята[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/02/Acyloin_example_Hughes.png/500px-Acyloin_example_Hughes.png)