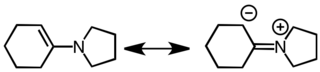
енамин

Енамин полученное — ненасыщенное соединение, конденсацией альдегида или кетона со вторичным амином . [1] [2] Енамины являются универсальными промежуточными продуктами. [3] [4]

Конденсация с образованием енамина. [5]
Слово «енамин» происходит от аффикса эн- , используемого в качестве суффикса слова алкен , и корня амина . Это можно сравнить с енолом , который представляет собой функциональную группу, содержащую как алкен ( ен- ), так и спирт (-ол ) . Енамины считаются азотистыми аналогами енолов. [6]
Если один или оба заместителя азота представляют собой атом водорода, это таутомерная форма имина . Обычно это перегруппировывается в имин; однако есть несколько исключений (например, анилин ). Енамин-иминную таутомерию можно считать аналогом кето-енольной таутомерии . В обоих случаях атом водорода меняет свое положение между гетероатомом (кислорода или азота) и вторым атомом углерода.
Енамины являются одновременно хорошими нуклеофилами и хорошими основаниями. Их поведение как нуклеофилов на основе углерода объясняется с помощью следующих резонансных структур.
Формирование [ править ]
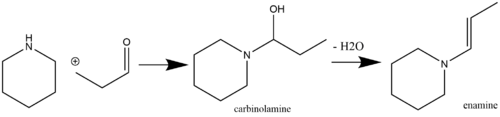
Енамины являются лабильными и, следовательно, химически полезными фрагментами, которые можно легко получить из коммерчески доступных исходных реагентов. Распространенным путем производства енамина является кислотно-катализируемая нуклеофильная реакция кетона. [7] или альдегид [8] виды, содержащие α-водород со вторичными аминами. Кислотный катализ не всегда требуется, если pK aH реагирующего амина достаточно высока (например, пирролидин , имеющий pK aH 11,26). Однако если pK aH реагирующего амина низок, то необходим кислотный катализ как на стадиях присоединения, так и на стадиях дегидратации. [9] (обычные дегидратирующие агенты включают MgSO 4 и Na 2 SO 4 ). [10] Первичные амины обычно не используются для синтеза енаминов из-за преимущественного образования более термодинамически стабильных видов имина. [11] Самоконденсация метилкетона является побочной реакцией, которой можно избежать путем добавления TiCl 4. [12] в реакционную смесь (действуя в качестве поглотителя воды ). [13] [14] Пример реакции альдегида со вторичным амином с образованием енамина через промежуточный карбиноламин показан ниже:
Реакция [ править ]
Алкилирование [ править ]
Несмотря на то, что енамины более нуклеофильны, чем их енольные аналоги, они все же могут реагировать избирательно, что делает их полезными для реакций алкилирования. Нуклеофил енамина может атаковать галогеналканы с образованием промежуточной алкилированной иминиевой соли, которая затем гидролизуется с регенерацией кетона (исходного материала в синтезе енамина). Эта реакция была впервые предложена Гилбертом Сторком , и иногда ее называют по имени ее изобретателя ( енаминное алкилирование Сторка ). Аналогично, эту реакцию можно использовать как эффективный способ ацилирования . В этой реакции можно использовать различные алкилирующие и ацилирующие агенты, включая бензильные и аллилгалогениды. [15]

Ацилирование [ править ]
В реакции, очень похожей на алкилирование енамина, енамины могут ацилироваться с образованием конечного дикарбонильного продукта. Исходный материал енамина подвергается нуклеофильному присоединению к ацилгалогенидам с образованием промежуточной иминиевой соли, которая может гидролизоваться в присутствии кислоты. [16]

Металлоэнамины [ править ]
Сильные основания, такие как LiNR 2, можно использовать для депротонирования иминов и образования металлоенаминов. Металлоенамины могут оказаться синтетически полезными из-за их нуклеофильности (они более нуклеофильны, чем еноляты). Таким образом, они лучше реагируют с более слабыми электрофилами (например, их можно использовать для открытия эпоксидов ). [17] В частности, эти реакции позволили провести асимметричное алкилирование кетонов путем превращения в хиральные промежуточные металлоенамины. [18]
Галогенирование [ править ]
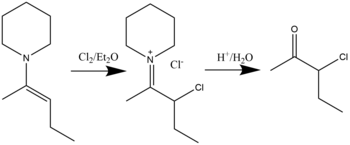
Соединения β-галогениммония можно синтезировать реакцией галогенирования енаминов галогенидами в растворителе диэтиловом эфире . Гидролиз приведет к образованию α-галогенкетонов. [19] Было показано, что хлорирование, бромирование и даже йодирование возможно. Общая реакция показана ниже:
Окислительная реакция [ править ]
Енамин можно эффективно перекрестно сочетать с енолсиланами путем обработки цериево-аммиачной селитрой . Об этих реакциях сообщила группа Нарасака в 1975 году, что открыло путь к стабильным енаминам, а также к одному из примеров 1,4-дикетона (полученного из реагента морфолин- амина). [20] Позже эти результаты были использованы группой Макмиллана при разработке органокатализатора , который использовал субстраты Нарасака для энантиоселективного производства 1,4-дикарбонилов с хорошими выходами. [21] Окислительная димеризация альдегидов в присутствии аминов протекает через образование енамина с последующим окончательным образованием пиррола . [22] Этот метод симметричного синтеза пиррола был разработан в 2010 году группой Jia как ценный новый путь синтеза пирролсодержащих природных продуктов. [23]
Отмена [ править ]
Химия енаминов была использована с целью создания однореакторной энантиоселективной версии кольца Робинсона . Аннуляция Робинсона, опубликованная Робертом Робинсоном в 1935 году, представляет собой реакцию, катализируемую основаниями, в которой кетон и метилвинилкетон ( обычно сокращенно MVK) объединяются с образованием конденсированной кольцевой системы циклогексенона . Эта реакция может катализироваться пролином , протекая через хиральные промежуточные енаминовые соединения, которые обеспечивают хорошую стереоселективность. [24] Это важно, в частности, в области синтеза природных продуктов, например, для синтеза кетона Виланда-Мишера – жизненно важного строительного блока для более сложных биологически активных молекул. [25] [26]
Реактивность [ править ]
Енамины действуют как нуклеофилы, которым для реакционной способности требуется меньшая кислотно-основная активация, чем их енолятным аналогам. Также было показано, что они обладают большей селективностью и меньшим количеством побочных реакций. Существует градиент реакционной способности между различными типами енаминов: кетоновые енамины обладают большей реакционной способностью, чем их альдегидные аналоги. [27] Циклические кетоны-енамины следуют тенденции реакционной способности, при которой пятичленное кольцо является наиболее реакционноспособным из-за его максимально плоской конформации по азоту, следуя тенденции 5>8>6>7 (семичленное кольцо является наименее реакционноспособным). Эту тенденцию объясняют количеством p-символов на орбитали неподеленной пары азота - более высокий p-символ соответствует большей нуклеофильности, поскольку p-орбиталь допускает донорство на π-орбитали алкена. Аналогично, если неподеленная пара N участвует в стереоэлектронных взаимодействиях с аминогруппой, неподеленная пара выйдет из плоскости (будет пирамидализоваться ) и поставит под угрозу донорство соседней связи π CC. [28] [29]

Существует множество способов модулировать реакционную способность енамина в дополнение к изменению стерических/электронных свойств азотного центра, включая изменение температуры, растворителя, количества других реагентов и типа электрофила. Настройка этих параметров позволяет осуществлять преимущественное образование E/Z-енаминов, а также влияет на образование более/менее замещенного енамина из исходного кетонового материала. [30]
См. также [ править ]
- Реакция гидразонового алкилирования Эндерса SAMP/RAMP
- Реакция Хайоса-Пэрриша-Эдера-Зауэра-Вихерта
- Майкл Аддишн
- Синтез индола Неницеску
- Органокатализ
- Отмена Робинзона
- Реакция Торпа
- Флюоксиместерон
Ссылки [ править ]
- ^ Клейден, Джонатан (2001). Органическая химия . Оксфорд, Оксфордшир: Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Энамины: синтез: структура и реакции, второе издание, Гилберт Кук (редактор). 1988, Марсель Деккер, Нью-Йорк. ISBN 0-8247-7764-6
- ^ Р.Б. Вудворд, И.Дж. Пахтер и М.Л. Шейнбаум (1974). «2,2-(Триметилендитио)циклогексанон» . Органические синтезы . 54 : 39
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 5, с. 1014 . - ^ Р.Д. Берпитт и Дж.Г. Твитт (1968). «Циклодеканон» . Органические синтезы . 48:56 ; Сборник томов , т. 5, с. 277 .
- ^ Имины и енамины | PharmaXChange.info
- ^ Аист, Гилберт; Бризцолара, А.; Ландесман, Х.; Шмушкович, Дж.; Террелл, Р. (1963). «Енаминовое алкилирование и ацилирование карбонильных соединений» . Журнал Американского химического общества . 85 (2): 207–222. дои : 10.1021/ja00885a021 . ISSN 0002-7863 .
- ^ Манних, К.; Дэвидсен, Х. (1936). «О простых енаминах с тройной связью азота». Отчеты Немецкого химического общества (серии A и B) (на немецком языке). 69 (9): 2106–2112. дои : 10.1002/cber.19360690921 . ISSN 0365-9488 .
- ^ Капон, Брайан; Ву, Чжэнь Пин (апрель 1990 г.). «Сравнение таутомеризации и гидролиза некоторых вторичных и третичных енаминов». Журнал органической химии . 55 (8): 2317–2324. дои : 10.1021/jo00295a017 .
- ^ Локнер, Джеймс. «Стехиометрическая химия енамина» (PDF) . Baran Group, Исследовательский институт Скриппса . Проверено 26 ноября 2014 г.
- ^ Фармер, Стивен (16 октября 2013 г.). «Енаминовые реакции» . Wiki Калифорнийского университета в Дэвисе.
- ^ Карлсон, Р; Нильссон, А (1984). «Улучшенная методика синтеза енамина с использованием тетрахлорида титана» . Acta Chemica Scandinavica . 38Б : 49–53. doi : 10.3891/acta.chem.scand.38b-0049 .
- ^ Локнер, Джеймс. «Стехиометрическая химия енамина» (PDF) . Baran Group, Исследовательский институт Скриппса . Проверено 26 ноября 2014 г.
- ^ Уайт, Уильям Эндрю; Вайнгартен, Гарольд (январь 1967 г.). «Универсальный синтез нового енамина». Журнал органической химии . 32 (1): 213–214. дои : 10.1021/jo01277a052 .
- ^ Уэйд, LG (1999). Органическая химия . Сэддл-Ривер, Нью-Джерси: Прентис-Холл. стр. 1019 . ISBN 9780139227417 .
- ^ Фармер, Стивен (16 октября 2013 г.). «Енаминовые реакции» . Wiki Калифорнийского университета в Дэвисе.
- ^ Эванс, Д. «Енолаты и металлоенамины II» (PDF) . Проверено 10 декабря 2014 г. [ постоянная мертвая ссылка ]
- ^ Мейерс, А.И.; Уильямс, Дональд Р. (август 1978 г.). «Асимметричное алкилирование ациклических кетонов посредством хиральных металленоенаминов. Влияние кинетических и термодинамических металлирований». Журнал органической химии . 43 (16): 3245–3247. дои : 10.1021/jo00410a034 .
- ^ Зойферт, Вальтер; Эйффенбергер, Франц (1979). «О галогенировании енаминов - получение β-галоген-иминийгалогенидов». Химические отчеты . 112 (5): 1670–1676. дои : 10.1002/cber.19791120517 .
- ^ Ито, Ю; Конойке, Т; Саэгуса, Т (1975). «Синтез 1,4-дикетонов реакцией эфира силиленола с оксидом серебра. Региоспецифическое образование промежуточных продуктов енолята серебра (I)». Журнал Американского химического общества . 97 (3): 649–651. дои : 10.1021/ja00836a034 .
- ^ Джанг, HY; Хонг, JB; Макмиллан, DWC (2007). «Энантиоселективная органокаталитическая активация однозанятых молекулярных орбиталей: энантиоселективное альфа-енолирование альдегидов» (PDF) . Дж. Ам. хим. Соц . 129 (22): 7004–7005. дои : 10.1021/ja0719428 . ПМИД 17497866 .
- ^ Ли, Кью; Фан, А; Лу, З; Кюи, Ю; Лин, В; Цзя, Ю (2010). «Опосредованный AgOAc синтез полизамещенных пирролов из первичных аминов и альдегидов в одном горшке: применение к полному синтезу пурпурона». Органические письма . 12 (18): 4066–4069. дои : 10.1021/ol101644g . ПМИД 20734981 .
- ^ Го, Фэнхай; Клифт, Майкл Д.; Томсон, Риган Дж. (сентябрь 2012 г.). «Окислительное сочетание енолятов, енолсиланов и енаминов: методы и синтез натуральных продуктов» . Европейский журнал органической химии . 2012 (26): 4881–4896. дои : 10.1002/ejoc.201200665 . ПМЦ 3586739 . ПМИД 23471479 .
- ^ Список, Бенджамин (2002). «Асимметричные реакции, катализируемые пролином». Тетраэдр . 58 (28): 5573–5590. дои : 10.1016/s0040-4020(02)00516-1 .
- ^ Буи, Томми; Барбас (2000). «Асимметричное кольцо Робинсона, катализируемое пролином». Буквы тетраэдра . 41 (36): 6951–6954. дои : 10.1016/s0040-4039(00)01180-1 .
- ^ Винер, Джейк. «Энантиоселективный органический катализ: подходы, отличные от MacMillan» (PDF) . Архивировано из оригинала (PDF) 26 октября 2017 года . Проверено 29 ноября 2014 г.
- ^ Хикмотт, Питер (май 1982 г.). «Енамины: последние достижения в области синтетических, спектроскопических, механистических и стереохимических аспектов - II». Тетраэдр . 38 (23): 3363–3446. дои : 10.1016/0040-4020(82)85027-8 .
- ^ Майр, Х. (2003). «Связь структура-нуклеофильность енаминов». хим. Евро. Дж . 9 (10): 2209–18. дои : 10.1002/chem.200204666 . ПМИД 12772295 .
- ^ Хикмотт, Питер (май 1982 г.). «Енамины: последние достижения в области синтетических, спектроскопических, механистических и стереохимических аспектов - II». Тетраэдр . 38 (23): 3363–3446. дои : 10.1016/0040-4020(82)85027-8 .
- ^ Локнер, Джеймс. «Стехиометрическая химия енамина» (PDF) . Baran Group, Исследовательский институт Скриппса . Проверено 26 ноября 2014 г.