Органокатализ

В органической химии органокатализ — это форма катализа , при которой скорость химической реакции увеличивается за счет органического катализатора. Этот «органокатализатор» состоит из углерода , водорода , серы и других неметаллических элементов, содержащихся в органических соединениях. [3] [4] [5] [6] [7] [8] Из-за их сходства по составу и описанию их часто ошибочно принимают за ферменты из -за их сопоставимого влияния на скорость реакций и участвующие формы катализа.
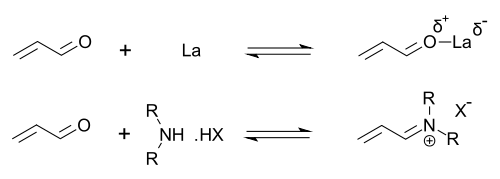
Органокатализаторы, которые обладают вторичной аминной функциональностью, могут быть описаны как осуществляющие либо енаминовый катализ (путем образования каталитических количеств активного нуклеофила енамина ), либо иминиевый катализ (путем образования каталитических количеств активированного иминиевого электрофила). Этот механизм типичен для ковалентного органокатализа. Ковалентное связывание субстрата обычно требует высокой загрузки катализатора (для пролинового катализа обычно 20–30 мол%).Нековалентные взаимодействия, такие как водородные связи, способствуют низкой загрузке катализатора (до 0,001 моль%).
Органокатализ дает ряд преимуществ. Нет необходимости в катализе на основе металлов, что вносит вклад в зеленую химию . В этом контексте простые органические кислоты использовались в качестве катализатора модификации целлюлозы в воде в многотонных масштабах. [9] Когда органокатализатор является хиральным, открывается путь к асимметричному катализу ; например, использование пролина в альдольных реакциях является примером хиральности и зеленой химии. [10] Химики-органики Дэвид Макмиллан и Бенджамин Лист были удостоены Нобелевской премии по химии 2021 года за работу по асимметричному органокатализу. [11]
Введение
[ редактировать ]Обычные ахиральные органокатализаторы основаны на азоте, таком как пиперидин, используемый в конденсации Кнёвенагеля . [12] DMAP используется при этерификации [13] и DABCO, используемые в реакции Бейлиса-Хиллмана . [14] Соли тиазолия используются в реакции Стеттера . Эти катализаторы и реакции имеют долгую историю, но в настоящее время интерес к органокатализу сосредоточен на асимметричном катализе с использованием хиральных катализаторов, называемом асимметричным органокатализом или энантиоселективным органокатализом . Новаторская реакция, разработанная в 1970-х годах, называется реакцией Хаджоса-Пэрриша-Эдера-Зауэра-Вихерта . В период с 1968 по 1997 год было лишь несколько сообщений об использовании малых органических молекул в качестве катализаторов асимметричных реакций (вероятно, самой известной является реакция Хаджоса-Пэрриша), но эти химические исследования рассматривались скорее как уникальные химические реакции, чем как целостные процессы. части более крупного, взаимосвязанного поля. [15]
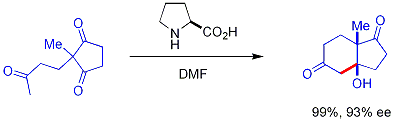
В этой реакции встречающийся в природе хиральный пролин является хиральным катализатором реакции Альдола . Исходным материалом является ахиральный трикетон , и для получения продукта реакции, кетола, требуется всего 3% пролина в 93% энантиомерном избытке . Это первый пример асимметричной альдольной реакции, катализируемой аминокислотами. [16] [17]
Асимметричный синтез кетона Виланда-Мишера применением было одно из преобразований в полном синтезе эритромицина (1985) также основан на пролине, и еще одним ранним Робертом Б. Вудвордом (1981). [18] Мини-обзорный дайджест посвящен избранным недавним примерам полного синтеза натуральных и фармацевтических продуктов с использованием органокаталитических реакций. [19]
Многие хиральные органокатализаторы представляют собой адаптацию хиральных лигандов (которые вместе с металлическим центром также катализируют асимметричные реакции), и обе концепции в некоторой степени перекрываются.
Прорыв в области органокатализа произошел в 1997 году, когда Иан Ши сообщил о первой общей высокоэнантиоселективной органокаталитической реакции с каталитическим асимметричным эпоксидированием транс- и тризамещенных олефинов хиральными диоксиранами. [20] С тех пор было разработано несколько различных типов реакций.
Классы органокатализаторов
[ редактировать ]Органокатализаторы асимметрического синтеза можно разделить на несколько классов:
- Биомолекулы : пролин , фенилаланин . Вторичные амины вообще. [21] Алкалоиды хинного дерева , некоторые олигопептиды .
- Синтетические катализаторы, полученные из биомолекул.
- Катализаторы водородных связей , в том числе ТАДДОЛЫ , производные БИНОЛА, такие как НОБИН , и органокатализаторы на основе тиомочевины.
- нового поколения реакции Стеттера Соли триазолия как катализаторы
Примерами асимметричных реакций с участием органокатализаторов являются:
- Асимметричные реакции Дильса-Альдера
- Асимметричные реакции Михаэля
- Асимметричные реакции Манниха
- Ши эпоксидирование
- Органокаталитическое трансферное гидрирование
Пролин
[ редактировать ]Был рассмотрен пролиновый катализ. [22] [23]
Имидазолидиноновый органокатализ
[ редактировать ]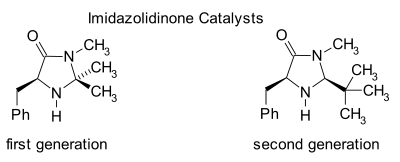
Имидазолидиноны являются катализаторами многих превращений, таких как асимметричные реакции Дильса-Альдера и присоединения Михаэля . Хиральные катализаторы вызывают асимметричные реакции , часто с высокой энантиоселективностью. Этот катализатор работает путем образования иминиевого иона с карбонильными группами α,β-ненасыщенных альдегидов ( эналей ) и енонов в быстром химическом равновесии . Эта иминиевая активация аналогична активации карбонильных групп кислотой Льюиса субстрата , и оба катализатора снижают LUMO : [24] [25]
Временное промежуточное соединение иминия является хиральным и переносится на продукт реакции посредством хиральной индукции . Катализаторы использовались в реакциях Дильса-Альдера , присоединения Михаэля , алкилирования Фриделя-Крафтса , переносного гидрирования и эпоксидирования .
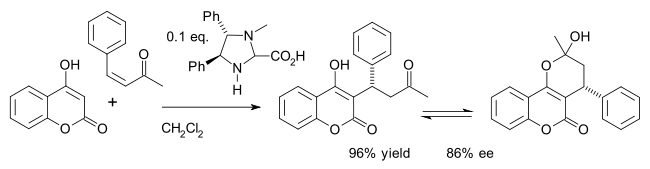
Одним из примеров является асимметричный синтез препарата варфарин (в равновесии с гемикеталем ) путем добавления по Михаэлю гидроксикумарина 4- и бензилиденацетона : [26]
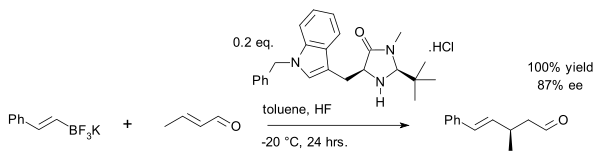
Недавним достижением является виниловое алкилирование кротональдегида солью органотрифторборатной : [27]
Другие примеры его использования: см. Органокаталитическое трансферное гидрирование и асимметричные реакции Дильса-Альдера .
Органокатализ тиомочевины
[ редактировать ]Большая группа органокализаторов включает фрагмент мочевины или тиомочевины . Эти каталитически эффективные производные (тио)мочевины, называемые органокатализаторами (тио)мочевины, обеспечивают явные взаимодействия с двойными водородными связями для координации и активации субстратов, акцептирующих H-связь. [28]
Их нынешнее использование ограничено асимметричными многокомпонентными реакциями, в том числе реакциями присоединения Михаэля, асимметричными многокомпонентными реакциями синтеза спироциклов, асимметричными многокомпонентными реакциями с участием ацильных реакций Штрекера, асимметричными реакциями Петасиса, асимметричными реакциями Биджинелли, асимметричными реакциями Манниха, асимметричными реакциями аза-Генри. и асимметричные реакции восстановительного сочетания. [29]
Ссылки
[ редактировать ]- ^ Юстус фон Либих, Юстус (1860). «Об образовании оксамида из циана» . Анналы химии и фармации . 113 (2): 246–247. дои : 10.1002/jlac.18601130213 .
- ^ В. Лангенбек (1929). «Об органических катализаторах. III. Образование оксамида из дицианина в присутствии альдегидов». Анна Либиха . 469 : 16-25. дои : 10.1002/jlac.19294690103 .
- ^ Беркессель, А.; Грегер, Х. (2005). Асимметричный органокатализ . Вайнхайм: Wiley-VCH. ISBN 978-3-527-30517-9 .
- ^ Специальный выпуск: Список, Бенджамин (2007). «Органокатализ» . хим. Преподобный . 107 (12): 5413–5883. дои : 10.1021/cr078412e .
- ^ Петр Иванович Далько; Лайонел Мойсан (2004). «В золотой век органокатализа». Энджью. хим. Межд. Эд . 43 (39): 5138–5175. дои : 10.1002/anie.200400650 . ПМИД 15455437 .
- ^ Мэтью Дж. Гонт; Карин СиСи Йоханссон; Энди МакНелли; Нгок Т. Во (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня . 12 (1/2): 8–27. дои : 10.1016/j.drudis.2006.11.004 . ПМИД 17198969 .
- ^ Дитер Эндерс; Кристоф Грондал; Маттиас Р.М. Хюттль (2007). «Асимметричные органокаталитические реакции домино». Энджью. хим. Межд. Эд . 46 (10): 1570–1581. дои : 10.1002/anie.200603129 . ПМИД 17225236 .
- ^ Петр Иванович Далько; Лайонел Мойсан (2001). «Энантиоселективный органокатализ». Энджью. хим. Межд. Эд . 40 (20): 3726–3748. doi : 10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D . ПМИД 11668532 .
- ^ Международный патент WO 2006068611 A1 20060629 «Прямая гомогенная и гетерогенная модификация аминов и спиртов, катализируемая органическими кислотами и аминокислотами». Изобретатели: Армандо Кордова, Стокгольм, Швеция; Йонас Хафрен, Стокгольм, Швеция.
- ^ Пример 4 в патенте США № 3975440 от 17 августа 1976 г., поданном 9 декабря 1970 г. Золтан Г. Хайос и Дэвид Р. Пэрриш.
- ^ «Нобелевская премия по химии 2021 года» . Нобелевская премия . Нобелевская премия . Проверено 6 октября 2021 г.
- ^ Лист, Б. (2010). «Эмиль Кневенагель и корни аминокатализа». Angewandte Chemie International Edition на английском языке . 49 (10): 1730–1734. дои : 10.1002/anie.200906900 . ПМИД 20175175 .
- ^ Нейсес, Бернхард; Стеглих, Вольфганг (июль 1978 г.). «Простой метод этерификации карбоновых кислот». Angewandte Chemie International Edition на английском языке . 17 (7): 522–524. дои : 10.1002/anie.197805221 .
- ^ Басавайя, Диви; Рао, Анумолу Джаганмохан; Сатьянараяна, Тумманапалли (март 2003 г.). «Последние достижения в реакции Бейлиса-Хиллмана и ее применения». Химические обзоры . 103 (3): 811–892. дои : 10.1021/cr010043d . ПМИД 12630854 .
- ^ Макмиллан, Дэвид У.К. (2008). «Появление и развитие органокатализа». Природа . 455 (7211). ООО «Спрингер Сайенс энд Бизнес Медиа»: 304–308. Бибкод : 2008Natur.455..304M . дои : 10.1038/nature07367 . ISSN 0028-0836 . ПМИД 18800128 . S2CID 205215034 .
- ^ З.Г. Хайос, Д.Р. Пэрриш, патент Германии DE 2102623, 1971 г.
- ^ Золтан Г. Хайос; Дэвид Р. Пэрриш (1974). «Асимметричный синтез бициклических промежуточных продуктов химии природных продуктов». Дж. Орг. Хим . 39 (12): 1615–1621. дои : 10.1021/jo00925a003 .
- ^ Р.Б. Вудворд; Э. Логуш; КП Намбиар; К. Сакан; Д.Е. Уорд; Б.В. Ау-Юнг; П. Баларам; Эл Джей Браун; и др. (1981). «Асимметричный общий синтез эритромцина. 1. Синтез производного эритронолида А секокислоты посредством асимметричной индукции». Дж. Ам. хим. Соц . 103 (11): 3210–3213. дои : 10.1021/ja00401a049 .
- ^ Б.-Ф. Солнце (2015). «Тотальный синтез натуральных и фармацевтических продуктов на основе органокаталитических реакций» . Тетраэдр Летт . 56 (17): 2133–2140. дои : 10.1016/j.tetlet.2015.03.046 .
- ^ Ван, Чжи-Сянь; Ту, Ён; Фрон, Майкл; Чжан, Цзянь-Ронг; Ши, Ян (1 ноября 1997 г.). «Эффективный метод каталитического асимметричного эпоксидирования» . Журнал Американского химического общества . 119 (46): 11224–11235. дои : 10.1021/ja972272g . ISSN 0002-7863 .
- ^ Бертельсен, Сорен (2009). «Органокатализ — после золотой лихорадки». Обзоры химического общества . 38 (8): 2178–89. дои : 10.1039/b903816g . ПМИД 19623342 .
- ^ Гонт, MJ; Йоханссон, CCC; МакНелли, А.; Во, NT (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня . 12 (1–2): 8–27. дои : 10.1016/j.drudis.2006.11.004 . ПМИД 17198969 .
- ^ Кучеренко А.С.; Сюткин, Д.Э.; Мальцев О.В.; Кочетков С.В.; Злотин, С.Г. (2013). «Асимметричный органокатализ: от пролина к высокоэффективным иммобилизованным органокатализаторам». Российский химический вестник . 61 (7): 1313. doi : 10.1007/s11172-012-0177-4 . S2CID 93168492 .
- ^ Жеральд Леле; Дэвид У.К. Макмиллан (2006). «Современные стратегии органического катализа: появление и развитие активации иминием» (PDF) . Альдрихимика Акта . 39 (3): 79.
- ^ Эрккиля, Анниина; Махандер, Ингер; Пихко, Петри М. (2007). «Иминиевый катализ». хим. Преподобный 107 (12): 5416–5470. дои : 10.1021/cr068388p . ПМИД 18072802 .
- ^ Нис Халланд; Торе Хансен; Карл Анкер Йоргенсен (2003). «Органокаталитическая асимметричная реакция Михаэля циклических 1,3-дикарбонильных соединений и α,β-ненасыщенных кетонов - высокоатомно-экономичное каталитическое одностадийное образование оптически активного варфаринового антикоагулянта». Энджью. хим. Межд. Эд . 42 (40): 4955–4957. дои : 10.1002/anie.200352136 . ПМИД 14579449 .
- ^ Сандра Ли; Дэвид У.К. Макмиллан (2007). «Органокаталитическое винилирование и алкилирование Фриделя-Крафтса трифторборатными солями» (PDF) . Дж. Ам. хим. Соц . 129 (50): 15438–15439. дои : 10.1021/ja0767480 . ПМИД 18031044 . S2CID 34848947 .
- ^ Мадарас, Адам; Доса, Жолт; Варга, Солид; Соос, Тибор; Чампай, Антал; Папай, Имре (июль 2016 г.). «Производные тиомочевины как органокатализаторы кислоты Бренстеда» (PDF) . АКС-катализ . 6 (7): 4379–4387. дои : 10.1021/accatal.6b00618 .
- ^ Парвин, Тасним; Ядава, Рахул; Чоудри, Локман (2020). «Недавние применения органокатализаторов на основе тиомочевины в асимметричных многокомпонентных реакциях (AMCR)» . Орг. Биомол. Хим . 18 : 5513–5532. дои : 10.1039/D0OB00595A .
Внешние ссылки
[ редактировать ] СМИ, связанные с органокатализом, на Викискладе?
СМИ, связанные с органокатализом, на Викискладе?  Словарное определение органокатализа в Викисловаре
Словарное определение органокатализа в Викисловаре  Цитаты, связанные с органокатализом , в Wikiquote
Цитаты, связанные с органокатализом , в Wikiquote