Дисилоксан
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Дисилоксан
| |
| Другие имена
Дисилиловый эфир
Дисилилоксид | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Сокращения | ДС ДСЕ |
| КЭБ | |
| ХимическийПаук | |
| 1206 | |
| МеШ | Дисилоксан |
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Н 6 О Si 2 | |
| Молярная масса | 78.217 g·mol −1 |
| Появление | Бесцветный газ |
| Точка кипения | -15,2 ° C (4,6 ° F; 257,9 К) |
| 0,24 Д | |
| Структура | |
| орторомбический | |
| Пмм 2 | |
| Бент | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения
|
Диметиловый эфир |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
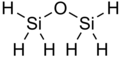
Дисилоксан имеет химическую формулу Si.
22Ч
6 О. Это простейший известный силоксан, содержащий только водородные R-группы. Молекула содержит шесть эквивалентных связей Si-H и две эквивалентные связи Si-O. Дисилоксан при стандартных условиях существует в виде бесцветного резкого газа. Однако в целом он безопасен для использования человеком, о чем свидетельствует его широкое использование в косметике. Он также широко известен как дисилиловый эфир, дисилилоксид и пергидродисилоксан.
Структура
[ редактировать ]Дисилоксан имеет простую структуру, состоящую из силоксановой связи (Si-O-Si) и водородных R-групп.
Структура дисилоксана изучалась различными спектроскопическими методами, такими как дифракция электронов , [ 1 ] рентгеновская кристаллография , [ 2 ] дипольный момент и спектроскопия ядерного магнитного резонанса . Из-за своей необычной природы валентные углы Si-O-Si широко изучаются. Эти связи обычно имеют углы, превышающие средний показатель, примерно от 130 до 160 градусов, а большая длина связей не является редкостью. [ 3 ] Например, в твердом состоянии при температуре 108 К сам дисилоксан имеет валентный угол Si-O-Si 142°. [ 2 ] Напротив, валентный угол C-O-C в углеродном аналоге дисилоксана, диметиловом эфире , составляет 111 °. [ 4 ]
Необычный валентный угол в дисилоксане объясняется в первую очередь отрицательным гиперсопряжением кислорода между p -орбиталями и кремний-углеродными σ* -разрыхляющими орбиталями, p (O) → σ*(Si ^-R), формой обратной связи π . Вторичный и гораздо меньший вклад в связь кремний-кислород в дисилоксанах включает π-связь от 2 p -орбиталей кислорода к 3 d -орбиталям кремния, p (O) → d (Si). Из-за этого взаимодействия связи Si-O могут проявлять частичное поведение двойной связи, а атомы кислорода гораздо менее основные , чем в углеродном аналоге, диметиловом эфире. [ 5 ]
Помимо исследований валентных углов, также был проведен колебательный анализ для определения элементов симметрии дисилоксана. ИК- и рамановская спектроскопия были использованы для определения точечной группы D 3d . [ нужна ссылка ]
В то время как дисилоксан сам по себе имеет изогнутую молекулярную геометрию по кислороду, родственное соединение гексафенилдисилоксан Ph 3 Si-O-SiPh 3 имеет угол Si-O-Si 180°. [ 6 ]
Синтез
[ редактировать ]Синтез дисилоксана обычно осуществляется путем взятия гидросилана с уходящей группой заместителя и его реакции с водой с образованием силанола. Затем силанол вступает в реакцию сам с собой с образованием конечного дисилоксана путем дегидратационного сочетания. Это показано в реакциях ниже:
H 3 SiX + H 2 O → H 3 SiOH + HX (первый этап)
2 H 3 SiOH → H 3 SiOSiH 3 + H 2 O (вторая ступень)
Другие методы синтеза предполагают использование золота на углероде в качестве катализатора реакции, проводимой в воде, а также InBr 3 - катализируемое окисление гидросиланов.
Использование
[ редактировать ]Дисилоксаны можно использовать в качестве герметиков для строительства, красок, чернил и покрытий, косметики, механических жидкостей, текстильных изделий и покрытий для бумаги.
Коммерческое использование дисилоксана широко распространено в косметике. Его обычно можно найти в таких продуктах, как солнцезащитный крем, увлажняющий крем, лак для волос, подводка для глаз, спрей для тела, лак для ногтей, средства для снятия макияжа и кондиционеры. Свойства, которые дисилоксан проявляет в этих продуктах, включают быстрое высыхание, снижение жирности, увлажнение, кондиционирование кожи и пеногаситель (предотвращение образования пены).
Дисилоксаны одобрены как безопасные для подростков и детей. Силоксаны многих видов оказались чрезвычайно безопасными для местного применения, но могут быть опасными при проглатывании в больших количествах.
Вариации
[ редактировать ]Термин дисилоксан обычно используется для обозначения структур, которые имеют гораздо более сложные R-группы, чем водород. Наиболее распространенной молекулой, использующей это название, является гексаметилдисилоксан , который заменяет водородные группы метильными группами. Другие распространенные варианты включают использование дисилоксанов в качестве мостиков и спейсеров в более крупных соединениях, таких как полимеры.
Ссылки
[ редактировать ]- ^ Альменнинген, А.; Бастиансен, О.; Юинг, В.; Хедберг, Кеннет; Треттеберг, М. (1963). «Молекулярная структура дисилоксана (SiH 3 ) 2 O» . Акта Хим. Скан. 17 : 2455–2460. doi : 10.3891/acta.chem.scand.17-2455 .
- ^ Jump up to: а б Барроу, MJ; Эбсворт, EAV; Хардинг, ММ (1979). «Кристаллическая и молекулярная структура дисилоксана (при 108 К) и гексаметилдисилоксана (при 148 К)». Акта Кристаллогр. Б. 35 : 2093–2099. дои : 10.1107/S0567740879008529 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 342–344, 348–349. ISBN 978-0-08-037941-8 .
- ^ Войнович, Крунослав; Лоузхэнд, Удо; Митцель, Ноберт В. (2004). «Агрегация дихлорсилана и диметилового эфира: новый мотив в образовании аддукта галосилана». Далтон Транс. (16): 2578–2581. дои : 10.1039/B405684A . ПМИД 15303175 .
- ^ Данкерт, Фабиан; фон Ханиш, Карстен (2021). «Возвращение к силоксановой координации: характер связи Si-O, реакционная способность и великолепные молекулярные формы». Евро. Дж. Неорг. хим. 2021 (29): 2907–2927. дои : 10.1002/ejic.202100275 . S2CID 239645449 .
- ^ Глайдвелл, К.; Лайлз, округ Колумбия (1978). «Кристаллическая и молекулярная структура оксобис[трифенилкремния(IV)]» . Акта Кристаллогр. Б. 34 : 124–128. дои : 10.1107/S0567740878002435 . S2CID 98347658 .
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( Ноябрь 2018 г. ) |
- Савама, Ю.; Масуда, М.; Ясукава, Н.; Накатани, Р.; Нисимура, С.; Шибата, К.; Ямада, Т.; Монгучи, Ю.; Сузука, Х.; Такаги, Ю.; Садзики, Х. Журнал органической химии , 2016, 81 , 4190–4195.
- Дисилоксан https://pubchem.ncbi.nlm.nih.gov/compound/Disiloxane (по состоянию на 23 марта 2018 г.).
- Лассен, К.; Хансен, К.; Миккельсен, С.; Мааг, Дж. Силоксаны – потребление, токсичность и альтернативы ; Министерство окружающей среды Дании, 2018 г.
- Лорд, Р.; Робинсон, Д.; Шумб, В. Журнал Американского химического общества, 1956, 78 , 1327–1332.
- Варма, Р.; МакДиармид, А.; Миллер, Дж. Неорганическая химия , 1964, 3 , 1754–1757.
- БОК, Х.; МОЛЛЕРЕ, П.; БЕККЕР, Г.; ФРИЦ, Г. Служба химической информации , 1974, 5 , 113–125.
- Дисилоксаны | Х6ОСи2 | ChemSpider http://www.chemspider.com/Chemical-Structure.109921.html (по состоянию на 23 марта 2018 г.).
