трет -Бутиллитий

| |
| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
трет -Бутиллитий [ нужна ссылка ] | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 3587204 | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.008.939 |
| Номер ЕС |
|
ПабХим CID
|
|
| Число | 3394 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| ЛиК 44ч 9 | |
| Молярная масса | 64.055 g mol −1 |
| Появление | Бесцветное твердое вещество |
| Плотность | 660 мг см −3 |
| Точка кипения | От 36 до 40 ° C (от 97 до 104 ° F; от 309 до 313 К) |
| Реагирует | |
| Кислотность ( pKa ) | 45–53 |
| Опасности | |
| СГС Маркировка : | |
    
| |
| Опасность | |
| H225 , H250 , H260 , H300 , H304 , H310 , H314 , H330 , H336 , H411 | |
| П210 , П222 , П223 , П231+П232 , П370+П378 , П422 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | -6,6 ° C (20,1 ° F; 266,5 К) |
| Родственные соединения | |
Родственные соединения
|
н -Бутиллитий |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
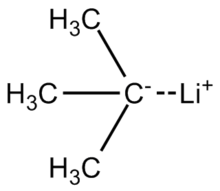
трет -Бутиллитий представляет собой химическое соединение формулы 3 (CH 3 ) CLi . Как литийорганическое соединение , оно находит применение в органическом синтезе , поскольку является сильным основанием , способным депротонировать многие молекулы углерода, включая бензол . трет -Бутиллитий коммерчески доступен в виде растворов в углеводородах (таких как пентан); его обычно не готовят в лаборатории.
Подготовка
[ редактировать ]Трет -Бутиллитий производится в промышленных масштабах путем обработки трет- бутилхлорида металлическим литием. О его синтезе впервые сообщил Р.Б. Вудворд в 1941 году. [1]
Структура и связь
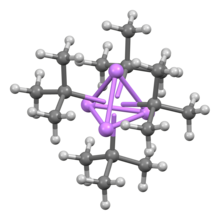
[ редактировать ]Как и другие литийорганические соединения, трет -бутиллитий представляет собой кластерное соединение . В то время как н -бутиллитий существует как в виде гексамера, так и в виде тетрамера, трет -бутиллитий существует исключительно в виде тетрамера с кубиновой структурой . Связывание в литийорганических кластерах включает сигма-делокализацию и значительную связь Li-Li. [2] Несмотря на сложную структуру, трет -бутиллитий обычно изображается в уравнениях как мономер.
Связь литий-углерод в трет- бутиллитии сильно поляризована, имеет около 40 процентов ионного характера . Молекула реагирует как карбанион , что представлено этими двумя резонансными структурами : [3]
Реакции
[ редактировать ]трет -Бутиллитий известен депротонированием углеродных кислот (связей CH). Одним из примеров является двойное депротонирование аллилового спирта . [4] Другими примерами являются депротонирование виниловых эфиров . [5] [6] [7]
В сочетании с н -бутиллитием трет -бутилллитий монолитирует ферроцен . [8] трет -Бутиллитий депротонирует дихлорметан : [9]
- H 2 CCl 2 + RLi → HCCl 2 Li + RH
Подобно н -бутиллитию, трет -бутиллитий можно использовать в реакциях обмена лития и галогена . [10] [11]
Совместимость с растворителями
[ редактировать ]Чтобы свести к минимуму разложение растворителями, реакции с участием трет -бутиллития часто проводятся при очень низких температурах в специальных растворителях, таких как смесь растворителей Траппа .
В большей степени, чем другие соединения алкиллития, трет -бутиллитий реагирует с простыми эфирами . [2] В диэтиловом эфире период полураспада бутиллития трет- составляет около 60 минут при 0 °C. Он еще более активен по отношению к тетрагидрофурану (ТГФ); период полураспада в растворах ТГФ составляет около 40 минут при -20 ° C. [12] В диметоксиэтане период полураспада составляет около 11 минут при -70 ° C. [13]
реакция трет В этом примере показана -бутиллития с (ТГФ):
Безопасность
[ редактировать ]трет- бутиллитий является пирофорным веществом, что означает, что он самопроизвольно воспламеняется при контакте с воздухом. Безвоздушные методы важны для предотвращения бурной реакции этого соединения с кислородом и влагой:
- т -BuLi + O 2 → т -BuOOLi
- t -BuLi + H 2 O → t -BuH + LiOH
Растворители, используемые в обычных коммерческих препаратах, сами по себе огнеопасны. Хотя с этим соединением можно работать, используя перенос через канюлю , следы трет -бутиллития на кончике иглы или канюли могут воспламениться и засорить канюлю солями лития. В то время как некоторые исследователи воспринимают этот эффект «пилотного света» как признак того, что продукт «свежий» и не испортился из-за времени или неправильного хранения/обращения, другие предпочитают заключать кончик иглы или канюлю в короткую стеклянную трубку, которая продуты инертным газом и герметизированы с каждого конца перегородками. [14] серьезные лабораторные аварии, связанные с трет Произошли -бутиллитием. Например, в 2008 году научный сотрудник Шехарбано Санджи в лаборатории Патрика Харрана [15] в Калифорнийском университете в Лос-Анджелесе скончался после тяжелых ожогов в результате пожара, вызванного трет -бутиллитием. [16] [17] [18]
Крупномасштабные реакции могут привести к неконтролируемым реакциям, пожарам и взрывам, когда трет -бутиллитий смешивается с простыми эфирами, такими как диэтиловый эфир и тетрагидрофуран. Может быть предпочтительным использование углеводородных растворителей.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Бартлетт, Пол Д.; К. Гарднер Суэйн; Роберт Б. Вудворд (1941). «т-Бутиллитий». Дж. Ам. хим. Соц . 63 (11): 3229–3230. дои : 10.1021/ja01856a501 .
- ^ Перейти обратно: а б Эльшенбройх, К. (2006). Металлоорганические соединения . Вайнхайм: Wiley-VCH. ISBN 978-3-527-29390-2 .
- ^ КПК Воллхардт, Н. Э. Шор (1999). «Металлоорганические реагенты: источники нуклеофильного углерода для синтеза спиртов». Органическая химия: структура и функции, 3-е издание .
- ^ Рик Л. Данхайзер, Дэвид М. Финк, Кадзуо Окано, Юн-Мин Цай, Стивен В. Щепански (1988). «(1-оксо-2-пропенил)триметилсилан». Органические синтезы . 66 : 14. дои : 10.15227/orgsyn.066.0014 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джон А. Содерквист (1990). «Ацетилтриметилсилан». Органические синтезы . 68:25 . дои : 10.15227/orgsyn.068.0025 .
- ^ М.А. Чанц, Л.Е. Берджесс, А.И. Мейерс (1996). «4-кетоундекановая кислота». Органические синтезы . 73 : 215. дои : 10.15227/orgsyn.073.0215 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кшиштоф Яровицкий, Филип Дж. Коценски, Лю Цюнь (2002). «1,2-Металлатная перегруппировка: (Z)-4-(2-Пропенил)-3-октен-1-Ол». Органические синтезы . 79 : 11. дои : 10.15227/orgsyn.079.0011 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Карл А. Бусакка, Магнус К. Эрикссон, Низар Хаддад, З. Стив Хан, Джон К. Лоренц, Бо Цюй, Синчжун Цзэн, Крис Х. Сенанаяке (2013). «Практический синтез ди- трет -бутилфосфиноферроцена» . Органические синтезы . 90 : 316. дои : 10.15227/orgsyn.090.0316 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Мэттесон, Дональд С.; Маджумдар, Дебеш (1983). «Омологация эфиров бороновой кислоты на α-хлорбороновые эфиры». Металлоорганические соединения . 2 (11): 1529–1535. дои : 10.1021/om50005a008 .
- ^ Адам П. Смит, Скотт А. Сэвидж, Дж. Кристофер Лав, Кассандра Л. Фрейзер (2002). «Синтез 4-, 5- и 6-метил-2,2'-бипиридина с помощью стратегии перекрестного сочетания Негиши: 5-метил-2,2'-бипиридин». Органические синтезы . 78:51 . дои : 10.15227/orgsyn.078.0051 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Мерседес Амат, Сабина Хадида, Сваргам Сатьянараяна, Джоан Бош (1997). «Региоселективный синтез 3-замещенных индолов: 3-этилиндол». Органические синтезы . 74 : 248. дои : 10.15227/orgsyn.074.0248 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Станетти, П; Коллер, Х.; Миховилович, М. (1992). «Направленное орто-литиирование 1,1-диметилэтилового эфира фенилкарбаминовой кислоты ( N -BOC-анилин). Пересмотр и улучшения». Журнал органической химии . 57 (25): 6833–6837. дои : 10.1021/jo00051a030 .
- ^ Фитт, Джей-Джей; Гшвенд, HE (1984). «Реакция н-, втор- и трет-бутиллития с диметоксиэтаном (ДМЭ): поправка». Журнал органической химии . 49 : 209–210. дои : 10.1021/jo00175a056 .
- ^ Эррингтон, РМ (1997). Расширенная практическая неорганическая и металлоорганическая химия ( отрывок из Google Books ) . Лондон: Blackie Academic & Professional. стр. 47–48. ISBN 978-0-7514-0225-4 .
- ^ «Лаборатория Харрана: Калифорнийский университет в Лос-Анджелесе» . Архивировано из оригинала 13 октября 2012 г. Проверено 21 сентября 2011 г.
- ^ Джиллиан Кемсли (22 января 2009 г.). «Исследователь погиб после пожара в лаборатории» . Новости химии и техники .
- ^ Джиллиан Кемсли (3 апреля 2009 г.). «Уроки Калифорнийского университета в Лос-Анджелесе: подробности эксперимента, который привел к смерти исследователя, побуждают к оценке методов академической безопасности» . Новости химии и техники .
- ^ Лос-Анджелес Таймс , 1 марта 2009 г.



