Амид лития
 | |
| Имена | |
|---|---|
| Название ИЮПАК Амид лития | |
| Другие имена Азанид лития Посетите это | |
| Идентификаторы | |
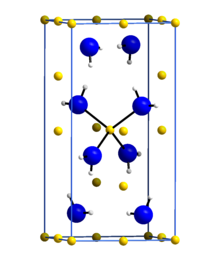
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.062 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ЛиНХ 2 | |
| Молярная масса | 22.96 g·mol −1 |
| Появление | белое твердое вещество |
| Плотность | 1,178 г/см 3 |
| Температура плавления | 375 ° C (707 ° F; 648 К) |
| Точка кипения | 430 ° C (806 ° F; 703 К) разлагается. |
| реагирует | |
| Растворимость | слабо растворим в этаноле нерастворим в аммиаке |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -182 кДж/моль |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Амид лития или азанид лития представляет собой неорганическое соединение с химической формулой ЛиНХ 2 . Это белое твердое вещество с тетрагональной кристаллической структурой. [1] Амид лития можно получить обработкой металлического лития жидким аммиаком : [2]
- 2 Li + 2 NH 3 → 2 LiNH 2 + H 2
Амид лития при нагревании разлагается на аммиак и имид лития . [3]
Приложения
[ редактировать ]Амид лития в смеси с гидридом лития находит применение в хранении водорода . [4] [3] Реакция начинается с разложения амида лития на аммиак и имид лития . Затем гидрид лития депротонирует аммиак с образованием амида лития. Обратная реакция может происходить между водородом и побочным продуктом имида лития.
Другие амиды лития
[ редактировать ]Сопряженные основания аминов известны как амиды. Таким образом, амид лития может также относиться к любому соединению класса литиевой соли амина . Эти соединения имеют общий вид LiNR 2 которого является сам химический амид лития , исходной структурой . Обычные амиды лития включают диизопропиламид лития (LDA), тетраметилпиперидид лития (LiTMP) и гексаметилдисилазид лития (LiHMDS). Их получают реакцией металлического лития с соответствующим амином:
- 2 Li + 2 R 2 NH → 2 LiNR 2 + H 2
Амиды лития являются очень реакционноспособными соединениями. В частности, они являются сильными базами .
Примеры
[ редактировать ]Тетраметилпиперидид лития кристаллизован в виде тетрамера. [5] С другой стороны, литиевое производное бис(1-фенилэтил)амина кристаллизуется в виде тримера: [6]
 |  |
Также возможно получение смешанных олигомеров алкоксидов и амидов металлов. [7] Они относятся к супероснованиям , которые представляют собой смеси алкоксидов металлов и алкилов. Циклические олигомеры образуются, когда азот амида образует сигма-связь с литием, а неподеленная пара азота связывается с другим металлическим центром.
Обычно считается, что другие литийорганические соединения (такие как BuLi ) существуют и функционируют посредством агрегированных частиц высокого порядка.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Дэвид, Уильям ИФ; Джонс, Мартин О.; Грегори, Дункан Х.; Джуэлл, Кэтрин М.; Джонсон, Саймон Р.; Уолтон, Аллан; Эдвардс, Питер П. (1 февраля 2007 г.). «Механизм нестехиометрии в реакции хранения водорода амид лития/имид лития» . Журнал Американского химического общества . 129 (6): 1594–1601. дои : 10.1021/ja066016s . ISSN 0002-7863 . ПМИД 17243680 .
- ^ П.В. Шенк (1963). «Амид лития». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 454.
- ^ Jump up to: а б Пинкертон, FE (1 сентября 2005 г.). «Кинетика разложения амида лития для материалов для хранения водорода» . Журнал сплавов и соединений . 400 (1): 76–82. дои : 10.1016/j.jallcom.2005.01.059 . ISSN 0925-8388 .
- ^ Итикава, Такаюки; Ханада, Нобуко; Исобе, Сигехито; Ленг, Хайян; Фуджи, Хиронобу (1 июня 2004 г.). «Механизм новой реакции LiNH 2 и LiH с Li 2 NH и H 2 как перспективная система хранения водорода» . Журнал физической химии Б. 108 (23): 7887–7892. дои : 10.1021/jp049968y . ISSN 1520-6106 .
- ^ М. Ф. Лапперт; Эм Джей Слэйд; А. Сингх; Дж. Л. Этвуд; Р.Д. Роджерс; Р. Шакир (1983). «Структура и реакционная способность пространственно-затрудненных амидов лития и их диэтилэфиратов: кристаллические и молекулярные структуры [Li{N(SiMe 3 ) 2 }(OEt 2 )] 2 и тетракис (2,2,6,6-тетраметилпиперидинатолитий)». Журнал Американского химического общества . 105 (2): 302–304. дои : 10.1021/ja00340a031 .
- ^ доктор Армстронг; К.В. Хендерсон; А. Р. Кеннеди; У. Дж. Керр; Ф.С. Майр; Дж. Х. Мойр; П.Х. Моран; Р. Снайт (1999). «Структурные исследования хиральных амидов лития [{PhC(H)Me} 2 NLi] и [PhCH 2 {PhC(H)Me}NLi·THF], полученных из α-метилбензиламина». Транзакции Далтона : 4063–4068. дои : 10.1039/A904725E .
- ^ К.В. Хендерсон, DS Walther и PG Williard (1995). «Идентификация комплекса оснований униметал методом 6 ЯМР-спектроскопия лития и анализ монокристаллов». Журнал Американского химического общества . 117 (33): 8680–8681. doi : 10.1021/ja00138a030 .
- Индекс Merck , 11-е издание, 5398 .
