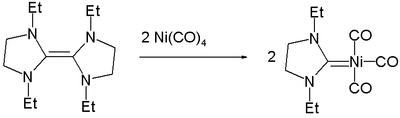
Никельорганическая химия

Никельорганическая химия — раздел металлоорганической химии , изучающий органические соединения , содержащие связи никель — углерод . [1] [2] Они используются в качестве катализатора, как строительный блок в органической химии и при химическом осаждении из паровой фазы . Никельорганические соединения также являются недолговечными промежуточными продуктами органических реакций. Первым никельорганическим соединением был тетракарбонил никеля Ni(CO) 4 , о котором сообщалось в 1890 году и который быстро применили в процессе Монда для очистки никеля. Никельорганические комплексы играют важную роль во многих промышленных процессах, включая карбонилирование , гидроцианирование и процесс получения высших олефинов Shell . [3] [4]
Классы соединений
[ редактировать ]Алкильные и арильные комплексы
[ редактировать ]Популярным реагентом является Ni(CH 3 ) 2 (тетраметилэтилендиамин) . [5]
Известны многие алкильные и арильные комплексы формулы NiR(X)L 2 . Примеры включают [(dppf)Ni(циннамил)Cl)], транс- (PCy 2 Ph) 2 Ni( о -толил)Cl]], (dppf)Ni( о -толил)Cl]], (TMEDA)Ni( о -толил)Cl и (TMEDA)NiMe 2 .

Соединения никеля типа NiR 2 также существуют всего лишь с 12 валентными электронами. Однако в растворе растворитель всегда взаимодействует с атомом металла, увеличивая количество электронов. Одним из соединений 12 VE является ди(мезитил)никель, полученный из (аллила) 2 Ni 2 Br 2 и соответствующего реактива Гриньяра .
- (аллил) 2 Ni 2 Br 2 + 4 C 6 H 2 Me 3 MgBr → 2 (аллил)MgBr + 2 MgBr 2 + 2 (C 6 H 2 Me 3 ) 2 Ni
Алкеновые комплексы
[ редактировать ]Существует множество комплексов никеля, координированного с алкеном . Практическое применение этой темы включает полимеризацию или олигомеризацию алкенов, как в процессе Shell по производству высших олефинов . [7] В этих соединениях никель формально является нульвалентным Ni. 0 а связь описывается моделью Дьюара-Чатта-Дункансона . Одним из распространенных представителей является бис(циклооктадиен)никель(0) (Ni(COD) 2 ), который содержит два циклооктадиеновых лиганда. Это соединение 18VE с 10 электронами, обеспечиваемыми самим никелем, и еще 4x2 электронами, обеспечиваемыми двойными связями. Это твердое вещество, плавящееся при 60 °C, используется в качестве катализатора и предшественника многих других соединений никеля.
Аллильные комплексы
[ редактировать ]
Никель образует несколько простых аллильных комплексов . Аллилгалогениды реагируют с Ni(CO) 4 с образованием пи-аллильных комплексов (аллил) 2 Ni 2 Cl 2 . [8] Эти соединения, в свою очередь, являются источниками аллильных нуклеофилов . В (аллил) 2 Ni 2 Br 2 и (аллил)Ni(C 5 H 5 ) никелю присвоена степень окисления +2, а число электронов равно 16 и 18 соответственно. Бис(аллил)никель получают из бромида аллилмагния и хлорида никеля .
Циклопентадиенильные комплексы
[ редактировать ]Никелоцен NiCp 2 со степенью окисления Ni +2 и 20 валентными электронами является основным металлоценом никеля. Его можно окислить одним электроном. Соответствующие палладоцен и платиноцен неизвестны. Из никельоцена образуется множество производных, например CpNiLCl, CpNiNO и Cp 2 Ni 2 (CO) 3 .
Карбеновые комплексы
[ редактировать ]Никель образует карбеновые комплексы, формально содержащие двойные связи C=Ni. [9]
Реакции
[ редактировать ]Алкен/алкиновая олигомеризация
[ редактировать ]Соединения никеля олигомеризацию алкенов катализируют и алкинов . Это свойство подтвердило исследования и разработки катализаторов Циглера-Натта в 1950-х годах. Это открытие было продемонстрировано примесями никеля, происходящими из автоклава , которые остановили реакцию распространения ( Aufbau ) в пользу реакции обрыва с образованием концевого алкена : полимеризация этилена внезапно остановилась на 1-бутене . Этот так называемый эффект никеля побудил к поиску других катализаторов, способных к этой реакции, в результате чего были обнаружены новые катализаторы, которые технически производят полимеры с высокой молярной массой, такие как современные катализаторы Циглера-Натта.
Одной из практических реализаций олигомеризации алкинов является синтез Реппе ; например, при синтезе циклооктатетраена :
Это формальное [2+2+2+2] циклоприсоединение . Олигомеризация бутадиена с этиленом до транс-1,4-гексадиена когда-то была промышленным процессом.
Формальное [2+2+2]циклоприсоединение также имеет место при тримеризации алкинов . Эта расширяемая тримеризация обычно может включать бензол . [10] Бензин образуется in situ из бензольного соединения, присоединенного к трифлату и триметилсилильному заместителю в орто- положениях, и реагирует с диином, таким как 1,7-октадиин, вместе с каталитической системой никель(II) бромид / цинк (NiBr). 2- бис(дифенилфосфино)этан /Zn) для синтеза соответствующего производного нафталина .
В каталитическом цикле элементарный цинк служит для восстановления никеля (II) до никеля (0), с которым затем можно координировать две алкиновые связи. Далее следует стадия циклометалирования до промежуточного соединения никельциклопентадиена, а затем координация бензона , что дает реакцию внедрения CH в соединение никельциклогептатриена. Восстановительное элиминирование высвобождает соединение тетрагидроантрацена.
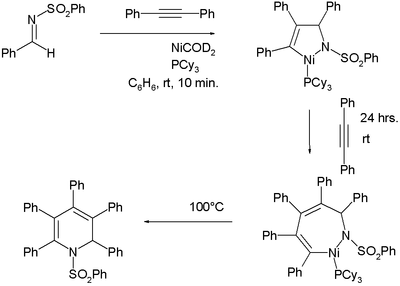
Образование никельорганических соединений в реакциях этого типа не всегда очевидно, но в тщательно спланированном эксперименте количественно образуются два таких промежуточных соединения: [11] [12]
Это отмечается в одном исследовании [13] что эта реакция работает только с самим ацетиленом или с простыми алкинами из-за плохой региоселективности . Изомеры концевого алкина 7, возможно, отличаются положением заместителей или положением двойной связи. Одна из стратегий решения этой проблемы предполагает использование определенных средств:
Выбранные условия реакции также минимизируют количество образующегося конкурирующего продукта [2+2+2]циклоприсоединения к соответствующему замещенному арену.
Реакции сцепления
[ редактировать ]Соединения никеля реакцию сочетания аллила и арилгалогенидов вызывают . Другими реакциями сочетания с участием никеля в каталитических количествах являются реакция Кумады и реакция Негиши .
Карбонилирование Ni
[ редактировать ]Ni катализирует присоединение оксида углерода к алкенам и алкинам. Промышленное производство акриловой кислоты в свое время заключалось в соединении ацетилена , оксида углерода и воды при 40–55 атм и 160–200 °С с бромидом никеля(II) и галогенидом меди.
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- П.В. Джолли, Г. Уилке, изд. (1974). Органическая химия никеля. Том I: Никельорганические комплексы . Академическая пресса. дои : 10.1016/B978-0-12-388401-5.X5001-5 . ISBN 9780123884015 .
Ссылки
[ редактировать ]- ^ Ф.А. Кэри Р.Дж. Сандберг. Передовая органическая химия, 2-е изд. ISBN 0-306-41199-7
- ^ Комплексная металлоорганическая химия III Роберт Крэбтри, Майк Мингос 2006 ISBN 0-08-044590-Х
- ^ Анаников, Валентин П. (2015). «Никель: «энергичная лошадь» катализа переходных металлов» . АКС-катализ . 5 (3): 1964–1971. дои : 10.1021/acscatal.5b00072 .
- ^ Таскер, Сара З.; Стэндли, Эрик А.; Джеймисон, Тимоти Ф. (2014). «Последние достижения в области гомогенного никелевого катализа» . Природа . 509 (7500): 299–309. Бибкод : 2014Natur.509..299T . дои : 10.1038/nature13274 . ПМЦ 4344729 . ПМИД 24828188 .
- ^ Гётткер-Шнетманн, Иниго; Мекинг, Стефан (2020). «Практический синтез [(tmeda)Ni(CH 3 ) 2 ], меченого изотопами [(tmeda)Ni( 13 CH 3 ) 2 ] и нейтральные хелатно-никелевые метиловые комплексы». Organometallics . 39 (18): 3433–3440. doi : 10.1021/acs.organomet.0c00500 . S2CID 224930545 .
- ^ Шилдс, Джейсон Д.; Грей, Эрин Э.; Дойл, Эбигейл Г. (01 мая 2015 г.). «Модульный, устойчивый на воздухе никелевый прекатализатор» . Органические письма . 17 (9): 2166–2169. doi : 10.1021/acs.orglett.5b00766 . ПМЦ 4719147 . ПМИД 25886092 .
- ^ Оливье-Бурбигу, Х .; Брей, Пенсильвания; Магна, Л.; Мишель, Т.; Эспада Пастор, М. Фернандес; Делькруа, Д. (2020). «Олигомеризация и димеризация олефинов, катализируемая никелем» . Химические обзоры . 120 (15): 7919–7983. doi : 10.1021/acs.chemrev.0c00076 . ПМИД 32786672 . S2CID 221124789 .
- ^ Мартин Ф. Семмельхак и Пол М. Хелквист (1988). «Реакция арилгалогенидов с галогенидами π-аллилникеля: металлилбензол» . Органические синтезы . 52 :115 ; Сборник томов , т. 6, с. 161 .
- ^ Данопулос, Андреас А.; Симлер, Томас; Браунштейн, Пьер (2019). «N-Гетероциклические карбеновые комплексы меди, никеля и кобальта». Химические обзоры . 119 (6): 3730–3961. doi : 10.1021/acs.chemrev.8b00505 . ПМИД 30843688 . S2CID 73515728 .
- ^ Джен-Чье Се и Чиен-Хонг Ченг (2005). «Никель-катализируемая коциклотримеризация аринов с диинами; новый метод синтеза производных нафталина». Химические коммуникации . 2005 (19): 2459–2461. дои : 10.1039/b415691a . ПМИД 15886770 .
- ^ Образование аза-никелацикла путем реакции имина и алкина с никелем (0): окислительная циклизация, вставка и восстановительное устранение Сенсуке Огоши Харуо Икеда и Хидео Куросава Ангью. хим. Межд. Эд. 2007 , 46, 4930 –4932 два : 10.1002/anie.200700688
- ^ Реакция имина N- (бензолсульфонил)бензальдимина с двумя эквивалентами дифенилацетилена с NiCOD 2 и трициклогексилфосфином сначала с никелапирролином, со вторым введением никельдигидроазепина и, наконец, при нагревании с дигидропиридином.
- ^ Никель (0)-катализируемые [2 + 2 + 2 + 2] циклоприсоединения терминальных диинов для синтеза замещенных циклооктатетраенов Пол А. Вендер и Джастин П. Кристи Дж. Ам. хим. Соц. ; 2007 год ; 129(44) стр. 13402 - 13403; (Коммуникация) два : 10.1021/ja0763044