Ненавижу совокупление
| Ненавижу совокупление | |
|---|---|
| Назван в честь | Макото Кумада |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | соединение ненависти |
| RSC Идентификатор онтологии | RXNO: 0000144 |

В органической химии представляет сочетание Кумады собой тип реакции перекрестного сочетания , полезной для образования углерод-углеродных связей в результате реакции реактива Гриньяра и органического галогенида. В этой процедуре используются на основе переходных металлов катализаторы , обычно никель или палладий, для соединения комбинации двух алкильных , арильных или винильных групп . Группы Роберта Корриу и Макото Кумады независимо сообщили о реакции в 1972 году. [1] [2]
Реакция примечательна тем, что является одним из первых описанных методов каталитического кросс-сочетания. Несмотря на последующее развитие альтернативных реакций ( Сузуки , Соногашира , Стилле , Хияма , Негиши ), связь Кумады продолжает использоваться во многих синтетических приложениях, включая промышленное производство алискирена , лекарства от гипертонии , и политиофенов , полезных в органических соединениях. электронные устройства.
История
[ редактировать ]Первые исследования каталитического сочетания реактивов Гриньяра с органическими галогенидами относятся к исследованию кобальтовых катализаторов Моррисом С. Харашем и Э. К. Филдсом в 1941 году. [3] В 1971 году Тамура и Кочи подробно остановились на этой работе в серии публикаций, демонстрирующих жизнеспособность катализаторов на основе серебра. [4] медь [5] и железо. [6] Однако эти ранние подходы давали низкие выходы из-за значительного образования продуктов гомосочетания, когда соединяются два идентичных вида.
Кульминацией этих усилий стал 1972 год, когда группы Корриу и Кумада одновременно сообщили об использовании никельсодержащих катализаторов. С введением палладиевых катализаторов в 1975 году группой Мурахаши сфера применения реакции еще больше расширилась. [7] Впоследствии было разработано множество дополнительных методов соединения, кульминацией которых стала Нобелевская премия по химии 2010 года, присудившая Эй-ити Негиши , Акире Судзуки и Ричарду Ф. Хеку за их вклад в эту область.
Механизм
[ редактировать ]
Палладиевый катализ
[ редактировать ]Согласно широко распространенному механизму, катализируемое палладием сочетание Кумады считается аналогом роли палладия в других реакциях кросс-сочетания. Предлагаемый каталитический цикл включает состояния окисления как палладия (0), так и палладия (II). Первоначально богатый электронами катализатор Pd(0) ( 1 ) внедряется в связь R–X органического галогенида. Это окислительное присоединение образует органо-Pd(II)-комплекс ( 2 ). Последующее переметаллирование реактивом Гриньяра образует гетерометаллоорганический комплекс ( 3 ). Перед следующим шагом необходима изомеризация, чтобы привести органические лиганды рядом друг с другом во взаимно цис-положения. Наконец, восстановительное отщепление ( 4 ) образует углерод-углеродную связь и высвобождает продукт перекрестной связи при регенерации катализатора Pd(0) ( 1 ). [8] В палладиевых катализаторах часто определяющее скорость окислительное присоединение происходит медленнее, чем в никелевых каталитических системах. [8]
Никелевый катализ
[ редактировать ]
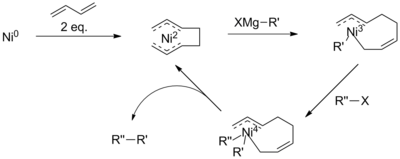
Текущее понимание механизма катализируемого никелем сочетания ограничено. Действительно, полагают, что механизм реакции протекает по-разному в разных условиях реакции и при использовании разных никелевых лигандов. [9] В целом механизм еще можно описать как аналог палладиевой схемы (справа). Однако при определенных условиях реакции этот механизм не может объяснить все наблюдения. Исследование Вичика и его коллег с использованием тридентатного терпиридинового лиганда выявило промежуточные соединения каталитического цикла Ni(II)-Ni(I)-Ni(III), [10] предлагаю более сложную схему. Кроме того, считается, что при добавлении бутадиена в реакции участвует промежуточный продукт Ni(IV). [11]
Объем
[ редактировать ]Органические галогениды и псевдогалогениды
[ редактировать ]Связь Кумады была успешно продемонстрирована для различных арил- и винилгалогенидов. Вместо галогенидного реагента также можно использовать псевдогалогениды, и было показано, что сочетание тозилата весьма эффективно. [12] и трифлат [13] виды в различных условиях.
Несмотря на широкий успех соединений арила и винила, использование алкилгалогенидов менее распространено из-за нескольких усложняющих факторов. Не имея π-электронов, алкилгалогениды требуют иных механизмов окислительного присоединения, чем арильные или винильные группы, и эти процессы в настоящее время плохо изучены. [9] Кроме того, присутствие β-водородов делает алкилгалогениды восприимчивыми к конкурентного элиминирования . процессам [14]
Эти проблемы удалось обойти благодаря наличию активирующей группы, такой как карбонил в α-бромкетонах, которая ускоряет реакцию. Однако связывание Кумады также осуществлялось с неактивированными алкильными цепями, часто с использованием дополнительных катализаторов или реагентов. Например, с добавлением 1,3-бутадиенов Камбе и его коллеги продемонстрировали катализируемые никелем соединения алкил-алкил, которые в противном случае были бы нереакционноспособными. [15]

Предполагается, что механизм этой реакции, хотя и плохо изучен, включает образование комплекса октадиенила никеля. Предлагается, чтобы этот катализатор сначала подвергался трансметаллированию с помощью реактива Гриньяра, прежде чем восстановительное отщепление галогенида, что снижает риск отщепления β-гидрида. Однако наличие промежуточного соединения Ni(IV) противоречит механизмам, предложенным для сочетания арил- или винилгалогенида. [11]
реактив Гриньяра
[ редактировать ]О сочетаниях с участием арильных и виниловых реагентов Гриньяра сообщалось в оригинальных публикациях Кумады и Корриу. [2] Алкиловые реактивы Гриньяра также можно использовать без затруднений, так как они не подвержены процессам отщепления β-гидрида. Хотя реактив Гриньяра по своей природе имеет плохую толерантность к функциональным группам, были проведены низкотемпературные синтезы с высокофункционализированными арильными группами. [16]
Катализаторы
[ редактировать ]Сочетание Кумада может осуществляться с использованием различных катализаторов на основе никеля (II) или палладия (II). Структуры каталитических предшественников обычно могут быть сформулированы как ML 2 X 2 , где L представляет собой фосфиновый лиганд. [17] Обычный выбор для L 2 включает, среди прочего, бидентатные дифосфиновые лиганды, такие как dppe и dppp .
Работа Алоиса Фюрстнера и его коллег над катализаторами на основе железа показала разумные результаты. Предполагается, что катализатором в этих реакциях является «неорганический реактив Гриньяра», состоящий из Fe(MgX) 2 . [18]
Условия реакции
[ редактировать ]Реакцию обычно проводят в тетрагидрофуране или диэтиловом эфире в качестве растворителя. Такие эфирные растворители удобны, поскольку являются типичными растворителями для получения реактива Гриньяра. [2] Из-за высокой реакционной способности реактива Гриньяра соединения Кумады имеют ограниченную толерантность к функциональным группам, что может быть проблематичным при крупномасштабном синтезе. В частности, реактивы Гриньяра чувствительны к протонолизу даже слабокислых групп, таких как спирты . Они также присоединяются к карбонилам и другим окислительным группам.
Как и во многих реакциях сочетания, палладиевый катализатор на основе переходного металла часто чувствителен к воздуху и требует инертной реакционной среды аргона или азота.
Образец синтетического препарата доступен на Organic Syntheses сайте .
Селективность
[ редактировать ]Стереоселективность
[ редактировать ]Как цис- , так и транс- олефингалогениды способствуют общему сохранению геометрической конфигурации при сочетании с алкилами Гриньяра. Это наблюдение не зависит от других факторов, включая выбор лигандов катализатора и виниловых заместителей. [17]
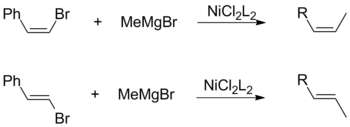
И наоборот, сочетание Кумады с использованием виниловых реактивов Гриньяра протекает без стереоспецифичности с образованием смеси цис- и транс- алкенов. Степень изомеризации зависит от множества факторов, включая соотношение реагентов и идентичность галогенидной группы. По мнению Кумады, эта потеря стереохимии объясняется побочными реакциями между двумя эквивалентами аллильного реактива Гриньяра. [17]

Энантиоселективность
[ редактировать ]
Асимметричные соединения Кумады могут быть осуществлены за счет использования хиральных лигандов. При использовании плоских хиральных ферроценовых лигандов в арильных связях наблюдался энантиомерный избыток (ee) более 95%. [19] Совсем недавно Грегори Фу и его коллеги продемонстрировали энантиоконвергентные реакции α-бромкетонов с использованием катализаторов на основе бис-оксазолиновых лигандов, где хиральный катализатор превращает рацемическую смесь исходного материала в один энантиомер продукта с ee до 95%. [20] Последняя реакция также важна для участия традиционно недоступного алкилгалогенидного сочетания.
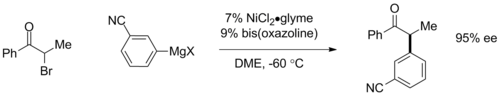
Хемоселективность
[ редактировать ]Реагенты Гриньяра обычно не связываются с хлорированными аренами. Эта низкая реакционная способность является основой хемоселективности внедрения никеля по связи C–Br бромхлорбензола с использованием катализатора на основе NiCl 2 . [21]

Приложения
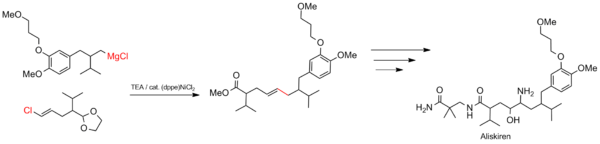
[ редактировать ]Синтез алискирена
[ редактировать ]Муфта Кумада подходит для крупномасштабных промышленных процессов, таких как синтез лекарств. Реакция используется для построения углеродного скелета алискирена (торговое название Тектурна), средства для лечения гипертонии . [22]
Синтез политиофенов
[ редактировать ]Сочетание Кумады также перспективно в синтезе сопряженных полимеров , таких как полиалкилтиофены (ПАТ), которые имеют множество потенциальных применений в органических солнечных элементах и светоизлучающих диодах . [23] В 1992 году МакКоллоу и Лоу разработали первый синтез региорегулярных полиалкилтиофенов, используя схему сочетания Кумады, изображенную ниже, которая требует отрицательных температур. [24]
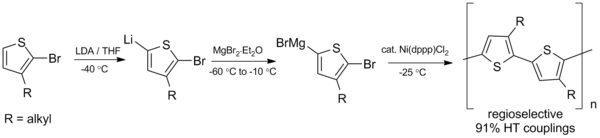
С момента этого первоначального приготовления синтез был улучшен для получения более высоких выходов и работы при комнатной температуре. [25]
См. также
[ редактировать ]- Черт возьми реакция
- Хияма муфта
- Реакция Сузуки
- Муфта Негиши
- Реакция Петасиса
- Реакция Стилле
- Муфта Соногашира
- Муфта Мурахаши
Цитаты
[ редактировать ]- ^ Корриу, RJP; Масс, JP (1 января 1972 г.). «Активация реагентов Гриньяра комплексами переходных металлов. Новый и простой синтез транс-стильбенов и полифенилов». Журнал Химического общества, Химические коммуникации (3): 144a. дои : 10.1039/C3972000144A .
- ^ Jump up to: а б с Тамао, Кохей; Сумитани, Кодзи; Кумада, Макото (1 июня 1972 г.). «Селективное образование углерод-углеродной связи путем кросс-сочетания реагентов Гриньяра с органическими галогенидами. Катализ никель-фосфиновыми комплексами». Журнал Американского химического общества . 94 (12): 4374–4376. дои : 10.1021/ja00767a075 .
- ^ Хараш, М.С.; Филдс, EK (1 сентября 1941 г.). «Факторы, определяющие ход и механизмы реакций Гриньяра. IV. Влияние галогенидов металлов на реакцию арильных реагентов Гриньяра и органических галогенидов1». Журнал Американского химического общества . 63 (9): 2316–2320. дои : 10.1021/ja01854a006 .
- ^ Джей К. Кочи и Масухико Тамура (1971). «Механизм катализируемой серебром реакции реактивов Гриньяра с алкилгалогенидами». Дж. Ам. хим. Соц. 93 (6): 1483–1485. дои : 10.1021/ja00735a028 .
- ^ Кочи, Джей К.; Тамура, Масухико (1 марта 1971 г.). «Алкилмедь (I) при сочетании реагентов Гриньяра с алкилгалогенидами». Журнал Американского химического общества . 93 (6): 1485–1487. дои : 10.1021/ja00735a029 .
- ^ Тамура, Масухико; Кочи, Джей К. (1 марта 1971 г.). «Винилирование реактивов Гриньяра. Катализ железом». Журнал Американского химического общества . 93 (6): 1487–1489. дои : 10.1021/ja00735a030 .
- ^ Ямамура, Масааки; Моритани, Ичиро; Мурахаси, Сюн-Ичи (27 мая 1975 г.). «Реакция комплексов σ-винилпалладия с алкиллитиями. Стереоспецифические синтезы олефинов из винилгалогенидов и алкиллитий». Журнал металлоорганической химии . 91 (2): C39–C42. дои : 10.1016/S0022-328X(00)89636-9 .
- ^ Jump up to: а б Кнаппке, Кристиана Э.И.; Якоби фон Вангелин, Аксель (2011). «35 лет катализируемой палладием кросс-сочетания с реагентами Гриньяра: как далеко мы продвинулись?». Обзоры химического общества . 40 (10): 4948–62. дои : 10.1039/c1cs15137a . ПМИД 21811712 .
- ^ Jump up to: а б Ху, Силе (2011). «Кросс-сочетание неактивированных алкилгалогенидов, катализируемое никелем: механистическая перспектива». хим. Наука . 2 (10): 1867–1886. дои : 10.1039/c1sc00368b .
- ^ Джонс, Гэвин Д.; Макфарланд, Крис; Андерсон, Томас Дж.; Вич, Дэвид А. (1 января 2005 г.). «Анализ ключевых этапов каталитического кросс-сочетания алкилэлектрофилов в условиях, подобных Негиши». Химические коммуникации (33): 4211–3. дои : 10.1039/b504996b . ПМИД 16100606 .
- ^ Jump up to: а б Фриш, Аня К.; Беллер, Матиас (21 января 2005 г.). «Катализаторы реакций кросс-сочетания с неактивированными алкилгалогенидами». Angewandte Chemie, международное издание . 44 (5): 674–688. дои : 10.1002/anie.200461432 . ПМИД 15657966 .
- ^ Лиммерт, Майкл Э.; Рой, Эми Х.; Хартвиг, Джон Ф. (1 ноября 2005 г.). «Сочетание Кумада арил- и винилтозилатов в мягких условиях». Журнал органической химии . 70 (23): 9364–9370. дои : 10.1021/jo051394l . ПМИД 16268609 .
- ^ Бусакка, Карл А.; Эрикссон, Магнус К.; Фиаски, Рита (1999). «Кросс-сочетание винилтрифлатов и алкильных реагентов Гриньяра, катализируемое комплексами никеля (0)». Буквы тетраэдра . 40 (16): 3101–3104. дои : 10.1016/S0040-4039(99)00439-6 .
- ^ Рудольф, Алена; Лаутенс, Марк (30 марта 2009 г.). «Вторичные алкилгалогениды в реакциях перекрестного сочетания, катализируемых переходными металлами». Angewandte Chemie, международное издание . 48 (15): 2656–2670. дои : 10.1002/anie.200803611 . ПМИД 19173365 .
- ^ Терао, июнь; Ватанабэ, Хидеюки; Икуми, Аки; Куниясу, Хитоши; Камбе, Нобуаки (1 апреля 2002 г.). «Никель-катализируемая реакция перекрестного сочетания реагентов Гриньяра с алкилгалогенидами и тозилатами: замечательный эффект 1,3-бутадиенов». Журнал Американского химического общества . 124 (16): 4222–4223. CiteSeerX 10.1.1.604.5758 . дои : 10.1021/ja025828v . ПМИД 11960446 .
- ^ Адрио, Хавьер; Карретеро, Хуан К. (15 ноября 2010 г.). «Функционализированные реагенты Гриньяра в реакциях кросс-сочетания Кумады». ChemCatChem . 2 (11): 1384–1386. дои : 10.1002/cctc.201000237 . S2CID 98429919 .
- ^ Jump up to: а б с Кумада, М. (1 января 1980 г.). «Комплекс никеля и палладия катализирует реакции кросс-сочетания металлоорганических реагентов с галогенорганическими соединениями» . Чистая и прикладная химия . 52 (3): 669–679. дои : 10.1351/pac198052030669 .
- ^ Фюрстнер, Алоис; Лейтнер, Андреас; Мендес, Мария; Краузе, Хельга (1 ноября 2002 г.). «Реакции кросс-сочетания, катализируемые железом». Журнал Американского химического общества . 124 (46): 13856–13863. дои : 10.1021/ja027190t . ПМИД 12431116 .
- ^ Хаяси, Тамио; Ямамото, Акихиро; Ходзё, Масахиро; Киши, Кохей; Ито, Ёсихико; Нисиока, Эрико; Миура, Хитоши; Янаги, Казунори (1989). «Асимметричный синтез, катализируемый хиральными комплексами ферроценилфосфин-переходный металл». Журнал металлоорганической химии . 370 (1–3): 129–139. дои : 10.1016/0022-328X(89)87280-8 .
- ^ Лу, Ша; Фу, Грегори К. (3 февраля 2010 г.). «Никель/бис(оксазолин)-катализируемые асимметричные реакции Кумады алкилэлектрофилов: кросс-сочетания рацемических α-бромкетонов» . Журнал Американского химического общества . 132 (4): 1264–1266. дои : 10.1021/ja909689t . ПМЦ 2814537 . ПМИД 20050651 .
- ^ Икома, Ёсихару; Андо, Казухико; Наой, Ёситаке; Акияма, Такео; Сугимори, Акира (1 февраля 1991 г.). «Селективность галогенов в катализируемом солями никеля перекрестном сочетании арильных реагентов Гриньяра с бромхлорбензолами - новый метод синтеза несимметричного терфенила». Синтетические коммуникации . 21 (3): 481–487. дои : 10.1080/00397919108016772 .
- ^ Джонсон и Ли (2010). Современный синтез лекарств . Хобокен, Нью-Джерси: John Wiley & Sons, Inc., стр. 153–154. ISBN 978-0-470-52583-8 .
- ^ Ченг, Йен-Джю; Ян, Шэн-Сюн; Сюй, Чейн-Шу (11 ноября 2009 г.). «Синтез сопряженных полимеров для применения в органических солнечных элементах». Химические обзоры . 109 (11): 5868–5923. дои : 10.1021/cr900182s . ПМИД 19785455 .
- ^ Маккалоу, Ричард Д.; Лоу, Рене Д. (1 января 1992 г.). «Повышенная электропроводность в региоселективно синтезированных поли(3-алкилтиофенах)». Журнал Химического общества, Химические коммуникации (1): 70. doi : 10.1039/C39920000070 .
- ^ Лоу, Роберт С.; Юбэнк, Пол С.; Лю, Цзиньсун; Чжай, Лей; Маккалоу, Ричард Д. (1 июня 2001 г.). «Региорегулярные поли(3-алкилтиофены), связанные голова к хвосту, стали проще с помощью метода GRIM: исследование реакции и происхождения региоселективности». Макромолекулы . 34 (13): 4324–4333. Бибкод : 2001МаМол..34.4324L . дои : 10.1021/ma001677+ .