Муфта Негиши
| Муфта Негиши | |
|---|---|
| Назван в честь | Эй-ичи Негиси |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Негиши-соединение |
| RSC Идентификатор онтологии | RXNO: 0000088 |
Сочетание Негиши представляет собой широко используемую переходными металлами катализируемую реакцию кросс-сочетания, . В результате реакции органические галогениды или трифлаты соединяются с цинкорганическими соединениями , образуя углерод-углеродные связи при этом , . обычно используют палладий (0) (СС). В качестве катализатора хотя никель иногда используют [1] [2] Разнообразие никелевых катализаторов в Ni 0 или Ни II Степень окисления может использоваться в кросс-сочетаниях Негиши, таких как Ni(PPh 3 ) 4 , Ni(acac) 2 , Ni(COD) 2 и т. д. [3] [4] [5]

- Уходящая группа X обычно представляет собой хлорид , бромид или йодид , но трифлатные и ацетилоксигруппы также возможны . X = Cl обычно приводит к медленным реакциям.
- Органический остаток R = алкенил , арил , аллил , алкинил или пропаргил .
- Галогенид X' в цинкорганическом соединении может представлять собой хлорид , бром или йод , а органический остаток R' представляет собой алкенил , арил , аллил , алкил , бензил , гомоаллил и гомопропаргил.
- Металл М в катализаторе — никель или палладий.
- Лигандом BINAP L катализаторе может быть трифенилфосфин , dppe , в , хирафос или XPhos .
Палладиевые катализаторы обычно имеют более высокие химические выходы и более высокую толерантность к функциональным группам .
Сочетание Негиши находит широкое применение в области полного синтеза как метод избирательного образования CC-связей между сложными синтетическими промежуточными соединениями. Реакция позволяет осуществить соединение sp 3 , сп 2 и sp атомы углерода (см. орбитальную гибридизацию ), что делает его несколько необычным среди реакций сочетания, катализируемых палладием . Цинкорганические соединения чувствительны к влаге и воздуху , поэтому сочетание Негиши должно проводиться в среде, свободной от кислорода и воды, что затрудняет его использование по сравнению с другими реакциями кросс-сочетания, которые требуют менее устойчивых условий (например, реакция Сузуки). Однако цинкорганические соединения более реакционноспособны, чем станнаны и органобораты, что приводит к более быстрому времени реакции.
Реакция названа в честь Эй-ичи Негиси, который был одним из лауреатов Нобелевской премии по химии 2010 года за открытие и развитие этой реакции.
Негиши и его коллеги первоначально исследовали кросс-сочетание алюминийорганических реагентов в 1976 году, первоначально используя Ni и Pd в качестве катализаторов на основе переходных металлов, но отметили, что Ni приводит к снижению стереоспецифичности, тогда как Pd - нет. [6] Переход от алюминийорганических соединений к цинкорганическим соединениям Негиши и его коллеги сообщили об использовании комплексов Pd в реакциях сочетания цинкорганических соединений и провели исследования методов, в конечном итоге доведя условия реакции до тех, которые обычно используются сегодня. [7] Вместе с Ричардом Ф. Хеком и Акирой Судзуки Эл-ити Негиши был одним из лауреатов Нобелевской премии по химии в 2010 году за свою работу по «перекрестным связям, катализируемым палладием, в органическом синтезе».
Механизм реакции
[ редактировать ]Считается, что механизм реакции протекает по стандартному пути кросс-сочетания, катализируемому Pd, начиная с разновидности Pd(0), которая окисляется до Pd(II) на стадии окислительного присоединения с участием галогенорганических соединений. [8] Этот этап протекает с арил-, винил-, алкинил- и ацилгалогенидами, ацетатами или трифлатами с субстратами, имеющими стандартные относительные скорости окислительного присоединения (I>OTf>Br>>Cl). [9]
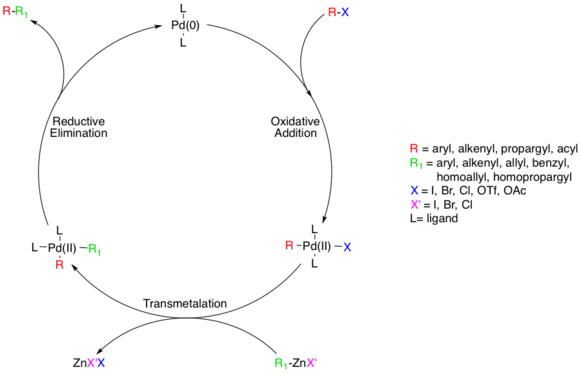
Фактический механизм окислительного присоединения не выяснен, хотя существует два вероятных пути. Считается, что один путь протекает по механизму, подобному S N 2 , что приводит к инвертированной стереохимии. Другой путь осуществляется путем согласованного присоединения и сохраняет стереохимию.

Хотя добавки являются цис-, комплекс Pd(II) быстро изомеризуется в транс-комплекс. [10]

Затем происходит стадия трансметаллирования , на которой цинкорганический реагент обменивает свой органический заместитель на галогенид в комплексе Pd(II), образуя транс-комплекс Pd(II) и галогенид цинка. Цинкорганический субстрат может представлять собой арил, винил, аллил, бензил, гомоаллил или гомопропаргил. [8] Трансметаллация обычно ограничивает скорость , и полное механистическое понимание этого этапа еще не достигнуто, хотя несколько исследований пролили свет на этот процесс. Разновидности алкилцинка до трансметаллирования образуют разновидности цинката более высокого порядка, тогда как виды арилцинка этого не делают. [11] ZnXR и ZnR 2 могут использоваться в качестве реакционноспособных реагентов, а Zn, как известно, предпочитает четырехкоординатные комплексы, что означает комплексы Zn, координируемые растворителем, такие как ZnXR(растворитель) 2 нельзя исключить априори . [12] Исследования показывают, что между цис- и транс-бис-алкилпалладийорганическими комплексами существуют конкурирующие равновесия, но единственным продуктивным промежуточным продуктом является цис-комплекс. [13] [14]

Последним этапом каталитического пути сочетания Негиши является восстановительное элиминирование , которое, как полагают, протекает через трехкоординатное переходное состояние , давая связанный органический продукт и регенерируя катализатор Pd(0). Для того чтобы этот этап произошел, должен образоваться вышеупомянутый цис-алкилпалладийорганический комплекс. [15]

В качестве исходных материалов можно использовать как цинкорганические галогениды, так и диорганоцинковые соединения. В одной модельной системе было обнаружено, что на стадии трансметаллирования первые дают цис-аддукт R-Pd-R', что приводит к быстрому восстановительному элиминированию до продукта, тогда как второй дает транс-аддукт, который должен пройти медленный транс-цис- переход. сначала изомеризация . [13]
Распространенной побочной реакцией является гомосочетание. В одной модельной системе Негиши было обнаружено, что образование гомосочетания является результатом второй реакции трансметаллирования между промежуточным соединением диарилметалла и галогенидом арилметалла: [16]
- Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
- Ar'–Pd–Ar' → Ar'–Ar' + Pd(0) (гомосоединение)
- Ar–Zn–X + H 2 O → Ar–H + HO–Zn–X (реакция, сопровождающаяся дегалогенированием )
Никелевые катализированные системы могут работать по разным механизмам в зависимости от партнеров сочетания. В отличие от палладиевых систем, в которых используется только Pd 0 или палладий II В системах, катализируемых никелем, может использоваться никель с различными степенями окисления. [17] Обе системы схожи тем, что включают схожие элементарные стадии: окислительное присоединение, трансметаллирование и восстановительное элиминирование. Обе системы также должны решать проблемы удаления β-гидрида и сложного окислительного присоединения алкилэлектрофилов. [18]
Для неактивированных алкилэлектрофилов одним из возможных механизмов является трансметаллирования механизм первого . В этом механизме алкилцинковые соединения сначала будут трансметаллироваться с никелевым катализатором. Тогда никель будет отделять галогенид от алкилгалогенида, что приведет к образованию алкильного радикала и окислению никеля после добавления радикала. [19]

Одним из важных факторов при рассмотрении механизма перекрестного связывания, катализируемого никелем, является то, что восстановительное элиминирование происходит легко из Ni. III вид, но очень трудный из Ni II разновидность. Кочи и Моррелл предоставили доказательства этого, выделив Ni. II комплекс Ni(PEt 3 ) 2 (Me)( o -tolyl), который не подвергся восстановительному элиминированию достаточно быстро, чтобы участвовать в этой элементарной стадии. [20]
Объем
[ редактировать ]Связь Негиши была применена в следующих иллюстративных синтезах:
- несимметричные 2,2'-бипиридины из 2-бромпиридина с тетракис(трифенилфосфин)палладием(0) , [21]
- бифенил из о -толилцинкхлорида и о -йодтолуола и тетракис(трифенилфосфин)палладия(0), [22]
- 5,7-гексадекадиен из 1-децина и ( Z )-1-гексенилиодида. [23]

Сочетание Негиши было применено при синтезе гексаферроценилбензола : [24]
с гексаиодидобензолом, диферроценилцинком и трис(дибензилиденацетон)дипалладием(0) в тетрагидрофуране . Выход составляет всего 4%, что означает значительное скопление вокруг арильного ядра.
В новой модификации палладий сначала окисляется галогенкетоном 2 -хлор-2-фенилацетофеноном 1 , и образующийся комплекс палладия OPdCl затем присоединяет как цинкорганическое соединение 2 , так и оловоорганическое соединение 3 в результате двойного трансметаллирования : [25]
Примеры муфт Негиши, катализируемых никелем, включают sp 2 -sp 2 , сп 2 -sp 3 и сп 3 -sp 3 системы. В системе, впервые изученной Негиши, арил-арильное кросс-сочетание катализируется Ni(PPh 3 ) 4 , генерируемым in situ за счет восстановления Ni(acac) 2 с помощью PPh3 и (i-Bu) 2 AlH. [26]

Также были разработаны варианты, позволяющие осуществлять перекрестное связывание арильных и алкенильных партнеров. В варианте, разработанном Кночелем и др., арилбромиды цинка подвергались реакции с винилтрифлатами и винилгалогенидами. [27]

Реакции между sp 3 -sp 3 центры зачастую более трудны; однако добавление ненасыщенного лиганда с электроноакцепторной группой в качестве сокатализатора улучшило выход в некоторых системах. Считается, что дополнительная координация ненасыщенного лиганда способствует восстановительному отщеплению, а не отщеплению β-гидрида. [28] [29] Это также работает в некоторых алкиларильных системах. [30]
Существует несколько асимметричных вариантов, и многие из них используют лиганды Pybox. [31] [32] [33]
Промышленное применение
[ редактировать ]Сочетание Негиши не используется в промышленных целях так часто, как его родственные реакции Сузуки и реакция Хека , в основном из-за чувствительности к воде и воздуху необходимых арильных или алкилцинковых реагентов. [34] [35] В 2003 году компания Novartis применила соединение Негиши при производстве PDE472, ингибитора фосфодиэстеразы типа 4D, который исследовался в качестве ведущего препарата для лечения астмы . [36] Сочетание Негиши использовали в качестве альтернативы реакции Сузуки, обеспечивая улучшенные выходы, 73% в масштабе 4,5 кг, желаемого синтетического промежуточного соединения бензодиоксазола. [37]
Приложения в полном синтезе
[ редактировать ]Хотя соединение Негиши редко используется в промышленной химии из-за вышеупомянутой чувствительности к воде и кислороду, оно находит широкое применение в области природных продуктов полного синтеза . Повышенная реакционная способность по сравнению с другими реакциями кросс-сочетания делает реакцию Негиши идеальной для соединения сложных промежуточных продуктов в синтезе натуральных продуктов. [8] Кроме того, Zn более безопасен для окружающей среды, чем другие металлы, такие как Sn , используемые в муфтах Stille . Исторически муфта Negishi не использовалась так часто, как муфта Stille или Suzuki. Когда дело доходит до процессов сочетания фрагментов, сочетание Негиши особенно полезно, особенно по сравнению с вышеупомянутыми реакциями сочетания Стилле и Сузуки. [38] Основным недостатком реакции Негиши, помимо ее чувствительности к воде и кислороду, является относительное отсутствие толерантности к функциональным группам по сравнению с другими реакциями кросс-сочетания. [39]
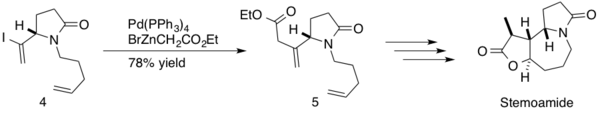
(-)-стемоамид – это натуральный продукт, содержащийся в экстрактах корня Stemona tuberosa. Эти экстракты используются в японской и китайской народной медицине для лечения респираторных заболеваний, а (-)-стемоамид также является противогельминтным средством. Сомфаи и его коллеги использовали сочетание Негиши в синтезе (-)-стемоамида. [40] Реакция реализовывалась в середине синтеза, образуя sp 3 -sp 2 cc-связь между β,γ-ненасыщенным эфиром и промежуточным диеном 4 с выходом продукта 5 78% . Компания Somfai завершила стереоселективный общий синтез (-)-стемоамида за 12 стадий с общим выходом 20%.
Кибаяши и его коллеги использовали соединение Негиши для полного синтеза пумилиотоксина B. Пумилиотоксин B является одним из основных токсичных алкалоидов, выделенных из Dendrobates pumilio, панамской ядовитой лягушки. Эти токсичные алкалоиды оказывают модулирующее действие на потенциалзависимые натриевые каналы , что приводит к кардиотонической и миотонической активности. [41] Кибаяши использовал позднюю стадию связывания Негиши в синтезе пумилиотоксина B, связывая гомоаллильный sp 3 углерода на алкилиден-индолизидине цинка 6 с (E)-винилиодидом 7 с выходом 51%. Затем натуральный продукт получали после снятия защиты. [42]
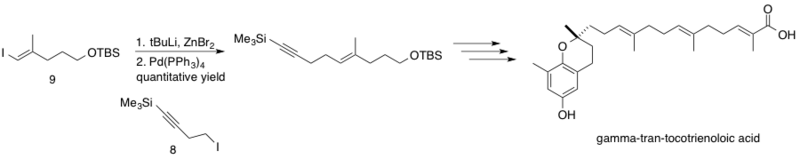
δ-транс-токотриенолевая кислота, выделенная из растения Chrysochlamys ulei, представляет собой природный продукт, который, как показано, ингибирует ДНК-полимеразу β (pol β), которая восстанавливает ДНК посредством вырезания оснований. Ингибирование pol B в сочетании с другими химиотерапевтическими препаратами может повысить цитотоксичность этих химиотерапевтических препаратов, что приведет к снижению эффективных доз. Сочетание Негиши было реализовано при синтезе δ-транс-токотриеноловой кислоты Хехтом и Мэлони, связывающими sp 3 гомопропаргилцинковый реагент 8 с sp 2 винилйодид 9 . [43] Реакция протекала с количественным выходом, соединяя фрагменты в середине синтеза на пути к стереоселективно синтезированному природному продукту δ-транс-токотриеноловой кислоте.
Смит и Фу продемонстрировали, что их метод соединения вторичных нуклеофилов со вторичными алкилэлектрофилами может быть применен к формальному синтезу α-цембра-2,7,11-триен-4,6-диола, мишени с противоопухолевой активностью. Они достигли выхода 61% в граммовом масштабе, используя свой метод установки изопропильной группы. Этот метод может быть легко адаптирован в этом приложении для диверсификации и установки других алкильных групп, чтобы обеспечить исследование зависимости структура-активность (SAR). [44]

Киршнинг и Шмидт применили катализируемую никелем кросс-сочетание Негиши для первого полного синтеза каролактона. В этом применении они достигли выхода 82% и dr = 10:1. [45]

Получение цинкорганических предшественников
[ редактировать ]Алкилцинковые реагенты можно получить из соответствующих алкилбромидов, используя йод в диметилацетамиде (DMAC). [46] Каталитик I 2 служит для активации цинка в направлении нуклеофильного присоединения.
Арильные цинки можно синтезировать в мягких условиях реакции через промежуточное соединение, подобное Гриньяру . [47]
Цинкорганические соединения также можно получать in situ и использовать в одном сосуде, как продемонстрировали Knochel et al. [48]

Дальнейшее чтение
[ редактировать ]- Макканн LC, Хантер Х.Н., Клайберн Дж.А., Organ MG (июль 2012 г.). «Цинкаты высшего порядка как трансметаллаторы в кросс-сочетании алкил-алкил-негиши». Ангеванде Хеми . 51 (28): 7024–7. дои : 10.1002/anie.201203547 . ПМИД 22685029 .
- Ян Ю, Олденхейс, Нью-Джерси, Бухвальд С.Л. (январь 2013 г.). «Мягкие и общие условия для кросс-сочетания Негиши, обеспечиваемые использованием предкатализаторов палладациклов» . Ангеванде Хеми . 52 (2): 615–9. дои : 10.1002/anie.201207750 . ПМЦ 3697109 . ПМИД 23172689 .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кинг А.О., Окукадо Н., Негиси Эй (1977). «Общий стерео-, регио- и хемоселективный синтез терминальных и внутренних сопряженных енинов с помощью Pd-катализируемой реакции алкинилцинковых реагентов с алкенилгалогенидами». Журнал Химического общества, Chemical Communications (19): 683. doi : 10.1039/C39770000683 .
- ^ Курти Л., Чако Б (2007). Стратегические применения названных реакций в органическом синтезе: предпосылки и детальные механизмы; 250 названных реакций . Амстердам: Elsevier Academic Press. ISBN 978-0-12-429785-2 .
- ^ Чжоу, Цзяньжун (Стив); Фу, Грегори К. (декабрь 2003 г.). «Кросс-сочетания неактивированных вторичных алкилгалогенидов: катализируемые никелем реакции Негиши алкилбромидов и йодидов при комнатной температуре» . Журнал Американского химического общества . 125 (48): 14726–14727. дои : 10.1021/ja0389366 . ISSN 0002-7863 . ПМИД 14640646 .
- ^ Негиси, Эйичи; Кинг, Энтони О.; Окукадо, Нобухиса (1 мая 1977 г.). «Селективное образование углерод-углеродной связи посредством катализа переходных металлов. 3. Высокоселективный синтез несимметричных биарилов и диарилметанов никель- или палладий-катализируемой реакцией арил- и бензилцинковых производных с арилгалогенидами» . Журнал органической химии . 42 (10): 1821–1823. дои : 10.1021/jo00430a041 . ISSN 0022-3263 .
- ^ Гаврюшин Андрей; Кофинк, Кристиана; Маноликакес, Георг; Кнохель, Пол (1 октября 2005 г.). «Эффективное кросс-сочетание функционализированных арилцинкгалогенидов, катализируемое системой хлорид никеля-диэтилфосфит» . Органические письма . 7 (22): 4871–4874. дои : 10.1021/ol051615+ . ISSN 1523-7060 . ПМИД 16235910 .
- ^ Баба С., Негиши Э (1976). «Новое стереоспецифическое перекрестное соединение алкенил-алкенил посредством катализируемой палладием или никелем реакции алкенилаланов с алкенилгалогенидами». Журнал Американского химического общества . 98 (21): 6729–6731. дои : 10.1021/ja00437a067 .
- ^ Негиси Э. , Кинг А.О., Окукадо Н. (1977). «Селективное образование углерод-углеродной связи посредством катализа переходных металлов. 3. Высокоселективный синтез несимметричных биарилов и диарилметанов никель- или палладий-катализируемой реакцией арил- и бензилцинковых производных с арилгалогенидами». Журнал органической химии . 42 (10): 1821–1823. дои : 10.1021/jo00430a041 .
- ^ Jump up to: а б с Курти Л., Чако Б (2005). Стратегическое применение названных реакций в органическом синтезе . Нью-Йорк: Elsevier Academic Press.
- ^ Исследовательская группа Эндрю Дж. Майерса. «Химия 115 Раздаточный материал» . Бостон, Массачусетс: Химический факультет Гарвардского университета.
- ^ Касадо А.Л., Эспинет П. (1998). «О конфигурации, возникающей в результате окислительного присоединения RX к Pd(PPh3)4, и механизме цис-транс-изомеризации комплексов [PdRX(PPh3)2] (R = арил, X = галогенид)». Металлоорганические соединения . 17 (5): 954–959. дои : 10.1021/om9709502 .
- ^ Макканн LC, Хантер Х.Н., Клайберн Дж.А., Organ MG (июль 2012 г.). «Цинкаты высшего порядка как трансметаллаторы в кросс-сочетании алкил-алкил-негиши». Ангеванде Хеми . 51 (28): 7024–7. дои : 10.1002/anie.201203547 . ПМИД 22685029 .
- ^ Гарсиа-Мельчор М., Брага А.А., Льедос А., Ухаке Г., Масерас Ф. (ноябрь 2013 г.). «Вычислительный взгляд на механизмы реакции кросс-сочетания CC, катализируемой Pd». Отчеты о химических исследованиях . 46 (11): 2626–34. дои : 10.1021/ar400080r . ПМИД 23848308 .
- ^ Jump up to: а б Касарес Х.А., Эспинет П., Фуэнтес Б., Салас Г. (март 2007 г.). «Взгляд на механизм реакции Негиши: ZnRX по сравнению с реагентами ZnR2». Журнал Американского химического общества . 129 (12): 3508–9. дои : 10.1021/ja070235b . ПМИД 17328551 .
- ^ Фуэнтес Б., Гарсиа-Мельчор М., Лледос А., Масерас Ф., Касарес Х.А., Ухаке Г., Эспинет П. (август 2010 г.). «Палладий туда и обратно при сочетании Негиши транс-[PdMeCl(PMePh2)2] с ZnMeCl: экспериментальное исследование и метод ТФФ на стадии трансметаллирования». Химия: Европейский журнал . 16 (29): 8596–9. дои : 10.1002/chem.201001332 . ПМИД 20623568 .
- ^ Крэбтри Р. (2005). Металлоорганическая химия переходных металлов . Том. 4. Хобокен, Нью-Джерси: John Wiley and Sons Inc.
- ^ Лю Ц, Лан Ю, Лю Дж, Ли Г, Ву Ю.Д., Лэй А. (июль 2009 г.). «Выявление второй стадии трансметаллирования в соединении Негиши и ее конкуренции с восстановительным элиминированием: улучшение интерпретации механизма синтеза биарила». Журнал Американского химического общества . 131 (29): 10201–10. дои : 10.1021/ja903277d . ПМИД 19572717 . S2CID 58240 .
- ^ Фапале, Вилас Б.; Карденас, Диего Дж. (27 мая 2009 г.). «Реакции кросс-сочетания Негиши, катализируемые никелем: масштабы и механизмы» . Обзоры химического общества . 38 (6): 1598–1607. дои : 10.1039/B805648J . ISSN 1460-4744 . ПМИД 19587955 .
- ^ Чжоу, Цзяньжун (Стив); Фу, Грегори К. (декабрь 2003 г.). «Кросс-сочетания неактивированных вторичных алкилгалогенидов: катализируемые никелем реакции Негиши алкилбромидов и йодидов при комнатной температуре» . Журнал Американского химического общества . 125 (48): 14726–14727. дои : 10.1021/ja0389366 . ISSN 0002-7863 . ПМИД 14640646 .
- ^ Шли, Натан Д.; Фу, Грегори К. (26 ноября 2014 г.). «Никель-катализируемые арилирования бромидов пропаргиловой кислоты по Негиши: механистическое исследование» . Журнал Американского химического общества . 136 (47): 16588–16593. дои : 10.1021/ja508718m . ISSN 0002-7863 . ПМЦ 4277758 . ПМИД 25402209 .
- ^ Моррелл, Деннис Г.; Кочи, Джей К. (1 декабря 1975 г.). «Механистические исследования никелевого катализа при кросс-сочетании арилгалогенидов с алкилметаллами. Роль разновидностей арилалкилникеля (II) как промежуточных продуктов» . Журнал Американского химического общества . 97 (25): 7262–7270. дои : 10.1021/ja00858a011 . ISSN 0002-7863 .
- ^ Адам П. Смит, Скотт А. Сэвидж, Дж. Кристофер Лав и Кассандра Л. Фрейзер (2004). «Синтез 4-, 5- и 6-метил-2,2'-бипиридина с помощью стратегии кросс-сочетания Негиши: 5-метил-2,2'-бипиридин» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 10, с. 517 . - ^ Эй-ичи Негиси , Тамоцу Такахаши и Энтони О. Кинг (1993). «Синтез биарилов посредством катализируемой палладием кросс-сочетания: 2-метил-4'-нитробифенил» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 8, с. 430 . - ^ Эй-ити Негиси , Тамоцу Такахаши и Сигэру Баба (1993). «Палладий-катализируемый синтез сопряженных диенов» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 8, с. 295 . - ^ Ю Ю, Бонд А.Д., Леонард П.В., Лоренц У.Дж., Тимофеева Т.В., Воллхардт К.П., Уайтнер Г.Д., Яковенко А.А. (июнь 2006 г.). «Гексаферроценилбензол» . Химические коммуникации (24): 2572–4. дои : 10.1039/b604844g . ПМИД 16779481 .
- ^ Чжао Ю, Ван Х, Хоу Х, Ху Ю, Лэй А, Чжан Х, Чжу Л (ноябрь 2006 г.). «Окислительное кросс-сочетание посредством двойного переметаллирования: удивительно высокая селективность катализируемого палладием кросс-сочетания алкилцинка и алкинилстаннанов». Журнал Американского химического общества . 128 (47): 15048–9. дои : 10.1021/ja0647351 . ПМИД 17117830 .
- ^ Негиси, Эйичи; Кинг, Энтони О.; Окукадо, Нобухиса (1 мая 1977 г.). «Селективное образование углерод-углеродной связи посредством катализа переходных металлов. 3. Высокоселективный синтез несимметричных биарилов и диарилметанов никель- или палладий-катализируемой реакцией арил- и бензилцинковых производных с арилгалогенидами» . Журнал органической химии . 42 (10): 1821–1823. дои : 10.1021/jo00430a041 . ISSN 0022-3263 .
- ^ Гаврюшин Андрей; Кофинк, Кристиана; Маноликакес, Георг; Кнохель, Пол (1 октября 2005 г.). «Эффективное кросс-сочетание функционализированных арилцинкгалогенидов, катализируемое системой хлорид никеля-диэтилфосфит» . Органические письма . 7 (22): 4871–4874. дои : 10.1021/ol051615+ . ISSN 1523-7060 . ПМИД 16235910 .
- ^ Джованнини, Риккардо; Штюдеманн, Томас; Дюссен, Гаэль; Кнохель, Пол (1998). «Эффективное перекрестное соединение, катализируемое никелем, между углеродными центрами sp3» . Angewandte Chemie, международное издание . 37 (17): 2387–2390. doi : 10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M . ISSN 1521-3773 . ПМИД 29710957 .
- ^ Дженсен, Энн Эг; Кнохель, Пол (1 января 2002 г.). «Никель-катализируемая перекрестная связь между функционализированными первичными или вторичными алкилгалогенидами цинка и первичными алкилгалогенидами» . Журнал органической химии . 67 (1): 79–85. дои : 10.1021/jo0105787 . ISSN 0022-3263 . ПМИД 11777442 .
- ^ Джованнини, Риккардо; Кнохель, Пол (1 ноября 1998 г.). «Ni (II)-катализируемая перекрестная связь между полифункциональными производными арилцинка и первичными алкилйодидами» . Журнал Американского химического общества . 120 (43): 11186–11187. дои : 10.1021/ja982520o . ISSN 0002-7863 .
- ^ Фишер, Кристиан; Фу, Грегори К. (апрель 2005 г.). «Асимметричные никель-катализируемые кросс-сочетания Негиши вторичных α-бромамидов с цинкорганическими реагентами» . Журнал Американского химического общества . 127 (13): 4594–4595. дои : 10.1021/ja0506509 . ISSN 0002-7863 . ПМИД 15796523 .
- ^ Сын Сонхи; Фу, Грегори К. (1 марта 2008 г.). «Никель-катализируемые асимметричные кросс-сочетания Негиши вторичных аллилхлоридов с алкилцинками» . Журнал Американского химического общества . 130 (9): 2756–2757. дои : 10.1021/ja800103z . ISSN 0002-7863 . ПМИД 18257579 .
- ^ Фапале, Вилас Б.; Бунюэль, Елена; Гарсиа-Иглесиас, Мигель; Карденас, Диего Дж. (2007). «Катализируемое Ni каскадное образование связей C(sp3)C(sp3) путем реакций циклизации и кросс-сочетания иодоалканов с алкилгалогенидами цинка» . Angewandte Chemie, международное издание . 46 (46): 8790–8795. дои : 10.1002/anie.200702528 . ISSN 1521-3773 . ПМИД 17918274 .
- ^ Йоханссон Зеехурн CC, Китчинг М.О., Колакот Т.Дж., Сниекус В. (май 2012 г.). «Кросс-сочетание, катализируемое палладием: исторический контекстуальный взгляд на Нобелевскую премию 2010 года». Ангеванде Хеми . 51 (21): 5062–85. дои : 10.1002/anie.201107017 . ПМИД 22573393 .
- ^ Сасе С., Ярич М., Мецгер А., Малахов В., Кнохель П. (сентябрь 2008 г.). «Реакции кросс-сочетания Негиши в одном сосуде in situ приводят к образованию реагентов цинка с арилхлоридами, бромидами и трифлатами». Журнал органической химии . 73 (18): 7380–2. дои : 10.1021/jo801063c . ПМИД 18693766 .
- ^ Мэнли П.В., Аджемоглу М., Мартерер В., Пахингер В. (2003). «Крупномасштабное соединение Негиши применительно к синтезу PDE472, ингибитора фосфодиэстеразы типа 4D». Исследования и разработки органических процессов . 7 (3): 436–445. дои : 10.1021/op025615q .
- ^ Торборг С., Беллер М. (2009). «Недавние применения реакций сочетания, катализируемых палладием, в фармацевтической, агрохимической и тонкой химической промышленности». Расширенный синтез и катализ . 351 (18): 3027–3043. дои : 10.1002/adsc.200900587 .
- ^ Николау К.К., Балджер П.Г., Сарла Д. (июль 2005 г.). «Реакции кросс-сочетания, катализируемые палладием, в полном синтезе». Ангеванде Хеми . 44 (29): 4442–89. дои : 10.1002/anie.200500368 . ПМИД 15991198 .
- ^ Лессене Дж. (2004). «Достижения в области муфты Негиши». Ауст. Дж. Чем . 57 (1): 107. дои : 10.1071/ch03225 .
- ^ Торсселл С., Ваннгрен Э., Сомфаи П. (май 2007 г.). «Тотальный синтез (-)-стемоамида». Журнал органической химии . 72 (11): 4246–9. дои : 10.1021/jo070498o . ПМИД 17451274 .
- ^ Гусовский Ф., Пэджетт В.Л., Кревелинг Ч.Р., Дейли Дж.В. (декабрь 1992 г.). «Взаимодействие пумилиотоксина B с «алкалоидсвязывающим доменом» на потенциалзависимом натриевом канале». Молекулярная фармакология . 42 (6): 1104–8. ПМИД 1336116 .
- ^ Аояги С., Хирасима С., Сайто К., Кибаяши С. (2002). «Конвергентный подход к алкалоидам пумилиотоксина. Асимметричный общий синтез (+)-пумилиотоксинов A, B и 225F». Журнал органической химии . 67 (16): 5517–5526. дои : 10.1021/jo0200466 . ПМИД 12153249 .
- ^ Мэлони DJ, Hecht SM (сентябрь 2005 г.). «Стереоконтролируемый синтез дельта-транс-токотриеноловой кислоты». Органические письма . 7 (19): 4297–300. дои : 10.1021/ol051849t . ПМИД 16146411 .
- ^ Смит, Шон В.; Фу, Грегори К. (2008). «Никель-катализируемые кросс-сочетания Негиши вторичных нуклеофилов со вторичными пропаргиловыми электрофилами при комнатной температуре» . Angewandte Chemie, международное издание . 47 (48): 9334–9336. дои : 10.1002/anie.200802784 . ISSN 1521-3773 . ПМК 2790060 . ПМИД 18972493 .
- ^ Шмидт, Томас; Киршнинг, Андреас (2012). «Полный синтез каролактона, высокоэффективного ингибитора биопленок» . Angewandte Chemie, международное издание . 51 (4): 1063–1066. дои : 10.1002/anie.201106762 . ISSN 1521-3773 . ПМИД 22162345 .
- ^ Хо С. (февраль 2003 г.). «Высокоэффективная общая методика приготовления алкилцинковых реагентов из неактивированных алкилбромидов и хлоридов». Органические письма . 5 (4): 423–5. дои : 10.1021/ol0272693 . ПМИД 12583734 .
- ^ Джованнини Р., Кнохель П. (1998). «Ni (II)-катализируемая перекрестная связь между полифункциональными производными арилцинка и первичными алкилйодидами». Журнал Американского химического общества . 120 (43): 11186–11187. дои : 10.1021/ja982520o .
- ^ Сасе, Сёхей; Ярич, Милица; Мецгер, Альбрехт; Малахов Владимир; Кнохель, Пол (19 сентября 2008 г.). «Реакции кросс-сочетания Негиши в одном сосуде реагентов цинка, полученных in situ, с арилхлоридами, бромидами и трифлатами» . Журнал органической химии . 73 (18): 7380–7382. дои : 10.1021/jo801063c . ISSN 0022-3263 . ПМИД 18693766 .
Внешние ссылки
[ редактировать ]- Соединение Негиши на сайте www.organic-chemistry.org.






![Приготовление арилцинкового реагента {\displaystyle {\begin{matrix}{}\\{\ce {Ar-I->[{\begin{matrix}{\ce {iPrMgCl}}\\{\text{THF}}\end{matrix} }][{\ce {ZnBr2}}]Ar-ZnBr}}\end{матрица}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/207cdded6086749bdb7e5dd64cf22c29306ff367)