Дегалогенирование
В органической химии дегалогенирование — совокупность химических реакций , в ходе которых происходит разрыв связей углерод — галоген ; как таковая, это обратная реакция галогенирования . Дегалогенирование бывает разных видов, включая дефторирование (удаление фтора ), дехлорирование (удаление хлора ), дебромирование (удаление брома ) и дейодирование (удаление йода ). Стимулы к исследованию дегалогенирования включают как конструктивные, так и деструктивные цели. Сложные органические соединения, такие как фармацевтические препараты, иногда образуются в результате дегалогенирования. Многие галогенорганические соединения опасны, поэтому их дегалогенирование является одним из путей их детоксикации. [1]
Механистические и термодинамические концепции
[ редактировать ]Удаление атома галогена из галогенорганического соединения приводит к образованию радикала. Таких реакций трудно добиться, а когда они возможны, эти процессы часто приводят к образованию сложных смесей. Когда пара галогенидов взаимно соседствует ( вициналь ), их удаление предпочтительнее. Такие реакции дают алкены в случае вицинальных алкилдигалогенидов: [2]
- R 2 C(X)C(X)R 2 + M → R 2 C=CR 2 + MX 2
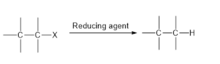
Наиболее желательным с точки зрения восстановления является дегалогенирование путем гидрогенолиза , т.е. замена связь C-X посредством C-H Связь . Катализу поддаются такие реакции:
- R−X + H 2 → R−H + HX
Скорость дегалогенирования зависит от прочности связи между атомом углерода и атомом галогена. Энергии диссоциации связей углерод-галоген описываются как: H 3 C-I (234 кДж/моль), H 3 C−Br (293 кДж/моль), H 3 C-Cl (351 кДж/моль) и H 3 C-F (452 кДж/моль). Таким образом, для одних и тех же структур скорость диссоциации связей при дегалогенировании составит: F < Cl < Br < I. [3] Кроме того, скорость дегалогенирования алкилгалогенидов также варьируется в зависимости от стерической среды и следует этой тенденции: первичные > вторичные > третичные галогениды. [3]
Приложения
[ редактировать ]Поскольку хлорорганические соединения являются наиболее распространенными галогенорганическими соединениями, большинство дегалогенирований влекут за собой манипуляции со связями C-Cl.
Органический синтез
[ редактировать ]Некоторый интерес для органического синтеза представляют электроположительные металлы, которые реагируют со многими органическими галогенидами в результате обмена металл-галоген :
- RX + 2 М → RM + MX
Образующееся металлоорганическое соединение подвержено гидролизу:
- RM + H 2 O → RH + МОН
Хорошо изученные примеры можно найти в литийорганической и магнийорганической химии . Ниже приведены некоторые показательные случаи.
Литий-галогеновый обмен по существу не имеет отношения к восстановлению, но этот метод полезен для тонкого химического синтеза. [4] [5] [6] Металлический натрий использовался в процессе дегалогенирования. [7] [8] Удаление атома галогена из арен-галогенидов в присутствии агента Гриньяра и воды с образованием нового соединения известно как деградация Гриньяра. Дегалогенирование с использованием реактивов Гриньяра представляет собой двухстадийный процесс гидродегалогенирования. Реакция начинается с образования алкил/арен-магний-галогенового соединения с последующим добавлением источника протонов с образованием дегалогенированного продукта. Егоров и его коллеги сообщили о дегалогенировании бензилгалогенидов с использованием атомарного магния в состоянии 3P при 600 ° C. В качестве продукта реакции были получены толуол и бибензилы. [9] Моррисон и его коллеги также сообщили о дегалогенировании органических галогенидов методом флэш-вакуумного пиролиза с использованием магния. [10]
С комплексами переходных металлов
[ редактировать ]Многие низковалентные и богатые электронами переходные металлы вызывают стехиометрическое дегалогенирование. [11] Реакция представляет практический интерес в контексте органического синтеза, например, сочетание Ульмана, промотируемое медью .
Реакцию в основном проводят стехиометрически. Некоторые металлоферменты (витамин B12 и кофермент F430) способны каталитически дегалогенировать. [12] Большой интерес представляют гидродегалогенирования, особенно хлорированных прекурсоров: [13]
- R−Cl + H2 → R−H + HCl


Дальнейшее чтение
[ редактировать ]- Готпагар, Дж.; Грульке, Э.; Бхаттачарья, Д.; Восстановительное дегалогенирование трихлорэтилена: кинетические модели и *Hetflejš, J.; Чаккоова, М.; Рерича, Р.; Вчелак, Дж. Катализируемое дегалогенирование делора 103 гидроалюминатом натрия. Хемосфера 2001, 44, 1521.
- Кагосима, Х.; Хасимото, Ю.; Огуро, Д.; Куцуна, Т.; Сайго, К. Комбинация трофенилфосфина и хлорида германия (IV): новый агент для восстановления производных α-бромкарбоновой кислоты. Тетраэдр, 1998, 39, 1203-1206
Ссылки
[ редактировать ]- ^ Смидт, Хауке; Де Вос, Виллем М. (2004). «Анаэробное микробное дегалогенирование». Ежегодный обзор микробиологии . 58 : 43–73. дои : 10.1146/annurev.micro.58.030603.123600 . ПМИД 15487929 .
- ^ Дж. К. Зауэр (1956). «1,1-Дихлор-2,2-Дифторэтилен». Органические синтезы . 36:19 . дои : 10.15227/orgsyn.036.0019 .
- ^ Jump up to: а б Трост, Барри М.; Флеминг, Ян (1991). Комплексный органический синтез – селективность, стратегия и эффективность в современной органической химии . Том. 1–9. Эльзевир. стр. 793–809. ISBN 0080359299 .
- ^ Рамон, Д.; Юс, М. Бишоменоляты лития в маске: полезные промежуточные соединения в органическом синтезе, J. Org. хим. 1991, 56, 3825-3831.
- ^ Гихарро, А.; Рамон, Д.; Юс, М. Нафталин-катализируемое литирование функционализированных хлораренов: региоселективное получение и реакционная способность функционализированных литиоаренов, Тетраэдр, 1993, 49, 469-482.
- ^ Юс, М.; Рамон, Д. Реакции литиирования, катализируемые ареном, литием при низкой температуре, Chem. Комм. 1991, 398–400.
- ^ Хавари, Дж. Региоселективность дехлорирования: восстановительное дехлорирование полихлорбифенилов полиметилгидросилоксан-щелочным металлом. Дж. Органомет. хим. 1992, 437, 91-98.
- ^ Маккензи, К.; Копинке, Ф.-Д. Дебромирование дуропластных огнестойких полимеров. Хемосфера, 1996, 33, 2423-2428.
- ^ Тараканова, А.; Анисимов А.; Егоров А. Низкотемпературное дегалогенирование бензилгалогенидов атомарным магнием в состоянии 3Р. Российский химический вестник, 1999, 48, 147-151.
- ^ Эйткен, Р.; Ходжсон, П; Оевале, А.' Моррисон, Дж. Дегалогенирование органических галогенидов путем флэш-вакуумного пиролиза над магнием: универсальный синтетический метод. хим. Коммун. 1997, 1163-1164.
- ^ Грушин, В.; Альпер, Х. Активация нереакционноспособных связей C-Cl. Вершина. Органомет. хим. 1999, 3, 193–226.
- ^ Гедык, Мацей; Голишевска, Катажина; Грыко, Дорота (2015). «Реакции, катализируемые витамином B12». Обзоры химического общества . 44 (11): 3391–3404. дои : 10.1039/C5CS00165J . ПМИД 25945462 .
- ^ Алонсо, Франциско; Белецкая Ирина П.; Юс, Мигель (2002). «Металлоопосредованное восстановительное гидродегалогенирование органических галогенидов». Химические обзоры . 102 (11): 4009–4092. дои : 10.1021/cr0102967 . ПМИД 12428984 .