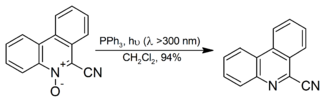Трифенилфосфин
 | |
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Трифенилфосфан [1] | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.009.124 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3077 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 18 Ч 15 П | |
| Молярная масса | 262.292 g·mol −1 |
| Появление | Белый сплошной |
| Плотность | 1,1 г см −3 , твердый |
| Температура плавления | 80 ° С (176 ° F; 353 К) |
| Точка кипения | 377 ° С (711 ° F, 650 К) |
| нерастворимый | |
| Растворимость | органические растворители |
| Кислотность ( pKa ) | 7.64 [2] (p K a сопряженной кислоты в ацетонитриле) 2.73 [3] (p K a сопряженной кислоты, водная накипь) |
| -166.8·10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1,59; ε р и т. д. |
| Структура | |
| Пирамидальный | |
| 1,4 – 1,44 Д [4] | |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х302 , Х317 , Х350 , Х412 | |
| P201 , P202 , P261 , P264 , P270 , P272 , P273 , P280 , P281 , P301+P312 , P302+P352 , P308+P313 , P321 , P330 , P333+P313 , P363 , P405 , 501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 180 ° С (356 ° F; 453 К) |
| Паспорт безопасности (SDS) | Фишер Сайентифик |
| Родственные соединения | |
Родственные третичные фосфины | Триметилфосфин Фосфин |
Родственные соединения | Трифениламин Трифениларсин Трифенилстибин оксид трифенилфосфина Трифенилфосфинсульфид Трифенилфосфин дихлорид Трифенилфосфинселенид Pd(PPh 3 ) 4 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Трифенилфосфин (название ИЮПАК: трифенилфосфан ) представляет собой распространенное фосфорорганическое соединение с формулой P(C 6 H 5 ) 3 и часто сокращается до P Ph 3 или Ph 3 P. Это универсальное соединение, которое широко используется в качестве реагента в органическом синтезе и в качестве лиганда комплексов переходных металлов, в том числе служащих катализаторами в металлоорганической химии . PPh 3 существует в виде относительно устойчивых на воздухе бесцветных кристаллов при комнатной температуре. Он растворяется в неполярных органических растворителях, таких как бензол и диэтиловый эфир .
Подготовка и структура [ править ]
Трифенилфосфин можно получить в лаборатории обработкой фосфора фенилмагнийбромидом трихлорида или фениллитием . Промышленный синтез включает реакцию между трихлоридом фосфора , хлорбензолом и натрием: [5]
- PCl 3 + 3 PhCl + 6 Na → PPh 3 + 6 NaCl
Трифенилфосфин кристаллизуется в триклинной [6] и моноклинная модификация. [7] В обоих случаях молекула принимает пирамидальную структуру с расположением трех фенильных групп, напоминающим пропеллер.
с халькогенами, галогенами и кислотами Основные реакции
Окисление [ править ]
Трифенилфосфин подвергается медленному окислению воздухом с образованием оксида трифенилфосфина Ph 3 PO:
- 2 ПФ 3 + О 2 → 2 ОПФ 3
Эту примесь можно удалить перекристаллизацией PPh 3 из горячего этанола или изопропанола . [8] Этот метод основан на том факте, что OPPH 3 более полярен и, следовательно, более растворим в полярных растворителях, чем PPh 3 .
Трифенилфосфин абстрагирует серу от полисульфидных соединений, эписульфидов и элементарной серы . Однако простые сероорганические соединения, такие как тиолы и тиоэфиры , нереакционноспособны. Фосфорсодержащий продукт – трифенилфосфинсульфид , Ph 3 PS. Эту реакцию можно использовать для анализа «лабильного» S. 0 содержание образца, скажем, вулканизированной резины. Селенид трифенилфосфина, Ph 3 PSe, можно легко получить обработкой PPh 3 красным (альфа-моноклинным) Se . Соли селеноцианата , SeCN − , используются как Se 0 источник. PPh 3 также может образовывать аддукт с Te, хотя этот аддукт существует преимущественно в виде (Ph 3 P) 2 Te, а не PPh 3 Te. [9]
Арилазиды 3 реагируют с PPh 3 с образованием фосфаниминов, аналогов OPPh , по реакции Штаудингера . Показательным является получение трифенилфосфинфенилимида :
- ПФ 3 + ФН 3 → ФНПФ 3 + Н 2
Фосфанимин может быть гидролизован до амина. Обычно промежуточный фосфанимин не выделяют.
- ПФ 3 + РН 3 + Н 2 О → ОПФ 3 + Н 2 + РНХ 2
Хлорирование [ править ]
Cl 2 присоединяется к PPh 3 с образованием дихлорида трифенилфосфина ([PPh 3 Cl]Cl), который существует в виде чувствительного к влаге галогенида фосфония . Этот реагент используется для превращения спиртов в алкилхлориды в органическом синтезе . Хлорид бис(трифенилфосфин)иминия (ППН) + кл. − , формула [(C 6 H 5 ) 3 P) 2 N]Cl получают из дихлорида трифенилфосфина: [10]
- 2 Ph 3 PCl 2 + NH 2 OH·HCl + Ph 3 P → {[Ph 3 P] 2 N}Cl + 4HCl + Ph 3 PO
Протонирование [ править ]
PPh 3 является слабым основанием (водное значение p K aH = 2,73, определенное электрохимически), хотя оно является значительно более сильным основанием, чем NPh 3 (расчетное водное значение p K aH < –3). [11] Он образует изолируемые соли трифенилфосфония с сильными кислотами, такими как HBr: [12]
- P(C 6 H 5 ) 3 + HBr → [HP(C 6 H 5 ) 3 ] + Бр −
Органические реакции [ править ]
ПФ 3 широко используется в органическом синтезе . Свойствами, определяющими его использование, являются его нуклеофильность и восстановительный характер. [13] На нуклеофильность PPh 3 указывает его реакционная способность по отношению к электрофильным алкенам, таким как акцепторы Михаэля и алкилгалогениды. Он также используется в синтезе биарильных соединений, например, в реакции Сузуки .
Кватернизация [ править ]
PPh 3 соединяется с алкилгалогенидами с образованием фосфониевых солей . Эта реакция кватернизации протекает особенно быстро для бензильных и аллилгалогенидов:
- ПФ 3 + СН 3 I → [СН 3 ППф 3 ] + я −
Эти соли, которые часто можно выделить в виде кристаллических твердых веществ, реагируют с сильными основаниями с образованием илидов , которые являются реагентами в реакциях Виттига .
Арилгалогениды кватернизируют PPh 3 с образованием солей тетрафенилфосфония :
- PPh 3 + PhBr → [PPh 4 ]Br
Однако реакция требует повышенных температур и металлических катализаторов.
Реакция Мицунобу [ править ]
В реакции Мицунобу смесь трифенилфосфина и диизопропилазодикарбоксилата («ДИАД» или его диэтиловый аналог DEAD ) превращает спирт и карбоновую кислоту в сложный эфир. ДИАД восстанавливается, поскольку он служит акцептором водорода, а PPh 3 окисляется до OPPh 3 .
Реакция на апелляцию [ править ]
В реакции Аппеля смесь PPh 3 и CX 4 (X = Cl, Br) используется для превращения спиртов в алкилгалогениды. Оксид трифенилфосфина (OPPH 3 ) является побочным продуктом.
- ПФ 3 + CBr 4 + RCH 2 OH → OPPh 3 + RCH 2 Br + HCBr 3
Эта реакция начинается с нуклеофильной атаки PPh 3 на CBr 4 , что является продолжением реакции кватернизации, указанной выше.
Деоксигенация [ править ]
Легкое оксигенирование PPh 3 используется при его использовании для деоксигенации органических пероксидов, что обычно происходит с сохранением конфигурации:
- PPh 3 + RO 2 H → OPPH 3 + ROH (R = алкил)
Его также используют для разложения органических озонидов на кетоны и альдегиды, хотя диметилсульфид более популярен для реакции в качестве побочного продукта, диметилсульфоксид легче отделяется от реакционной смеси, чем оксид трифенилфосфина. Ароматические N -оксиды восстанавливаются до соответствующего амина с высоким выходом при комнатной температуре и облучении: [14]
Сульфирование [ править ]
Сульфирование PPh 3 дает трис(3-сульфофенил)фосфин, P(C 6 H 4 -3-SO 3 − ) 3 ( TPPTS ), обычно выделяют в виде тринатриевой соли. В отличие от PPh 3 , ТППТС, как и его металлические производные, растворим в воде. Комплексы родия ТППТС используются в некоторых промышленных реакциях гидроформилирования . [15]

до дифенилфосфида Восстановление
Литий в ТГФ , а также Na или K реагируют с PPh 3 с образованием Ph 2 PM (M = Li, Na, K). Эти соли являются универсальными предшественниками третичных фосфинов. [16] [17] Например, 1,2-дибромэтан и Ph 2 PM реагируют с образованием Ph 2 PCH 2 CH 2 PPh 2 . Слабые кислоты, такие как хлорид аммония , превращают Ph 2 PM (M = Li, Na, K) в дифенилфосфин : [17]
- (C 6 H 5 ) 2 ПМ + H 2 O → (C 6 H 5 ) 2 PH + МОН
Комплексы переходных металлов [ править ]
Трифенилфосфин хорошо связывается с большинством переходных металлов , особенно с металлами средних и поздних переходных групп 7–10. [18] Что касается стерического объема, PPh 3 имеет угол конуса Толмена 145°. [19] который занимает промежуточное положение между P(C 6 H 11 ) 3 (170°) и P(CH 3 ) 3 (115°). Впервые в гомогенном катализе NiBr 2 (PPh 3 ) 2 был использован Уолтером Реппе для синтеза сложных эфиров акрилатов из алкинов , оксида углерода и спиртов . [20] Использование PPh 3 стало популярным благодаря его использованию в катализаторе гидроформилирования RhH(PPh 3 ) 3 (CO).
полимерным 3 Производные закреплением с PPh
полимерные аналоги PPh 3 Известны , в которых полистирол модифицирован группами PPh 2 в пара-положении. Такие полимеры можно использовать во многих областях применения, используемых для PPh 3, с тем преимуществом, что полимер, будучи нерастворимым, может быть отделен от продуктов простой фильтрацией реакционных суспензий. Такие полимеры получают обработкой 4-литиофенилзамещенного полистирола хлордифенилфосфином ( PPh 2 Cl).
См. также [ править ]
- Трис(о-толил)фосфин
- Децил(трифенил)фосфоний
- Комплекс Васьки
- Катализатор Уилкинсона
- Дихлорид бис(трифенилфосфин)никеля(II)
- Дихлорид бис(трифенилфосфин)палладия(II)
- Реактив Страйкера
Ссылки [ править ]
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 431. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Хаав, Кристьян; Мы можем, Яан; Хантер, Агнес; Лейто, Иво (2012). «Основность фосфанов и дифосфанов в ацетонитриле» . Европейский журнал органической химии . 2012 (11): 2167–2172. дои : 10.1002/ejoc.201200009 . ISSN 1434-193Х .
- ^ Оллман, Тим; Гоэл, Рам Г. (1982). «Основность фосфинов» . Канадский химический журнал . 60 (6): 716–722. дои : 10.1139/v82-106 .
- ^ Уорхол, М.; Дикарло, EN; Марьянов, Калифорния; Мислоу, К. (1975). «Доказательства вклада неподеленной пары в молекулярный дипольный момент триарилфосфинов». Буквы тетраэдра . 16 (11): 917–920. дои : 10.1016/S0040-4039(00)72019-3 .
- ^ Корбридж, Декабрь (1995). Фосфор: очерк химии, биохимии и технологии (5-е изд.). Амстердам: Эльзевир. ISBN 0-444-89307-5 .
- ^ Койджман, Х.; Бэкон, Алабама; ван Боммель, KJC; Вербум, В.; Рейнхудт, Д.Н. (1998). «Триклиническая модификация трифенилфосфина» (PDF) . Акта Кристаллографика . C54 (11): 1695–1698. Стартовый код : 1998AcCrC..54.1695K . дои : 10.1107/S0108270198009305 .
- ^ Данн, Би Джей; Орпен, АГ (1991). «Трифенилфосфин: новое определение» (PDF) . Акта Кристаллографика . С47 (2): 345–347. Бибкод : 1991AcCrC..47..345D . дои : 10.1107/S010827019000508X .
- ^ Армарего, ВЛФ; Перрин, Д.Д.; Перрин, доктор медицинских наук (1980). Очистка лабораторных химикатов (2-е изд.). Нью-Йорк: Пергамон. п. 455. ИСБН 978-0-08-022961-4 .
- ^ Джонс, CHW; Шарма, Р.Д. (1987). " 125 Те-ЯМР и мессбауэровская спектроскопия теллур-фосфиновых комплексов и теллуроцианатов». Металлоорганические соединения . 6 (7): 1419–1423. doi : 10.1021/om00150a009 .
- ^ Рафф, Дж. К.; Шлинц, WJ (1974). «Соли μ-нитридобиса (трифенилфосфора) (l +) («PPN») с карбонильными анионами металлов». Неорганические синтезы . Том. 15. С. 84–90. дои : 10.1002/9780470132463.ch19 . ISBN 978-0-470-13246-3 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Оллман, Тим; Гоэл, Рам Г. (15 марта 1982 г.). «Основность фосфинов» . Канадский химический журнал . 60 (6): 716–722. дои : 10.1139/v82-106 . ISSN 0008-4042 .
- ^ Эркуэ, А.; ЛеКорр, М. (1988) Бромид трифенилфосфония: удобный и количественный источник газообразного бромистого водорода. Синтез, 157–158.
- ^ Кобб, Дж. Э.; Криббс, CM; Хенке, БР; Юлинг, Германия; Эрнан, АГ; Мартин, К.; Рейнер, CM (2004). «Трифенилфосфин». В Л. Пакетте (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X.rt366.pub2 . ISBN 0-471-93623-5 .
- ^ Берк, SD; Данхайзер, РЛ (1999). «Трифенилфосфин». Справочник реагентов для органического синтеза, окислителей и восстановителей . Уайли. п. 495. ИСБН 978-0-471-97926-5 .
- ^ Херрманн, Вашингтон; Кольпайнтнер, CW (2007). «Синтез водорастворимых фосфинов и их комплексов переходных металлов». Неорганические синтезы . Том. 32. стр. 8–25. дои : 10.1002/9780470132630.ch2 . ISBN 978-0-470-13263-0 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Джордж Лютер III; Гордон Байерли (1977). «Дифенилфосфид лития и дифенил(триметилсилил)фосфин». Неорганические синтезы . Том. 17. С. 186–188. дои : 10.1002/9780470132487.ch51 . ISBN 978-0-470-13248-7 .
- ↑ Перейти обратно: Перейти обратно: а б В.Д. Бьянко С. Доронцо (1976). «Дифенилфосфин». Неорганические синтезы . Том. 16. С. 161–188. дои : 10.1002/9780470132470.ch43 . ISBN 978-0-470-13247-0 .
- ^ Эльшенбройх, К.; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH. ISBN 3-527-28165-7 .
- ^ Иммирзи, А.; Муско, А. (1977). «Метод измерения размера фосфорных лигандов в координационных комплексах». Неорганика Химика Акта . 25 : L41–L42. дои : 10.1016/S0020-1693(00)95635-4 .
- ^ * Реппе, В.; Швекендик, WJ (1948). «Циклизационная полимеризация ацетилена. III Бензол, производные бензола и гидроароматические соединения». «Анналы химии» Юстуса Либиха . 560 (1): 104–116. дои : 10.1002/jlac.19485600104 .