Апелляционная реакция
| Апелляционная реакция | |
|---|---|
| Назван в честь | Рольф Аппель |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | апелляционная реакция |
| RSC Идентификатор онтологии | RXNO: 0000406 |
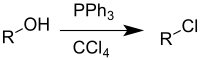
Реакция Аппеля — это органическая реакция , которая превращает спирт в алкилхлорид с использованием трифенилфосфина и четыреххлористого углерода . [ 1 ] Использование тетрабромида углерода или брома в качестве источника галогенидов дает алкилбромиды, тогда как использование тетрайодида углерода , метилиодида или йода дает алкилйодиды . Реакция приписана и названа в честь Рольфа Аппеля . [ 2 ] однако это было описано ранее. [ 3 ] Использование этой реакции становится все менее распространенным из-за на тетрахлорметан ограничений в соответствии с Монреальским протоколом .
Недостатками реакции являются использование токсичных галогенирующих агентов и совместное производство фосфорорганического продукта, который необходимо отделять от органического продукта. [ 4 ] Фосфорный реагент можно использовать в каталитических количествах. [ 5 ] [ 6 ] Соответствующий алкилбромид также можно синтезировать добавлением бромида лития в качестве источника бромид-ионов. Сообщалось также о более экологичной и устойчивой реакции Аппеля, не содержащей хлорированных растворителей и требующей только каталитического количества фосфинового реагента. [ 7 ]

Механизм
[ редактировать ]Реакция Аппеля начинается с образования фосфониевой соли 3 , которая, как полагают, существует в виде плотной ионной пары с 4 [ 8 ] и поэтому не может подвергаться альфа-элиминированию с образованием дихлоркарбена . Депротонирование спирта с образованием хлороформа дает алкоксид 5 . Нуклеофильное замещение хлорида алкоксидом дает промежуточное соединение 7 . С первичными и вторичными спиртами галогенид реагирует в процессе S N 2 с образованием алкилгалогенида 8 и оксида трифенилфосфина . Третичные спирты образуют продукты 6 и 7 по механизму S N 1 .
Движущей силой этой и подобных реакций является образование прочной двойной связи PO. [ 9 ] Реакция чем-то похожа на реакцию Мицунобу , где комбинация органофосфина в качестве акцептора оксида, азосоединения в качестве реагента, акцептора водорода, и нуклеофила используется для превращения спиртов в сложные эфиры и других подобных применений. [ 10 ]

Показательным применением реакции Аппеля является хлорирование гераниола до геранилхлорида. [ 11 ]
Модификации
[ редактировать ]Реакция Аппеля также эффективна для карбоновых кислот ; это использовалось для преобразования их в оксазолины , оксазины и тиазолины . [ 12 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Рольф Аппель (1975). «Третичный фосфан/тетрахлорметан, универсальный реагент для хлорирования, обезвоживания и PN-связывания». Angewandte Chemie International Edition на английском языке . 14 (12): 801–811. дои : 10.1002/anie.197508011 .
- ^ «Химия» . Архивировано из оригинала 11 августа 2019 г. Проверено 24 августа 2011 г.
- ^ Дауни, я; Холмс, Дж; Ли, Дж (1966). «Получение алкилхлоридов в мягких условиях». Химия и промышленность (22): 900. ISSN 0009-3068 .
- ^ Кадоган, Дж., изд. (1979). Фосфорорганические реагенты в органическом синтезе . Лондон: Академическая пресса. ISBN 978-0-12-154350-1 .
- ^ Дентон, Росс; Ань, Цзе; Адениран, Беатрис; Блейк, Александр; Льюис, Уильям; Поултон, Эндрю (2011). «Каталитические реакции нуклеофильного замещения, опосредованные фосфором (V): развитие каталитической реакции Аппеля». Журнал органической химии . 76 (16): 6749–6767. дои : 10.1021/jo201085r . ПМИД 21744876 .
- ^ ван Калкерен, Генри А.; Лендерс, Стефан Хэм; Хоммерсом, Дж. (Рианна) А.; Рутьес, Флорис ПДжТ; ван Делфт, Флорис Л. (2011). «Восстановление оксида фосфина in situ: каталитическая реакция аппеля». Химия: Европейский журнал . 17 (40): 11290–11295. дои : 10.1002/chem.201101563 . hdl : 2066/91927 . ПМИД 21882274 .
- ^ Джордан, Эндрю; Дентон, Росс М.; Снеддон, Хелен Ф. (10 февраля 2020 г.). «Разработка более устойчивой апелляционной реакции» . ACS Устойчивая химия и инженерия . 8 (5): 2300–2309. doi : 10.1021/acssuschemeng.9b07069 . S2CID 213147247 .
- ^ Ван, Зеронг (2009). «22: Апелляционная реакция». Комплексные органические реакции и реагенты . Хобокен, Нью-Джерси: Джон Уайли. стр. 95–99. дои : 10.1002/9780470638859.conrr022 . ISBN 9780470638859 .
- ^ «Архивная копия» (PDF) . Архивировано из оригинала (PDF) 22 июля 2012 г. Проверено 11 июля 2012 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Хосе Г. Кальсада и Джон Хуз (1974). «Геранилхлорид». Органические синтезы . 54:63 . дои : 10.15227/orgsyn.054.0063 .
- ^ Форбрюгген, Хельмут; Кроликевич, Конрад (январь 1993 г.). «Простой синтез Δ2-оксазинов, Δ2-оксазинов, Δ2-тиазолинов и 2-замещенных бензоксазолов». Тетраэдр . 49 (41): 9353–9372. дои : 10.1016/0040-4020(93)80021-К .
