Перегруппировка дивинилциклопропан-циклогептадиена
Перегруппировка дивинилциклопропан -циклогептадиен представляет собой органическое химическое превращение, которое включает изомеризацию 1,2-дивинилциклопропана в циклогептадиен или -триен. Концептуально это связано с перегруппировкой Коупа , но имеет преимущество сильной термодинамической движущей силы из-за снятия напряжения кольца. Эта термодинамическая энергия в последнее время рассматривается как альтернативный источник энергии. [1]
Введение
[ редактировать ]В 1960 году Фогель обнаружил, что 1,2-дивинилциклопропан перегруппировывается в циклогептан-1,4-диен. [2] После его открытия в 1960-х годах последовала серия интенсивных механистических исследований реакции, когда исследователи поняли, что она имеет сходство (как структурное, так и механистическое) с соответствующей перегруппировкой винилциклопропана в циклопентен. К 1970-м годам перегруппировка достигла синтетической полезности. [3] и по сей день это продолжает оставаться полезным методом образования семичленных колец. Сообщалось о вариациях, включающих гетероатомы (см. Ниже).
(1)

Преимущества: Будучи перегруппировкой, процесс демонстрирует идеальную атомную экономику. Часто оно протекает спонтанно, без необходимости использования катализатора. Конкурентные пути для полноуглеродной перегруппировки минимальны.
Недостатки: во многих случаях необходимо контролировать конфигурацию исходных материалов — транс -дивинилциклопропаны часто требуют нагревания для облегчения изомеризации, прежде чем произойдет перегруппировка. Перегруппировки с участием гетероатомов могут давать пониженные выходы из-за образования побочных продуктов.
Механизм и стереохимия
[ редактировать ]Преобладающий механизм
[ редактировать ]Основные дебаты относительно механизма перегруппировки сосредоточены на том, является ли это согласованным (сигматропным) или ступенчатым (дирадикальным) процессом. Механистические эксперименты показали, что транс -дивинилциклопропаны эпимеризуются с образованием соответствующих цис -изомеров и подвергаются перегруппировке по, скорее всего, согласованному пути. [4] [5] Было предложено переходное состояние, подобное лодке, которое помогает объяснить наблюдаемую стереоспецифичность процесса. В большинстве случаев неясно, происходит ли первоначальная эпимеризация транс - субстратов посредством одно- или двухцентрового процесса. (2)

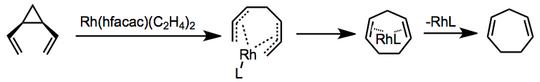
Известны варианты перегруппировки, катализируемые переходными металлами, и механизмы различаются. В одном примере с использованием бис(этилен)гексафторацетилацетоната родия координация и образование бис-π-аллильного комплекса предшествуют замыканию электроциклического кольца и высвобождению катализатора. [6]
(3)
Стереоселективные варианты
[ редактировать ]Реакции дивинилциклопропанов, содержащих замещенные двойные связи, стереоспецифичны по отношению к конфигурации двойных связей: цис , цис- изомеры дают цис- продукты, а цис- , транс- изомеры - транс-продукты. Таким образом, хиральные нерацемические исходные материалы дают хиральные продукты без потери энантиомерной чистоты. В приведенном ниже примере в каждом случае наблюдались только изображенные изомеры. [7]
(4)

Область применения и ограничения
[ редактировать ]В титульную реакцию вступают самые разнообразные дивинилциклопропаны. Эти предшественники были получены различными методами, включая добавление циклопропильных нуклеофилов (солей лития, [8] или медь [9] ) к активированным двойным или тройным связям, отщепление бис(2-галогенэтил)циклопропанов [10] и циклопропанирование. [11]
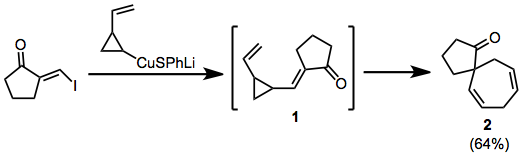
В приведенном ниже примере присоединение-отщепление купрата приводит к образованию временного енона 1 , который перегруппировывается в спироцикл 2 .
(5)
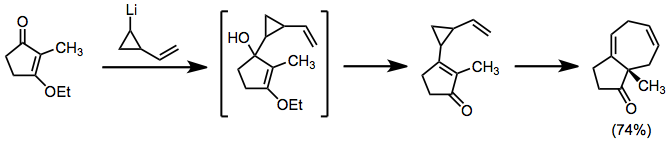
Литийорганические соединения можно использовать в аналогичной роли, но они непосредственно присоединяются к карбонилам. Результат — продукты с объединенной топологией. [8]
(6)
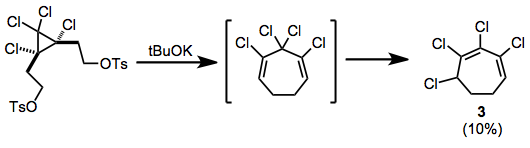
Наблюдалась перегруппировка после устранения дитозилатов; Полученный таким образом хлорированный циклогептадиен изомеризуется в конъюгированный гептадиен 3 во время реакции. [10]
(7)
Циклоппропанирование сопряженными диазосоединениями приводит к образованию дивинилциклопропанов, которые затем подвергаются перегруппировке. При использовании циклических исходных материалов образуются мостиковые продукты. [12]
(8)
В реакцию могут вступать и субстраты, содержащие трехчленные гетероциклические кольца. цис -дивинилэпоксиды дают оксепины при повышенных температурах (100 °C). транс- изомеры подвергаются интересной конкурентной перегруппировке в дигидрофураны при посредничестве карбонилилида . [13] и тот же илидный промежуточный продукт был предложен в качестве прямого предшественника оксепина 4 . [14] Сопряженные диенилэпоксиды образуют аналогичные продукты, что подтверждает существование илидного промежуточного соединения. [15] (9)

Дивинилазиридины зависимости от подвергаются аналогичному набору реакций с образованием азепинов или винилпирролинов в относительной конфигурации исходного азиридина. [16] Дивинилтираны могут образовывать тиепины или дигидротиофены, хотя эти реакции протекают медленнее, чем реакции соответствующих азот- и кислородсодержащих соединений.
Синтетические приложения
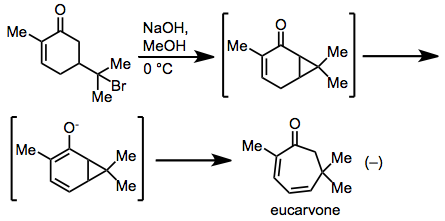
[ редактировать ]Самое раннее наблюдение циклогептадиена посредством перегруппировки заголовка было сделано Байером при синтезе эукарвона из гидробромида карвона. [17] Механистические исследования показали, что перегруппировка действительно протекает по согласованному механизму типа Коупа. [18]
(10)
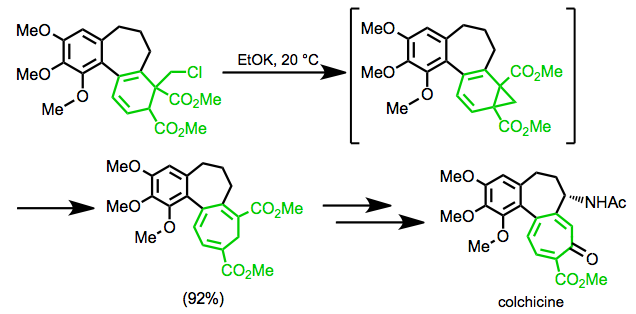
В синтезе колхицина Эшенмозера перегруппировка используется для образования семичленного кольца мишени. [19]
(11)
Рацемический синтез сиренина использует реакцию Виттига с образованием ключевого дивинилциклопропана. Гидрирование продукта перегруппировки позволило достичь цели. [20]
(12)

Условия и методика эксперимента
[ редактировать ]Типичные условия
[ редактировать ]Обычно перегруппировку проводят сразу после образования дивинилциклопропана в том же сосуде. Иногда необходимо нагревание, особенно для транс -субстратов, которые перед перегруппировкой должны подвергнуться эпимеризации. Однако при наличии достаточного количества энергии для преодоления активационных барьеров изомеризация обычно оказывается очень эффективной.
Пример процедуры
[ редактировать ](13)

К холодному (–78°) при перемешивании раствору диизопропиламида лития (1,4–1,5 ммоль/ммоль кетона) в сухом ТГФ (4 мл/ммоль основания) в атмосфере аргона медленно прибавляли раствор н-бутил-транса. -2-винилциклопропилкетон (1,19 ммоль) в сухом ТГФ (1 мл/ммоль кетона) и полученный раствор перемешивали при –78° в течение 45 минут. раствор свежесублимированного трет-бутилдиметилсилилхлорида (1,6 ммоль/ммоль кетона) в сухом ТГФ Добавляли (1 мл/ммоль хлорида), а затем сухой HMPA (0,5 мл/ммоль кетона). Раствор перемешивали при –78° в течение 15 минут и при комнатной температуре в течение 2–3 часов, затем распределяли между насыщенным водным раствором бикарбоната натрия и пентаном (10 мл и 20 мл/ммоль кетона соответственно). Водную фазу дважды промывали пентаном. Объединенный экстракт промывали четыре раза насыщенным водным раствором бикарбоната натрия и дважды рассолом , а затем сушили ( MgSO 4 ). Удаление растворителя с последующей перегонкой оставшегося масла по принципу «колба к колбе» дало соответствующий результат. эфир силиленола в виде бесцветного масла, которое не проявляло поглощения карбонильных напряжений в ИК-диапазоне. Термолиз эфира силилинола осуществляли нагреванием (чистая атмосфера аргона) при 230° (температура воздушной бани) в течение 30–60 мин. Прямая перегонка (140–150°/12 Торр) полученных веществ позволила получить циклогептадиен с выходом 85%: ИК (пленка) 1660, 1260, 840 см–1; 1H ЯМР ( CDCl3 ) δ 0,09 (с, 6H ), 0,88 (с, 9H), 0,7–2,75 (м, 14H), 4,8 (т, 1H, J = 5,5 Гц), 5,5–5,9 (м, 2H) . [21]
Ссылки
[ редактировать ]- ^ Хадлики, Т.; Фан, Р.; Рид, Дж.В.; Гадамасетти, КГ Орг. Реагировать. 1992 , 41 , 1-133. два : 10.1002/0471264180.or041.01
- ^ Фогель, Э. Ангью. хим. 1960 , 72 , 4.
- ^ Вендер, Пенсильвания; Эйсенштат, Массачусетс; Филоса, член парламента Дж. Ам. хим. Бревно. 1979 , 101 , 2196.
- ^ Арай, М.; Кроуфорд, Р.Дж. Кан. Дж. Хим. 1972 , 50 , 2158.
- ^ Болдуин, Дж. Э.; Флеминг, Р. Х. Дж. Ам. хим. Соц. 1973 , 95 , 5256.
- ^ Алкок, Северо-Запад; Браун, Дж. М.; Коннили, Дж. А.; Стофко-младший, JJ J. Chem. Соц., хим. Коммун. , 1975 , 234.
- ^ Брюле, Д.; Чалчат, JC; Весьер, Р. Булл. Соц. хим. , 1978 г. № 7-8 , II-385.
- ^ Перейти обратно: а б Вендер, Пенсильвания; Филоса, член парламента J. Org. хим. 1976 , 41 , 3490.
- ^ Марино, JP; Браун, LJ Tetrahedron Lett. 1976 , 3245.
- ^ Перейти обратно: а б Мюллер, П.; Рей, М. Хелв. Хим. Акта , 1982 , 65 , 1191.
- ^ Хадлики, Т.; Рулин, Ф.; Лавлейс, Т.; Рид, Дж.В., « Исследования по химии натуральных продуктов» , Атта-ур-Рахман, редактор, Elsevier, Амстердам, 1989, часть B, стр. 3.
- ^ Дэвис, HML; Кларк, DM; Смит, Т. К. Тетраэдр Летт. 1985 , 26 , 5659.
- ^ Поммлет, JC; Манисс, Н.; Чуч, Дж. Тетраэдр , 1972 , 28 , 3929.
- ^ Браун, RA J. Org. хим. 1963 , 28 , 1383.
- ^ Эбербах, В.; Розер, Дж. Тетраэдр Летт. 1987 , 28 , 2685.
- ^ Манисс, Н.; Чуч, Дж. Тетраэдр , 1977 , 33 , 2399.
- ^ Байер, А. Бер. 1894 , 27 , 810; там же. 1898 , 31 , 2067.
- ^ Фогель, Э.; Отт, К.-Х.; Гайек, К. Юстус Либигс Энн. хим. 1961 , 644 , 172.
- ^ Шрайбер, Дж.; Леймгрубер, В.; Пезаро, М.; Шудель, П.; Трелфолл, Т.; Эшенмозер, А. Хельв. Акта 1961 , 44 , 540.
- ^ Янике, Л.; Акинтоби, Т.; Мюллер, Д.Г. Ангью. хим. Межд. Эд. англ. 1971 , 10 , 492.
- ^ Пирс, Э.; Бурмейстер, М.С.; Рейссиг, Х.У. Кан. Дж. Хим. 1986, 64 , 180.