Хлорметилирование Блана
| Хлорметилирование Блана | |
|---|---|
| Назван в честь | Гюстав Луи Блан |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | Блан-реакция |
Хлорметилирование Блана (также называемое реакцией Блана ) представляет собой химическую реакцию ароматических колец с формальдегидом и хлористым водородом с образованием хлорметиларенов. Реакция катализируется кислотами Льюиса, такими как хлорид цинка . [1] Реакцию открыл Гюстав Луи Блан (1872-1927) в 1923 году. [2] [3]
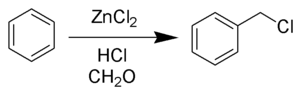
Механизм и сфера применения
[ редактировать ]Реакцию проводят в кислых условиях и с использованием катализатора ZnCl 2 . В этих условиях карбонил формальдегида протонируется, что делает углерод гораздо более электрофильным. Затем альдегид подвергается атаке ароматических пи-электронов с последующей реароматизацией ароматического кольца. Образовавшийся таким образом бензиловый спирт в условиях реакции быстро превращается в хлорид.

Другие возможности электрофила включают катион (хлорметил) оксония (ClH 2 C–OH 2 + ) или катион хлоркарбения (ClCH 2 + ), который может образовываться в присутствии хлорида цинка. [4] Эти виды могут объяснить тот факт, что умеренно и сильно дезактивированные субстраты, инертные к реакциям Фриделя-Крафтса, такие как ацетофенон, нитробензол и п -хлорнитробензол, [5] действительно демонстрируют предельную реакционную способность и ограниченную синтетическую применимость в условиях хлорметилирования. [6] Дезактивированные субстраты дают лучшие результаты в модифицированных условиях хлорметилирования с использованием хлорметилметилового эфира (МОМСl) в присутствии 60% H 2 SO 4 . [4]
Высокоактивированные арены, такие как фенолы и анилины, не являются подходящими субстратами, поскольку они подвергаются дальнейшей электрофильной атаке за счет алкилирования по Фриделю-Крафтсу с образованием бензилового спирта/хлорида неконтролируемым образом. В общем, образование побочного продукта диарилметана является обычным результатом. [6]
Хотя реакция является эффективным способом введения хлорметильной группы, производство небольших количеств высококанцерогенного бис(хлорметилового) эфира является недостатком для промышленного применения.
Соответствующие реакции фторметилирования, бромметилирования и иодометилирования также можно осуществить с использованием соответствующей галоидоводородной кислоты. [7]
Родственные хлорметилирования
[ редактировать ]Хлорметилирование тиолов можно осуществить концентрированной HCl и формальдегидом: [8]
- ArSH + CH 2 O + HCl → ArSCH 2 Cl + H 2 O
Хлорметилирование также можно осуществить с использованием хлорметилметилового эфира:
- ArH + CH 3 OCH 2 Cl → ArCH 2 Cl + CH 3 OH
Эта реакция используется при хлорметилировании стирола в производстве ионообменных смол и смол Меррифилда . [9]
Дополнительное чтение
[ редактировать ]- Уитмор, ФК; Гинзбург, Абрам; Рюггеберг, Вальтер; Тарп, И.; Нотторф, Х.; Кэннон, М.; Карнахан, Ф.; Крайдер, Д.; ФЛеминг, Г.; Гольдберг, Г.; Хаггард, Х.; Герр, К.; Гувер, Т.; Ловелл, Х.; Мраз, Р.; Нолл, К.; Оквуд, Т.; Паттерсон, Х.; Ван Стрин, Р.; Уолтер, Р.; Зук, Х.; Вагнер, Р.; Вайсгербер, К.; Уилкинс, Дж. (май 1946 г.). «Производство бензилхлорида хлорметилированием бензола. Лабораторные и опытно-промышленные исследования». Промышленная и инженерная химия . 38 (5): 478–485. дои : 10.1021/ie50437a013 .
Безопасность
[ редактировать ]Реакцию проводят с осторожностью, поскольку, как и в большинстве реакций хлорметилирования, образуется высококанцерогенный бис(хлорметиловый) эфир в качестве побочного продукта .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Беленький Леонид I; Волькенштейн Ю Б; Карманова, И.Б. (30 сентября 1977 г.). «Новые данные по хлорметилированию ароматических и гетероароматических соединений». Российское химическое обозрение . 46 (9): 891–903. Бибкод : 1977RuCRv..46..891B . дои : 10.1070/RC1977v046n09ABEH002180 . S2CID 250898192 .
- ^ Уайт, Гюстав Луи (1923). «О получении ароматических производных хлорметилена» . Бюллетень Французского химического общества . Серия 4. 33 : 313–319.
- ^ Грасси, Дж.; Маселли, К. (1898). «О некоторых хлорпроизводных 1,3,5-триоксана». Итальянский химический журнал . 28 (ч. 2): 477–500 [495].
- ^ Jump up to: а б Лаали, Кеннет К. (2001). «Формальдегид-хлорид водорода». Энциклопедия реагентов для органического синтеза . Американское онкологическое общество. дои : 10.1002/047084289x.rf022 . ISBN 978-0-470-84289-8 .
- ^ Кензо, Сиракава; Тайдзо, Мацукава (25 января 1950 г.) «Хлорметилирование бензольного ядра II» ( doi на японском языке). ( 1): 25–28. : 10.1248 / . yakushi1947.70.1_25 70 -6903 .
- ^ Jump up to: а б Маккивер, Швейцария; Фьюсон, Рейнольд К. (15 марта 2011 г.). «Хлорметилирование ароматических соединений». Органические реакции . Американское онкологическое общество. стр. 63–90. дои : 10.1002/0471264180.или001.03 . ISBN 978-0-471-26418-7 .
- ^ К., Норман, Ричард О. (2017). Принципы органического синтеза . Коксон, Джеймс М. (3-е изд.). Бока-Ратон: Рутледж. ISBN 978-1-351-42173-7 . OCLC 1042320639 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Д. Эндерс; С. фон Берг; Б. Янделейт (2002). «Диэтил[(фенилсульфонил)метил]фосфонат». Органические синтезы . 78 : 169. дои : 10.15227/orgsyn.078.0169 .
- ^ Дардель, Франсуа; Арден, Томас В. (2008). «Ионообменники». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a14_393.pub2 . ISBN 978-3527306732 .