Более короткая перестановка
| Более короткая перестановка | |
|---|---|
| Назван в честь | Теодор Курций |
| Тип реакции | Реакция перегруппировки |
| Идентификаторы | |
| Портал органической химии | более короткая перестановка |
| RSC Идентификатор онтологии | RXNO: 0000054 |
Перегруппировка Курциуса (или реакция Курциуса или деградация Курциуса ), впервые определенная Теодором Курциусом в 1885 году, представляет собой разложение ацилазида термическое до изоцианата с потерей газообразного азота. [1] [2] Затем изоцианат подвергается атаке различных нуклеофилов, таких как вода, спирты и амины , с образованием первичного амина, карбамата или производного мочевины соответственно. [3] Опубликовано несколько обзоров. [4] [5]

Получение ацилазида
[ редактировать ]
Ацилазид обычно получают реакцией хлорангидридов или ангидридов кислот. [6] с азидом натрия [7] или триметилсилилазид . [8] Ацилазиды получают также обработкой ацилгидразинов кислотой азотистой . [9] Альтернативно ацилазид может быть получен прямой реакцией карбоновой кислоты с дифенилфосфорилазидом (DPPA). [10] [11]

Механизм реакции
[ редактировать ]Считалось, что перегруппировка Курциуса представляет собой двухстадийный процесс с потерей газообразного азота с образованием ацилнитрена с последующей миграцией R-группы с образованием изоцианата . Однако недавние исследования показали, что термическое разложение представляет собой согласованный процесс . [12] причем обе стадии происходят одновременно из-за отсутствия каких-либо побочных продуктов внедрения нитрена или присоединения, наблюдаемых или выделяемых в реакции. [13] Термодинамические расчеты также подтверждают согласованный механизм. [14]
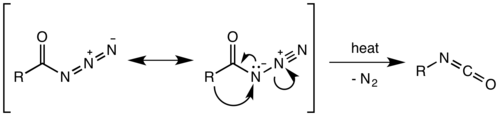
Миграция происходит с полным сохранением конфигурации в R-группе. Способность к миграции R-группы примерно третичная > вторичная ~ арил > первичная. Образовавшийся изоцианат затем может быть гидролизован с образованием первичного амина или подвергнут нуклеофильной атаке спиртами соответственно и аминами с образованием карбаматов и производных мочевины .
Модификации
[ редактировать ]Исследования показали, что перегруппировка Курциуса катализируется как Бренстедом, так и [15] и кислоты Льюиса посредством протонирования или координации ацильного атома кислорода соответственно. Например, Фар и Нейман показали, что использование катализатора трифторида бора или трихлорида бора снижает температуру разложения, необходимую для перегруппировки, примерно на 100 ° C и значительно увеличивает выход изоцианата. [16]
Фотохимическая перегруппировка
[ редактировать ]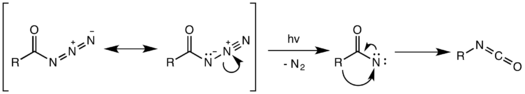
Возможно также фотохимическое разложение ацилазида. [17] Однако фотохимическая перегруппировка не является согласованной и вместо этого происходит с помощью промежуточного нитрена , образующегося в результате разрыва слабой связи N–N и потери газообразного азота. Высокореактивный нитрен может подвергаться различным нитреновым реакциям, таким как внедрение и присоединение нитрена , с образованием нежелательных побочных продуктов. [18] В приведенном ниже примере нитреновое промежуточное соединение вставляется в одну из связей C–H циклогексанового растворителя с образованием N-циклогексилбензамида в качестве побочного продукта.

Вариации
[ редактировать ]Дарапская деградация
[ редактировать ]В одном варианте, называемом деградацией Дарапского , [19] или синтез Дарапского , перегруппировка Курциуса происходит как одна из стадий превращения α-цианоэфира в аминокислоту . Гидразин используется для превращения сложного эфира в ацилгидразин , который вступает в реакцию с азотистой кислотой с образованием ацилазида. При нагревании азида в этаноле образуется этилкарбамат в результате перегруппировки Курциуса . Кислотный гидролиз дает одновременно амин из карбамата и карбоновую кислоту из нитрила, в результате чего образуется аминокислота. [20]

Реакция Харгера
[ редактировать ]Фотохимическая миграция и перегруппировка фосфинового азида по типу Курциуса образуют метафосфонимидат. [21] в так называемой реакции Харгера (названной в честь доктора Мартина Харгера из Университета Лестера ). [22] За этим следует гидролиз метанолом в приведенном ниже примере с получением фосфонамидата.

В отличие от перегруппировки Курциуса, в фосфиновом азиде существует выбор R-групп, которые могут мигрировать. Харгер обнаружил, что алкильные группы преимущественно мигрируют к арильным группам, и это предпочтение увеличивается в порядке метил < первичный < вторичный < третичный. Вероятно, это связано со стерическими и конформационными факторами: чем крупнее R-группа, тем менее благоприятна конформация для миграции фенила. [23]
Синтетические приложения
[ редактировать ]Перегруппировка Курциуса толерантна к большому разнообразию функциональных групп и имеет значительную синтетическую полезность, поскольку в зависимости от выбора нуклеофила, используемого для атаки изоцианата, может быть включено множество различных групп.
Например, если реакция проводится в присутствии трет -бутанола , в результате реакции образуются Boc - защищенные амины, полезные промежуточные соединения в органическом синтезе . [24] [25] Аналогичным образом, когда реакция Куртиуса проводится в присутствии бензилового спирта , Cbz -защищенные амины. образуются [26]
Трихинацен
[ редактировать ]Р.Б. Вудворд и др. использовал перегруппировку Курциуса как одну из стадий полного синтеза полихинантрихинацена 2 в 1964 году. После гидролиза сложного эфира в промежуточном продукте ( 1 ) была проведена перегруппировка Курциуса для превращения групп карбоновой кислоты в ( ) в метильные группы. карбаматные группы ( 3 ) с выходом 84%. Дальнейшие действия дали трихинацен ( 4 ). [27]

Осельтамивир
[ редактировать ]При синтезе противовирусного препарата осельтамивира , также известного как Тамифлю, Исикава и др. использовали перегруппировку Курциуса на одном из ключевых этапов превращения ацилазида в амидную группу в целевой молекуле. В этом случае изоцианат, образовавшийся в результате перегруппировки, подвергается воздействию карбоновой кислоты с образованием амида. Все последующие реакции можно было проводить в одном и том же реакционном сосуде с получением конечного продукта с общим выходом 57%. Важным преимуществом реакции Курциуса, подчеркнутым авторами, было то, что ее можно было проводить при комнатной температуре, что сводит к минимуму опасность нагревания. В целом схема была очень эффективной: для производства этого важного и ценного препарата, используемого для лечения птичьего гриппа , потребовалось всего три операции «в одном котле» . [28]

Диеводиамин
[ редактировать ]Диеводиамин – натуральный продукт растения Euodia ruticarpa , который широко используется в традиционной китайской медицине . предложенный Унсвортом и др., Полный синтез диеводиамина без защитных групп, использует перегруппировку Курциуса на первой стадии синтеза, катализируемого трифторидом бора . Затем активированный изоцианат быстро реагирует с индольным кольцом в реакции электрофильного ароматического замещения с образованием амида с выходом 94%, а последующие стадии дают диводамин. [29]

См. также
[ редактировать ]- Перегруппировка Бекмана
- Деградация Бергмана
- Перегруппировка Гофмана
- Свободная перестановка
- реакция Шмидта
- Перегруппировка Тимана
- Перегруппировка Небера
- Перегруппировка Вольфа
Ссылки
[ редактировать ]- ^ Курций, Т. (1890). «О H » азотистоводородной кислоте (азоимиде) N 3 . Отчеты Немецкого химического общества в Берлине . 23 (2): 3023–3033. дои : 10.1002/cber.189002302232 .
- ^ Курций, Т. (1894). «20. Гидразиды и азиды органических кислот I. Бумага» [Гидразиды и азиды органических кислот I. Бумага]. Журнал практической химии . 50 : 275–294. дои : 10.1002/prac.18940500125 .
- ^ Кайзер, К.; Вайншток, Дж. (1988). «Амины из смешанных карбоксильно-угольных ангидридов: 1-фенилциклопентиламин» . Органические синтезы ; Сборник томов , т. 6, с. 910 .
- ^ Смит, ПАС (1946). «Реакция Курциуса». Органические реакции . 3 : 337–449.
- ^ Скривен, Эрик Ф.В.; Тернбулл, Кеннет (1988). «Азиды: их получение и синтетическое использование». Химические обзоры . 88 (2): 297–368. дои : 10.1021/cr00084a001 .
- ^ Вайншток, Дж (1961). «Модифицированная реакция Курциуса». Дж. Орг. Хим . 26 : 3511. дои : 10.1021/jo01067a604 .
- ^ Кэри, Фрэнсис А.; Сундберг, Ричард Дж. (2007). Продвинутая органическая химия: Часть B: Реакции и синтез (5-е изд.). Нью-Йорк: Спрингер. п. 948. ИСБН 978-0387683546 .
- ^ Уоррен, доктор юридических наук; Пресс, Дж. Б. (1980). «Образование и перегруппировка Курциуса ацилазидов из нереакционноспособных хлорангидридов». Синтез. Коммун . 10 : 107–110. дои : 10.1080/00397918008061812 .
- ^ Позгай, В.; Дженнингс, HJ (1987). «Синтез азидов со стабильными нитрозильными солями». Тетраэдр Летт . 28 (43): 5091–5092. дои : 10.1016/s0040-4039(00)95598-9 .
- ^ Сиойри, Т.; Ниномия, К.; Ямада, С. (1972). «Новый удобный реагент для модифицированной реакции Курциуса и синтеза пептидов». Дж. Ам. хим. Соц . 94 (17): 6203–6205. дои : 10.1021/ja00772a052 . ПМИД 5054412 .
- ^ Кэри, Фрэнсис А.; Сундберг, Ричард Дж. (2007). Продвинутая органическая химия: Часть B: Реакции и синтез (5-е изд.). Нью-Йорк: Спрингер. п. 948. ИСБН 978-0387683546 .
- ^ Кэри, Фрэнсис А.; Сундберг, Ричард Дж. (2007). Продвинутая органическая химия: Часть B: Реакции и синтез (5-е изд.). Нью-Йорк: Спрингер. п. 948. ИСБН 978-0387683546 .
- ^ Раук, А.; Алевуд, ПФ (1977). «Теоретическое исследование перегруппировки Курциуса. Электронные структуры и взаимопревращение разновидностей CHNO». Может. Дж. Чем . 55 (9): 1498–1510. дои : 10.1139/v77-209 .
- ^ Л'Аббе, Г. (1969). «Реакции разложения и присоединения органических азидов». хим. Преподобный . 69 (3): 345–363. дои : 10.1021/cr60259a004 .
- ^ Юкава, Ю.; Цуно, Ю. (1959). «Разложение замещенных бензидов в кислых растворителях, кислотный катализ». Дж. Ам. хим. Соц . 81 : 2007–2012. дои : 10.1021/ja01517a055 .
- ^ Водить машину.; Нойманн, Л. (1965). «Реакция Курциуса с тригалогенидами бора». Энджью. Хим . 77 (13): 591. Бибкод : 1965АнгЧ..77..591Ф . дои : 10.1002/anie.19650771308 .
- ^ Вентрап, К.; Борнеманн, Х. (2005). «Возврат к перегруппировке Курциуса ацилазидов - образование цианата». Евро. Дж. Орг. хим. : 4521–4524. дои : 10.1002/ejoc.200500545 .
- ^ Эйблер, Э.; Зауэр, Дж. (1974). «Вклад в образование изоцианата при фотолизе ацилазидов». Тетраэдр Летт . 15 (30): 2569–2572. дои : 10.1016/s0040-4039(01)92295-6 .
- ^ Август Дарапский (1936) «Получение α-аминокислот из алкилцианоуксусных кислот» (Получение α-аминокислот из алкилцианоуксусных кислот), Journal für Practice Chemistry , 146 : 250-267.
- ^ Ганьон, ЧП; Бовин, Пенсильвания; Крейг, HM (1951). «Синтез аминокислот из замещенных эфиров цианоуксусной кислоты» . Может. Дж. Чем . 29 : 70–75. дои : 10.1139/cjc-29-1-70 .
- ^ Бертран, Г.; Майораль, Дж.; Басейредо, А. (1980). «Фотолитическая перегруппировка азида фосфора: свидетельства временного метафосфонимидата». Тетраэдр Летт . 21 (52): 5015–5018. дои : 10.1016/s0040-4039(00)71119-1 .
- ^ Харгер, MJP; Вестлейк, С. (1982). «Фотолиз некоторых несимметричных фосфиназидов в метаноле». Тетраэдр . 38 (20): 3073–3078. дои : 10.1016/0040-4020(82)80195-6 .
- ^ Харгер, MJP; Вестлейк, С. (1982). «Фотолиз некоторых несимметричных фосфиназидов в метаноле». Тетраэдр . 38 (20): 3073–3078. дои : 10.1016/0040-4020(82)80195-6 .
- ^ Ам Энде, Дэвид Дж.; Деврис, Кейт М.; Клиффорд, Памела Дж.; Бренек, Стивен Дж. (1998). «Колориметрическое исследование по безопасному увеличению перегруппировки Курциуса акрилоилазида». Исследования и разработки органических процессов . 2 (6): 382–392. дои : 10.1021/op970115w .
- ^ Лебель, Х.; Леоган, О. (2005). «Boc-защищенные амины посредством мягкой и эффективной перегруппировки Курциуса в одном реакторе». Органические письма . 7 (19): 4107–4110. дои : 10.1021/ol051428b . ПМИД 16146363 .
- ^ Джессап, Пи Джей; Петти, CB; Роос, Дж.; Оверман, Л.Е. (1988). «1- N -Ациламино-1,3-диены из 2,4-пентадиеновых кислот перегруппировкой Курциуса: бензил- транс -1,3-бутадиен-1-карбамат» . Органические синтезы ; Сборник томов , т. 6, с. 95 .
- ^ Вудворд, РБ; Фукунага, Т.; Келли, RC (1964). «Трихинацен». Дж. Ам. хим. Соц . 86 (15): 3162–3164. дои : 10.1021/ja01069a046 .
- ^ Исикава, Х.; Сузуки, Т.; Хаяши, Ю. (2009). «Высокопродуктивный синтез противогриппозного ингибитора нейрамидазы (-)-осельтамивира тремя операциями «в одном горшке». Энджью. хим. Межд. Эд . 48 (7): 1304–1307. дои : 10.1002/anie.200804883 . ПМИД 19123206 .
- ^ Ансворт, Уильям П.; Кициу, Кристиана; Тейлор, Ричард Дж. К. (5 июля 2013 г.). «Целесообразное полное синтезирование (±)-диеводиамина без защитных групп». Органические письма . 15 (13): 3302–3305. дои : 10.1021/ol4013469 . ПМИД 23786450 .