Реакция Уги
| Реакция Уги | |
|---|---|
| Назван в честь | Ивар Карл Уги |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | уги-реакция |
| RSC Идентификатор онтологии | RXNO: 0000129 |
В органической химии реакция Уги представляет собой многокомпонентную реакцию, в которой участвуют кетон или альдегид , амин , изоцианид и карбоновая кислота с образованием бисамида . [1] [2] [3] [4] Реакция названа в честь Ивара Карла Уги , который впервые сообщил об этой реакции в 1959 году.

Реакция Уги является экзотермической и обычно завершается в течение нескольких минут после добавления изоцианида. Высокая концентрация (0,5–2,0 М) реагентов дает самые высокие выходы. Хорошо подходят полярные апротонные растворители , такие как ДМФ . Однако метанол и этанол также успешно используются. Этой некатализируемой реакции свойственна высокая атомная экономичность , поскольку теряется только молекула воды, а химический выход в целом высок. Опубликовано несколько обзоров. [5] [6] [7] [8] [9] [10] [11] [12] [ чрезмерное цитирование ]
Поскольку продукты реакции являются потенциальными миметиками белков, было предпринято множество попыток разработать энантиоселективную реакцию Уги. [13] первый успешный отчет которого состоялся в 2018 году. [14]
Механизм реакции
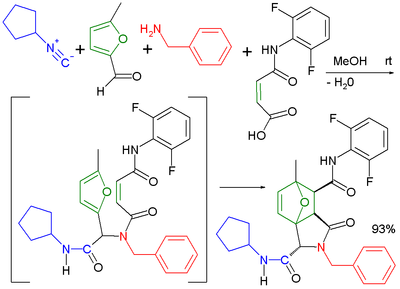
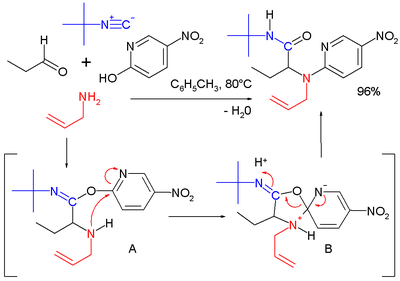
[ редактировать ]Один из возможных механизмов реакции изображен ниже: [15]

Амин 1 и кетон 2 образуют имин 3 с потерей одного эквивалента воды. Обмен протона с карбоновой кислотой 4 активирует иминий -ион 5 для нуклеофильного присоединения изоцианида 6 с его концевым атомом углерода к нитрилия иону 7 . Второе нуклеофильное присоединение происходит по этому интермедиату с анионом карбоновой кислоты к 8 . Завершающим этапом является перегруппировка Мумма с переносом ацильной группы R4 от кислорода к азоту. Все стадии реакции обратимы, за исключением перегруппировки Мумма, которая управляет всей последовательностью реакции.
В родственной реакции Пассерини (без амина) изоцианид реагирует непосредственно с карбонильной группой, но другие аспекты реакции такие же. Эта реакция может протекать одновременно с реакцией Уги, выступая источником примесей.
Вариации
[ редактировать ]Комбинация компонентов реакции
[ редактировать ]Использование бифункциональных компонентов реакции значительно увеличивает разнообразие возможных продуктов реакции. Аналогичным образом, несколько комбинаций приводят к созданию структурно интересных продуктов. Реакция Уги применялась в сочетании с внутримолекулярной реакцией Дильса-Альдера. [16] в расширенной многостадийной реакции.
Самостоятельная реакция представляет собой реакцию Уги-Смайлса, в которой компонент карбоновой кислоты заменен фенолом . В этой реакции перегруппировка Мумма на последней стадии заменяется перегруппировкой Смайлса . [17]
 |  | |
| Реакция Уги-Дильса-Альдера | Реакция Уги-Смайлса |
Другая комбинация (с отдельной обработкой промежуточного продукта Уги) представляет собой реакцию Бухвальда-Хартвига . [18] В реакции Уги-Хека . арил-ариловое сочетание Хека на второй стадии происходит [19]
 |  | |
| Реакция Уги – Бухвальда – Хартвига [20] | Реакция Уги-Хека [21] |
Комбинация амина и карбоновой кислоты
[ редактировать ]Несколько групп использовали β-аминокислоты в реакции Уги для получения β-лактамов. [22] Этот подход основан на переносе ацила при перегруппировке Мумма с образованием четырехчленного кольца. Реакция протекает с умеренным выходом при комнатной температуре в метаноле с формальдегидом или различными арилальдегидами. Например, п- нитробензальдегид реагирует с образованием β-лактама с выходом 71% в виде диастереомерной смеси 4:1 :

Комбинация карбонильного соединения и карбоновой кислоты
[ редактировать ]Чжан и др. [23] соединили альдегиды с карбоновыми кислотами и использовали реакцию Уги для создания лактамов различных размеров. Шорт и др. [24] получили γ-лактамы из кетокислот на твердом носителе.
Приложения
[ редактировать ]Химические библиотеки
[ редактировать ]Реакция Уги — одна из первых реакций, которая была использована специально для создания химических библиотек. Эти химические библиотеки представляют собой наборы соединений, которые можно тестировать повторно. Используя принципы комбинаторной химии , реакция Уги дает возможность синтезировать большое количество соединений за одну реакцию путем реакции различных кетонов (или альдегидов), аминов, изоцианидов и карбоновых кислот. Эти библиотеки затем можно протестировать с помощью ферментов или живых организмов для поиска новых активных фармацевтических веществ. Одним из недостатков является отсутствие химического разнообразия продуктов. Использование реакции Уги в сочетании с другими реакциями увеличивает химическое разнообразие возможных продуктов.Недавно был сделан прорыв в области ковалентных органических каркасов (COF), где реакция Уги используется для введения различных функциональных элементов в COF путем постсинтетической модификации. [25] Считается, что с помощью этой новой многообещающей стратегии можно подготовить библиотеку COF с полезными функциональными дескрипторами для различных важных приложений. Как предполагалось, недавно ручки дигликолевой кислоты (DGA) были включены в COF для разработки наиболее известного твердого адсорбента для неодима (редкоземельного элемента и критического материала), который имеет быструю кинетику сорбции и легко перерабатывается. [26]
Примеры комбинаций реакций Уги:
- Изохинолины в реакциях Уги и Хека . [27]
Фармацевтическая промышленность
[ редактировать ]Криксиван можно получить с помощью реакции Уги. [28]
многие анестетики каинового Кроме того, с помощью этой реакции синтезируются типа. Примеры включают лидокаин и бупивакаин .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Уги И, Мейр Р., Фетцер У., Штайнбрюкнер К. (1959). «Опыты с изонитрилами». Энджью. Chem. 71 (11): 386. doi : 10.1002/anie.19590711110 .
- ^ Уги I, Штайнбрюкнер С (1960). «О новом принципе конденсации». Энджью. Хим. 72 (7–8): 267–268. Бибкод : 1960АнгЧ..72..267У . дои : 10.1002/anie.19600720709 .
- ^ Уги, И. (1962). «А-присоединение ионов и анионов иммония к изонитрилам, сопровождаемое вторичными реакциями». Angewandte Chemie International Edition на английском языке . 1 (1): 8–21. дои : 10.1002/anie.196200081 .
- ^ Болтьес А, Лю Х, Лю Х, Дёмлинг А (2017). «Многокомпонентная реакция Уги» . Орг. Синтез . 94 : 54–65. дои : 10.15227/orgsyn.094.0054 .
- ^ Триполитсиотис, Николаос П.; Томаиди, Мария; Неохорит, Константинос Г. (15 ноября 2020 г.). «Трёхкомпонентная реакция Уги: ценный инструмент в современном органическом синтезе» . Европейский журнал органической химии . 2020 (42): 6525–6554. дои : 10.1002/ejoc.202001157 . ISSN 1434-193Х . S2CID 224890321 .
- ^ Уги И., Лобергер С., Карл Р. (1991). «Реакции Пассерини и Уги». Комплексный органический синтез . Том. 2. Оксфорд: Пергам. стр. 1083–1109. ISBN 0-08-040593-2 .
- ^ Уги И, Вернер Б, Дёмлинг А (2003). «Химия изоцианидов, их многокомпонентные реакции и их библиотеки» (PDF) . Молекулы . 8 : 53–66. дои : 10.3390/80100053 . S2CID 53949436 .
- ^ Банфи Л., Рива Р. (2005). «Реакция Пассерини». В Овермане Л.Е. (ред.). Органические реакции . Том. 65. Уайли. ISBN 0-471-68260-8 . )
- ^ Темпест, Пенсильвания (ноябрь 2005 г.). «Последние достижения в производстве гетероциклов с использованием эффективной реакции многокомпонентной конденсации Уги». Текущее мнение об открытии и разработке лекарств . 8 (6): 776–88. ПМИД 16312152 .
- ^ Уги И., Хек С. (февраль 2001 г.). «Многокомпонентные реакции и их библиотеки для естественной и препаративной химии». Комбинаторная химия и высокопроизводительный скрининг . 4 (1): 1–34. дои : 10.2174/1386207013331291 . ПМИД 11281825 .
- ^ Бьенейм Х., Халм С., Оддон Дж., Шмитт П. (сентябрь 2000 г.). «Максимизация синтетической эффективности: многокомпонентные преобразования лидируют» . Химия: Европейский журнал . 6 (18): 3321–9. doi : 10.1002/1521-3765(20000915)6:18<3321::AID-CHEM3321>3.0.CO;2-A . ПМИД 11039522 .
- ^ Дёмлинг А., Уги I (сентябрь 2000 г.). «Многокомпонентные реакции с изоцианидами». Ангеванде Хеми . 39 (18): 3168–3210. doi : 10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U . ПМИД 11028061 .
- ^ Ван Ц, Ван DX, Ван MX, Чжу Дж (май 2018 г.). «Все еще непокоренные: энантиоселективные многокомпонентные реакции Пассерини и Уги». Отчеты о химических исследованиях . 51 (5): 1290–1300. дои : 10.1021/acs.accounts.8b00105 . ПМИД 29708723 .
- ^ Чжан Дж., Ю П., Ли С.Ю., Сунь Х., Сян Ш., Ван Дж.Дж. и др. (сентябрь 2018 г.). «Четырехкомпонентная реакция Уги, катализируемая асимметричной фосфорной кислотой» . Наука . 361 (6407): eaas8707. дои : 10.1126/science.aas8707 . ПМИД 30213886 .
- ^ Дания SE, Fan Y (ноябрь 2005 г.). «Каталитическое, энантиоселективное альфа-присоединение изоцианидов: реакции типа Пассерини, катализируемые основанием Льюиса». Журнал органической химии . 70 (24): 9667–76. дои : 10.1021/jo050549m . ПМИД 16292793 .
- ^ Ильин А, Кисиль В, Красавин М, Курашвили И, Иващенко А.В. (декабрь 2006 г.). «Повышающая сложность кислотная перегруппировка трициклических продуктов тандемной реакции Уги 4CC/внутримолекулярная реакция Дильса-Альдера». Журнал органической химии . 71 (25): 9544–7. дои : 10.1021/jo061825f . ПМИД 17137394 .
- ^ Эль Каим Л., Жизолм М., Гримо Л., Обле Дж. (август 2006 г.). «Прямой доступ к гетероциклическим каркасам с помощью новых многокомпонентных муфт Уги-Смайлса». Органические письма . 8 (18): 4019–21. дои : 10.1021/ol061605o . ПМИД 16928063 .
- ^ Боннатер Ф., Буа-Шусси М., Жу Дж. (сентябрь 2006 г.). «Быстрый доступ к оксиндолам за счет комбинированного использования четырехкомпонентной реакции Уги и внутримолекулярной реакции амидирования Бухвальда-Хартвига с помощью микроволнового излучения». Органические письма . 8 (19): 4351–4. дои : 10.1021/ol061755z . ПМИД 16956224 .
- ^ Ма З, Сян З, Луо Т, Лу К, Сюй З, Чен Дж, Ян З (2006). «Синтез функционализированных хинолинов посредством реакций внутримолекулярного арилирования, катализируемых Ugi и Pd». Журнал комбинаторной химии . 8 (5): 696–704. дои : 10.1021/cc060066b . ПМИД 16961408 .
- ^ Вторая часть реакции, ускоренной микроволновым излучением , с Pd(dba) 2 и фосфиновым лигандом Me-Phos
- ^ Стадия Хека происходит с ацетатом палладия (II) , dppf с лигандом карбонатом калия и бромидом тетра-н-бутиламмония в диметилформамиде.
- ^ Гедей С., Ван дер Эйкен Дж., Фюлёп Ф. (май 2002 г.). «Жидкофазный комбинаторный синтез алициклических бета-лактамов посредством четырехкомпонентной реакции Уги». Органические письма . 4 (11): 1967–9. дои : 10.1021/ol025986r . ПМИД 12027659 .
- ^ Чжан Дж., Джейкобсон А., Руше Дж.Р., Херлихи В. (февраль 1999 г.). «Уникальные структуры, созданные реакциями Ugi 3CC с использованием бифункциональных исходных материалов, содержащих альдегид и карбоновую кислоту». Журнал органической химии . 64 (3): 1074–1076. дои : 10.1021/jo982192a . ПМИД 11674195 .
- ^ Короткий К.М., Мьялли А.М. (1997). «Твердофазный комбинаторный метод синтеза новых 5- и 6-членных кольцевых лактамов». Буквы тетраэдра . 38 (3): 359–362. дои : 10.1016/S0040-4039(96)02303-9 .
- ^ Волков А., Ми Дж., Лалит К., Чаттерджи П., Цзин Д., Карнахан С.Л., Чен Ю., Сунь С., Россини А.Дж., Хуан В., Стэнли Л.М. (март 2023 г.). «Общая стратегия включения ручек функциональных групп в ковалентные органические каркасы посредством реакции Уги». Журнал Американского химического общества . 145 (11): 6230–6239. дои : 10.1021/jacs.2c12440 . ПМИД 36892967 . S2CID 257425598 .
- ^ Чаттерджи, Пуранджан; Волков, Александр; Ми, Цзяшань; Ню, Минхуэй; Сунь, Симин; Россини, Аарон Дж.; Стэнли, Леви М.; Хуан, Вэньюй (11 июля 2024 г.). «Эффективный захват и высвобождение редкоземельного элемента неодима в водном растворе с помощью пригодных для вторичной переработки ковалентных органических каркасов» . Журнал Американского химического общества . дои : 10.1021/jacs.4c06609 .
- ^ Сян З, Луо Т, Лу К, Цуй Дж, Ши Х, Фатхи Р и др. (сентябрь 2004 г.). «Краткий синтез изохинолина с помощью реакций Уги и Хека». Органические письма . 6 (18): 3155–8. дои : 10.1021/ol048791n . ПМИД 15330611 .
- ^ Россен К., Пай П.Дж., ДиМишель Л.М., Воланте Р.П., Рейдер П.Дж. (1998). «Эффективный подход асимметричного гидрирования к синтезу промежуточного продукта криксивана пиперазина». Буквы тетраэдра . 39 (38): 6823–6826. дои : 10.1016/S0040-4039(98)01484-1 .