Диаграмма Уолша

Диаграммы Уолша , часто называемые диаграммами угловых координат или корреляционными диаграммами , представляют собой расчетные орбитальные энергии связи молекулы в зависимости от координаты искажения (углов связи), используемые для быстрого прогнозирования геометрии малых молекул. [1] [2] Диаграммы Уолша , изображающие изменение уровней молекулярных орбиталей молекулы в зависимости от геометрических изменений, объясняют, почему молекулы более стабильны в определенных пространственных конфигурациях (например, почему вода принимает изогнутую конформацию). [3]
Основное применение диаграмм Уолша заключается в объяснении закономерностей в структуре, наблюдаемых для родственных молекул, имеющих одинаковое количество валентных электронов (например, почему H 2 O и H 2 S выглядят одинаково), а также в объяснении того, как молекулы меняют свою геометрию в зависимости от количества их валентных электронов. электроны или спиновое состояние изменяются. Кроме того, диаграммы Уолша можно использовать для прогнозирования искажений молекулярной геометрии на основе знания того, как LUMO (самая низкая незанятая молекулярная орбиталь) влияет на HOMO (самая высокая занятая молекулярная орбиталь), когда молекула испытывает геометрические возмущения.
Правило Уолша для предсказания формы молекул гласит, что молекула примет структуру, которая лучше всего обеспечивает наибольшую стабильность ее ВЗМО. Если конкретное структурное изменение не нарушает ВЗМО, предпочтение геометрической ориентации определяется ближайшей занятой молекулярной орбиталью. [4]
История
[ редактировать ]Диаграммы Уолша были впервые представлены А. Д. Уолшем , британским профессором химии из Университета Данди , в серии из десяти статей в одном выпуске Журнала Химического общества . [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] Здесь он стремился рационализировать формы, принимаемые многоатомными молекулами в основном состоянии , а также в возбужденных состояниях , применяя теоретические вклады, сделанные Малликеном . В частности, Уолш рассчитал и объяснил влияние изменения формы молекулы на энергию молекулярных орбиталей. Диаграммы Уолша являются иллюстрацией такой зависимости, а его выводы называются «правилами Уолша». [15]
В своих публикациях Уолш на многочисленных примерах показал, что геометрия молекулы в ее основном состоянии в первую очередь зависит от количества ее валентных электронов. [16] Сам он признавал, что эта общая концепция не нова, но пояснял, что доступные ему новые данные позволяют расширить и отточить предыдущие обобщения. Он также отметил, что Малликен ранее пытался построить корреляционную диаграмму возможных орбиталей многоатомной молекулы в двух различных ядерных конфигурациях и даже пытался использовать эту диаграмму для объяснения формы и спектров молекул в их основном и возбужденном состояниях. [17] [18] Однако Малликен не смог объяснить причины подъемов и падений определенных кривых с увеличением угла, поэтому Уолш утверждал, что «его диаграмма была либо эмпирической, либо основана на неопубликованных вычислениях». [5]
Обзор
[ редактировать ]Первоначально Уолш построил свои диаграммы, отображая то, что он описал как «орбитальные энергии связи» в зависимости от валентных углов . Что на самом деле Уолш описывал этим термином, неясно; некоторые полагают, что на самом деле он имел в виду потенциалы ионизации , однако это остается темой споров. [19] В любом случае, общая концепция, которую он выдвинул, заключалась в том, что полная энергия молекулы равна сумме всех «орбитальных энергий связи» в этой молекуле. Следовательно, зная о стабилизации или дестабилизации каждой из орбиталей за счет изменения валентного угла молекулы, можно предсказать равновесный валентный угол для определенного состояния молекулы. Орбитали, которые взаимодействуют для стабилизации одной конфигурации (например, линейной), могут перекрываться или не перекрываться в другой конфигурации (например, изогнутой), таким образом, одна геометрия будет расчетно более стабильной, чем другая.
Обычно основные орбитали (1 для B, C, N, O, F и Ne) исключаются из диаграмм Уолша, поскольку они имеют настолько низкую энергию, что не претерпевают значительных изменений при изменении валентного угла. Рассматриваются только валентные орбитали. Однако следует иметь в виду, что часть валентных орбиталей часто оказывается незанятой.
Создание диаграмм Уолша
[ редактировать ]При составлении диаграммы Уолша сначала необходимо оптимизировать геометрию молекулы, например, с помощью метода Хартри-Фока (HF). [2] основного состояния для аппроксимации волновой функции и энергии основного состояния квантовой системы многих тел. [20] Затем выполняются одноточечные измерения энергии для ряда геометрий, смещенных от определенной выше равновесной геометрии. Одноточечные энергии (SPE) — это расчет поверхностей потенциальной энергии молекулы для определенного расположения атомов в этой молекуле. При проведении этих расчетов длины связей остаются постоянными (при равновесных значениях), и только валентный угол должен быть изменен по сравнению с его равновесным значением. Затем одноточечные вычисления для каждой геометрии можно построить в зависимости от валентного угла, чтобы получить репрезентативную диаграмму Уолша.
Структура диаграммы Уолша
[ редактировать ]
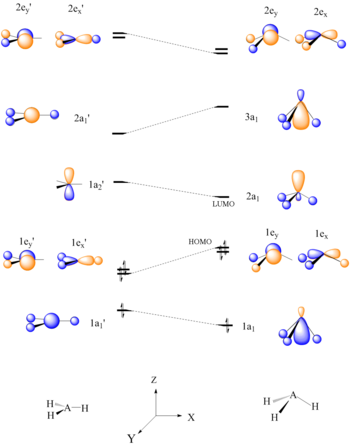
АН 2 Молекулы
[ редактировать ]Для простейшей молекулярной системы AH 2 Уолш построил первую диаграмму угловой корреляции, построив кривые орбитальной энергии ab initio для канонических молекулярных орбиталей при изменении валентного угла с 90 ° до 180 °. Поскольку валентный угол искажен, энергию каждой из орбиталей можно проследить вдоль линий, что позволяет быстро оценить молекулярную энергию как функцию конформации. До сих пор неясно, учитывает ли ордината Уолша ядерное отталкивание, и это остается темой споров. [21] Типичным результатом прогнозирования для воды является валентный угол 90°, что даже близко не соответствует экспериментальному значению 104°. В лучшем случае метод способен отличить изогнутую и линейную молекулу. [2]
Эту же концепцию можно применить к другим видам, включая негидридные молекулы AB 2 и BAC, молекулы HAB и HAAH, молекулы четырехатомного гидрида (AH 3 ), четырехатомные молекулы безгидрида (AB), H 2 молекулы AB, ацетальдегид , пятиатомные молекулы (CH3I). ), шестиатомные молекулы ( этилен ) и бензол .
Реактивность
[ редактировать ]Диаграммы Уолша в сочетании с теорией молекулярных орбиталей также могут использоваться как инструмент для прогнозирования реакционной способности. Создав диаграмму Уолша, а затем определив ВЗМО/НСМО этой молекулы, можно определить, как молекула может реагировать. В следующем примере кислотность Льюиса молекул AH 3 , таких как BH 3 и CH 3 + прогнозируется.
Шестиэлектронные молекулы АН 3 должны иметь плоскую конформацию. Видно, что ВЗМО, 1e' плоского AH 3 дестабилизируется при изгибе связей AH с образованием пирамидальной формы из-за разрушения связи. НСМО, сконцентрированная на одном атомном центре, является хорошим акцептором электронов и объясняет кислотный характер Льюиса BH 3 и CH 3. + . [22]
Корреляционные диаграммы Уолша также можно использовать для прогнозирования относительных уровней энергии молекулярных орбиталей . Искажение атомов водорода из плоского CH 3 + к тетраэдрическому CH 3 -Nu вызывает стабилизацию связующей орбитали C-Nu, σ. [22]
 |  |
Другие корреляционные диаграммы
[ редактировать ]Другими корреляционными диаграммами являются диаграммы Танабе-Сугано и диаграммы Оргеля .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Корреляционная диаграмма ». дои : 10.1351/goldbook.C01348
- ^ Jump up to: а б с Миллер Кэрри С. (2015). «Диаграммы Уолша: упражнение по вычислительной химии молекулярных орбиталей и структур для физической химии». Журнал химического образования . 92 : 1040–1043. дои : 10.1021/ed500813d .
- ^ Чен, Э.; Чанг, Т. (1998). «Диаграмма Уолша и линейная комбинация метода орбиталей связи». Журнал молекулярной структуры: THEOCHEM . 431 (1–2): 127–136. дои : 10.1016/S0166-1280(97)00432-6 .
- ^ Малликен, Р.С. (1955). «Структура молекул галогенов и прочность одинарных связей». Дж. Ам. хим. Соц. 77 (4): 884–887. дои : 10.1021/ja01609a020 .
- ^ Jump up to: а б Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть I. Молекулы AH 2 ». Дж. Хим. Соц. : 2260–2266. дои : 10.1039/JR9530002260 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть II. Молекулы AB 2 и BAC». Дж. Хим. Соц. : 2266–2288. дои : 10.1039/JR9530002266 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть III. Молекулы HAB и HAAH». Дж. Хим. Соц. : 2288–2296. дои : 10.1039/JR9530002288 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть IV. Молекулы четырехатомного гидрида, AH 3 ». Дж. Хим. Соц. : 2296–2301. дои : 10.1039/JR9530002296 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть V. Четырехатомные негидридные молекулы, АВ 3 ». Дж. Хим. Соц. : 2301–2306. дои : 10.1039/JR9530002301 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть VI. Молекулы H 2 AB». Дж. Хим. Соц. : 2306–2317. дои : 10.1039/JR9530002306 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть VII. Заметки о ближнем ультрафиолетовом спектре ацетальдегида». Дж. Хим. Соц. : 2318–2320. дои : 10.1039/JR9530002318 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть VIII. Пятатомные молекулы: молекулы CH 3 I». Дж. Хим. Соц. : 2321–2324. дои : 10.1039/JR9530002321 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть IX. Шестиатомные молекулы: этилен». Дж. Хим. Соц. : 2325–2329. дои : 10.1039/JR9530002325 .
- ^ Уолш, AD (1953). «Электронные орбитали, формы и спектры многоатомных молекул. Часть X. Заметки о спектре бензола». Дж. Хим. Соц. : 2330–2331. дои : 10.1039/JR9530002330 .
- ^ Малликен, Р.С. (1955). «Углы связи в молекулах типа воды и аммиака и их производных». Дж. Ам. хим. Соц. 77 (4): 887–891. дои : 10.1021/ja01609a021 .
- ^ Уолш, AD (1976). «Некоторые заметки об электронных спектрах малых многоатомных молекул». Межд. преп. наук: Физ. хим. Серия 2. 3 : 301–316.
- ^ О'Лири, Б.; Маллион, РБ (1987). «Диаграммы Уолша и теорема Хеллмана-Фейнмана: дань уважения покойному профессору Чарльзу А. Коулсону, FRS (1910-1974)». Журнал математической химии . 1 (4): 335–344. дои : 10.1007/BF01205066 .
- ^ Аткинс, PW (1970). Молекулярная квантовая механика . Оксфорд, Массачусетс: Clarendon Press. ISBN 978-0-19-855129-4 .
- ^ Питерс, Д. (1966). «Природа одноэлектронных энергий теории независимых электронных молекулярных орбиталей и диаграмм Уолша». Труды Фарадеевского общества . 6 : 1353–1361.
- ^ Чен, Э.; Чанг, Т. (1997). «Орбитальное взаимодействие и диаграмма Малликена-Уолша для систем AH 2 ». Журнал Китайского химического общества (Тайбэй) . 44 : 559–565. дои : 10.1002/jccs.199700086 .
- ^ Такахата, Ю.; Парр, Р.Г. (1974). «Три метода рассмотрения диаграмм типа Уолша, включая ядерное отталкивание» . Бюллетень Химического общества Японии . 47 (6): 1380–1386. дои : 10.1246/bcsj.47.1380 .
- ^ Jump up to: а б Аткинс, П.В.; и др. (1970). Неорганическая химия: Шрайвер и Аткинс . Оксфорд, Великобритания: Издательство Оксфордского университета. ISBN 978-0-19-926463-6 .