Синтез пиридина Ганча
| Синтез пиридина Ганча | |
|---|---|
| Назван в честь | Артур Рудольф Ханч |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | ганцш-дигидропиридин-синтез |
| RSC Идентификатор онтологии | RXNO: 0000268 |
Синтез пиридина Ханча или синтез дигидропиридина Ханча представляет собой многокомпонентную органическую реакцию между альдегидом, таким как формальдегид , 2 эквивалентами β-кетоэфира, такого как этилацетоацетат , и донором азота, таким как аммония ацетат или аммиак . [1] [2] Первоначальный продукт реакции представляет собой дигидропиридин, который может быть окислен на последующей стадии до пиридина . [3] Движущей силой этой второй стадии реакции является ароматизация . Об этой реакции сообщил в 1881 году Артур Рудольф Ханч .
1,4-дигидропиридина Дикарбоксилат также называют соединением 1,4-ДГП или сложным эфиром Ганча . Эти соединения представляют собой важный класс блокаторов кальциевых каналов. [2] и как таковые коммерциализируются, например, в виде нифедипина , амлодипина или нимодипина .
Было продемонстрировано, что реакция протекает в воде в качестве растворителя реакции и с прямой ароматизацией хлоридом железа , диоксидом марганца или перманганатом калия в однореакторном синтезе . [4]

Синтез дигидропиридина Ганча был осуществлен с помощью микроволновой химии . [5]
Механизм
[ редактировать ]Было предложено по крайней мере пять важных путей синтеза 1,4-дигидропиридина реакцией Ханча. Низкий выход и неожиданные продукты могут возникать при изменении реагентов и условий реакции. Предыдущие исследования проверяли реакции предварительно полученных промежуточных продуктов, чтобы определить наиболее вероятный механизм и разработать успешный синтез. [6] Раннее исследование механизма с использованием 13 С и 15 N-ЯМР указал на промежуточное взаимодействие халкона 6 и енамина 3 . Эти данные позволили предположить следующий путь реакции. [7]
Более поздние исследования с использованием масс-спектрометрического мониторинга с реагентами с мечеными зарядами подтвердили, что промежуточный путь А является вероятным маршрутом, и показали доказательства того, что реакция следовала двум дополнительным промежуточным путям, которые сходятся к предшественнику 7 . [6] Реагенты, вероятно, влияют на выбранный маршрут, поскольку, когда метильная группа 1 заменяется электроноакцепторной группой, реакция вместо этого протекает через промежуточный дикетон . [8]
Оптимизация условий реакции
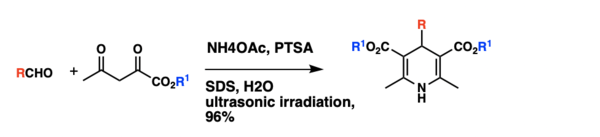
[ редактировать ]Классический метод синтеза 1,4-дигидропиридинов Ганча, который включает однореакторную конденсацию альдегидов с этилацетоацетатом и аммиаком, имеет ряд недостатков, таких как жесткие условия реакции, длительное время реакции и, как правило, низкий выход продуктов. Синтез 1,4-дигидропиридинов в водных мицеллах, катализируемый ПТСК при ультразвуковом облучении. Используя конденсацию бензальдегида , этилацетоацетата и ацетата аммония в качестве модели, эксперименты доказали, что при катализе п-толуолсульфоновой кислотой (ПТСК) под ультразвуковым облучением выход продукта может составлять 96% в водном растворе (ДСН, 0,1 М). . Реакцию также проводили в различных системах растворителей, и было обнаружено, что ультразвуковое облучение водных мицелл дает лучшие выходы, чем в растворителях, таких как метанол, этанол, ТГФ. С использованием оптимизированных условий реакции синтезирована серия 1,4-дигидропиридина, все они имеют выход реакции выше 90%. [9]
Ароматизация
[ редактировать ]Окисление 1,4-ДГП является одним из самых простых способов получения производных пиридина. [10] Обычными окислителями, используемыми для стимулирования ароматизации 1,4-ДГП, являются CrO 3 , KMnO 4 и HNO 3 . [11] Однако ароматизация часто сопровождается: низкими химическими выходами, сильными окислительными условиями, трудоемкими обработками, образованием побочных продуктов или необходимостью избытка окислителя. [11] [12] Поэтому особое внимание уделялось разработке методов ароматизации с получением производных пиридина в более мягких и эффективных условиях. Такие условия включают, помимо прочего: йод в кипящем метаноле, [11] диоксид хрома (CrO 2 ), [12] хлорит натрия , [13] не содержащих металлов, и в фотохимических условиях, с использованием как УФ-света, так и видимого света. [14] При метаболизме антигипертензивные препараты на основе 1,4-ДГФ подвергаются окислению посредством цитохрома Р-450 в печени и, таким образом, превращаются в свои пиридиновые производные. [11] В результате особое внимание было обращено на ароматизацию 1,4-ДГП как средство понимания биологических систем и разработки новых методов доступа к пиридинам. [13]
Зеленая химия
[ редактировать ]Будучи многокомпонентной реакцией , синтез пиридина Ганча гораздо более эффективен по атомам и имеет меньшее количество стадий реакции, чем синтез с линейной стратегией. «Растворители и условия реакции. [15] Одно направление исследований экспериментировало с использованием ионных жидкостей в качестве катализаторов реакций при комнатной температуре. Ионные жидкости — это простой в обращении и нетоксичный вариант замены традиционных катализаторов. Кроме того, этот катализатор обеспечивает высокий выход при комнатной температуре, уменьшая влияние нагревания реакции в течение длительного времени. Во втором исследовании в качестве альтернативного катализатора использовался нитрат церия-аммония (CAN), и была достигнута реакция при комнатной температуре без растворителя. [16]
Модификация Кневенагеля-Фриса
[ редактировать ]Модификация Кневенагеля -Фриса позволяет синтезировать несимметричные пиридиновые соединения. [17]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Ханч, А. (1881). «Продукты конденсации альдегидно-аммиачных и кетоноподобных соединений» . Химические отчеты . 14 (2): 1637–8. дои : 10.1002/cber.18810140214 .
- ^ Jump up to: а б Ли, Цзе Джек (19 июля 2006 г.). Имя Реакции (3-е изд.). ISBN 3-540-30030-9 .
- ^ Ли, Цзе Джек (11 октября 2004 г.). Назовите реакции в химии гетероциклов . п. 304. ИСБН 0-471-30215-5 .
- ^ Ся, Джей-Джей; Ван, GW (2005). «Однореакторный синтез и ароматизация 1,4-дигидропиридинов в кипящей воде». Синтез . 2005 (14): 2379–83. дои : 10.1055/s-2005-870022 .
- ^ ван ден Эйнде, Джей-Джей; Мэйенс, А. (2003). «Синтез и ароматизация 1,4-дигидропиридинов Ганча под воздействием микроволнового излучения. Обзор» (PDF) . Молекулы . 8 (4): 381–91. дои : 10.3390/80400381 . S2CID 98443099 .
- ^ Jump up to: а б Сантос, Ванесса Г. (2014). «Многокомпонентная реакция Ганча: комплексный масс-спектрометрический мониторинг с использованием реагентов с меченым зарядом». Химия – Европейский журнал . 20 (40): 12808–12816. дои : 10.1002/chem.201303065 . ПМИД 25179028 .
- ^ Катрински, Алан Р.; Остеркамп, Дэрил Л.; Юсуф, Тахер И. (1986). «Механизм синтеза ганча пиридина: исследование 15 Н и 13 C ЯМР-спектроскопия» . Tetrahedron . 42 (20): 5729–5738. doi : 10.1016/S0040-4020(01)88178-3 .
- ^ Сайни, Анил (февраль 2008 г.). «Реакция Ханча: последние достижения в области 1,4-дигидропиридинов Ханча» (PDF) . Журнал научных и промышленных исследований . 67 : 95–111.
- ^ Кумар, Атул (5 августа 2008 г.). "ХимИнформ Реферат: Эффективный синтез сложных эфиров Ханча и производных полигидрохинолина в водных мицеллах". ХимИнформ . 39 (32). дои : 10.1002/chin.200832145 .
- ^ Машраки, Сабир Х. (1998). «Пентагидрат нитрата висмута: удобный реагент для окисления 1,4-дигидропиридинов Ганча». Синтез . 1998 (5): 713–714. дои : 10.1055/s-1998-4516 .
- ^ Jump up to: а б с д Ядав, Джиллу С. (2000). «Ароматизация 1,4-дигидропиридинов Ганча с помощью I 2 -MeOH». Синтез . 2000 (11): 1532–1534. дои : 10.1055/s-2000-7613 .
- ^ Jump up to: а б Ко, Кван Юн (1999). «Ароматизация 1,4-дигидропиридинов Ханча с помощью магтриева». Буквы тетраэдра . 40 : 3207–3208. дои : 10.1016/S0040-4039(99)00467-0 .
- ^ Jump up to: а б Ляо, Сяли (2010). «Окислительная ароматизация 1,4-дигидропиридинов Ганча хлоритом натрия». Буквы тетраэдра . 51 (29): 3859–3861. дои : 10.1016/j.tetlet.2010.05.091 . S2CID 94650170 .
- ^ Вэй, Сяоцзин (2014). «Безметалловая окислительная ароматизация 1,4-дигидропиридинов в пиридины с использованием видимого света и воздуха». Китайский химический журнал . 32 (12): 1245–1250. дои : 10.1002/cjoc.201400521 .
- ^ Джассем, Ахмед Маджид; Алмашаль, Фаеза Абдул Карим; Мохаммед, Мохаммед Касим; Джабир, Хади Абдал Самад (7 февраля 2020 г.). «Каталитический и экологически чистый метод однореакторного синтеза новых 1,4-дигидропиридинов Ганча» . С.Н. Прикладные науки . 2 (3). дои : 10.1007/s42452-020-2165-x .
- ^ Шарма, МГ; Раджани, ДП; Патель, Ее Величество (14 июня 2017 г.). «Зеленый подход к синтезу биоактивных производных 1,4-дигидропиридина Ганча на основе тиофенового фрагмента посредством многокомпонентной реакции» . Королевское общество открытой науки . 4 (6): 170006. Бибкод : 2017RSOS....470006S . дои : 10.1098/rsos.170006 . ПМК 5493906 . ПМИД 28680664 .
- ^ Кневенагель, Э .; Фрис, А. (1898). «Синтезы в пиридиновом ряду. О расширении синтеза дигидропиридина Ганча» . Отчеты Немецкого химического общества . 31 (1): 761–7. дои : 10.1002/cber.189803101157 .