Ароматизация
Ароматизация — это химическая реакция , в которой ароматическая система образуется из одного неароматического предшественника. Обычно ароматизация достигается путем дегидрирования существующих циклических соединений, что иллюстрируется превращением циклогексана в бензол . Ароматизация включает образование гетероциклических систем. [1]

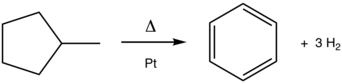
Превращение метилциклогексана в толуол является классической реакцией ароматизации. Этот катализируемый платиной (Pt) процесс широко применяется при производстве бензина из нефти.
Производственная практика
[ редактировать ]Хотя ароматизация и не практикуется под этим названием, она является краеугольным камнем нефтепереработки . Одной из основных реакций риформинга является в ароматические дегидрирование нафтенов соединения. Примером процесса, катализируемого платиной, является превращение метилциклогексана (нафтена) в толуол (ароматическое вещество). [2] Дегидроциклизация превращает парафины (ациклические углеводороды) в ароматические соединения. [3] Родственный процесс ароматизации включает в бензол дегидроизомеризацию метилциклопентана :
Биохимические процессы
[ редактировать ]Ароматазы — это ферменты , которые ароматизируют кольца внутри стероидов. Конкретными превращениями являются тестостерон в эстрадиол и андростендион в эстрон . [4] Каждая из этих ароматизаций включает окисление метильной группы C-19, что позволяет удалить муравьиную кислоту, сопутствующую ароматизации. Подобные превращения имеют отношение к онкогенезу эстрогенов при развитии рака молочной железы и рака яичников у женщин в постменопаузе и гинекомастии у мужчин. [5] Ингибиторы ароматазы, такие как эксеместан (который образует постоянную и деактивирующую связь с ферментом ароматазы) [6] и анастрозол и летрозол (которые конкурируют за фермент) [7] Было показано, что они более эффективны, чем антиэстрогенные препараты, такие как тамоксифен, вероятно, потому, что они предотвращают образование эстрадиола. [5]
Пути ароматизации
[ редактировать ]Окислительное дегидрирование
[ редактировать ]Для циклогексана, циклогексена и циклогексадиена дегидрирование является концептуально самым простым путем ароматизации. Активационный барьер уменьшается с увеличением степени ненасыщенности. Таким образом, циклогексадиены особенно склонны к ароматизации. Формально дегидрирование — это окислительно-восстановительный процесс. Дегидрирующая ароматизация является обратной гидрогенизации арена. По существу, катализаторы гидрирования эффективны для обратной реакции. Катализируемое платиной дегидрирование циклогексанов и родственного сырья является наиболее масштабным применением этой реакции (см. выше). [1]
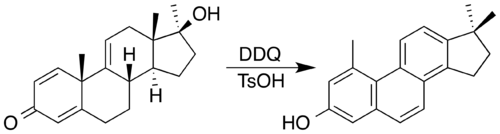
2,3-дихлор-5,6-дициано-1,4-бензохинон Реагентом выбора часто является (DDQ). DDQ и кислотный катализатор использовались для синтеза стероида с фенантреновым ядром путем окисления, сопровождающегося двойной миграцией метила . [8] В процессе DDQ сам превращается в ароматический гидрохинон .
При ароматизации традиционно используются сера и селен, уходящей группой является сероводород . [9]
Растворимые комплексы переходных металлов могут вызывать окислительную ароматизацию, сопровождающую комплексообразование. α-Фелландрен (2-метил-5- изо ) окисляется до п - изопропилтолуола -пропил-1,3- циклогексадиен с восстановлением трихлорида рутения . [10]
Окислительное дегидрирование дигидропиридина приводит к ароматизации с образованием пиридина . [11]
Обезвоживание
[ редактировать ]
Неароматические кольца можно ароматизировать разными способами. Обезвоживание допускает реакцию Земмлера-Вольфа. оксима 2-циклогексенона в анилин в кислой среде. [12]
таутомеризация
[ редактировать ]
Изомеризация циклогексадиенонов дает ароматический таутомер фенол . [13] [14] Изомеризация 1,4-нафталендиола при 200 °C дает смесь 2:1 с его кето-формой, 1,4-диоксотетралином. [15]
Гидридная и протонная абстракция
[ редактировать ]Классически реакции ароматизации включают изменение соотношения C:H в субстрате. При применении к циклопентадиену удаление протона дает ароматическое сопряженное основание циклопентадиенильный анион , который можно выделить как циклопентадиенид натрия : [16]
- 2 Na + 2 C 5 H 6 → 2 NaC 5 H 5 + H 2
Ароматизация может повлечь за собой удаление гидрида. Тропилий, С
7 ч. +
7 возникает в результате реакции ароматизации циклогептатриена с акцепторами гидрида.
- С
7 ч.
8 + руб.
2 → С
7 ч. +
7 + Бр. −
+ ХБр

Из ациклических предшественников
[ редактировать ]Ароматизация ациклических предшественников в органическом синтезе встречается реже, хотя она является важным компонентом производства БТК на нефтеперерабатывающих заводах.
Среди ациклических предшественников алкины относительно склонны к ароматизации, поскольку они частично дегидрированы. Циклизация Бергмана превращает эндиин в промежуточный дирадикал дегидробензола, который отщепляет водород для ароматизации. [17] Эндииновый фрагмент может быть включен в существующее кольцо, обеспечивая доступ к бициклической системе в мягких условиях вследствие деформации кольца в реагенте. Циклодека-3-ен-1,5-диин реагирует с 1,3-циклогексадиеном с образованием бензола и тетралина при 37 ° C, причем реакция очень благоприятна из-за образования двух новых ароматических колец:
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Гэри, Дж. Х.; Хандверк, GE (1984). Технология и экономика нефтепереработки (2-е изд.). Марсель Деккер, Inc. ISBN 0-8247-7150-8 .
- ^ Оно, Ю. (1992). «Превращение низших алканов в ароматические углеводороды на цеолитах ZSM-5». Катал. Преподобный - Науч. англ . 34 (3): 179–226. дои : 10.1080/01614949208020306 .
- ^ Лефарт, Эд (1996). «Обзор мозговой ароматазы цитохрома P450». Мозговой Рес. Преподобный . 22 (1): 1–26. дои : 10.1016/0165-0173(96)00002-1 . ПМИД 8871783 . S2CID 11987113 .
- ^ Jump up to: а б Авенданьо, К.; Менендес, JC (2008). «Ингибиторы ароматазы» . Медицинская химия противораковых препаратов . Эльзевир . стр. 65–73. дои : 10.1016/B978-0-444-52824-7.00003-2 . ISBN 9780080559629 .
- ^ Ясек, В., изд. Австрийский кодекс (на немецком языке) (62-е изд.). Вена: Издательство австрийского фармацевта. стр. 656–660. ISBN 9783852001814 .
- ^ Диннендал, В.; Фрике, У., ред. (2007). Профили лекарств (на немецком языке). Том 4 (21-е изд.). Эшборн, Германия: Govi Pharmazeutischer Verlag. ISBN 9783774198463 .
- ^ Браун, В.; Тернер, AB (1971). «Применение высокопотенциальных хинонов. Часть VII. Синтез стероидных фенантренов путем двойной миграции метила». Журнал Химического общества C: Organic . 14 : 2566–2572. дои : 10.1039/J39710002566 . ПМИД 5167256 .
- ^ Бергманн, Ф.; Шмушкович, Ю.; Фаваз, Г. (1947). «Конденсация 1,1-диарилэтиленов с малеиновым ангидридом». Журнал Американского химического общества . 69 (7): 1773–1777. дои : 10.1021/ja01199a055 . ПМИД 20251415 .
- ^ Беннетт, Массачусетс; Хуанг, Теннесси; Мэтисон, ТВ; Смит, АК (1982). (η 6 -Гексаметилбензол)рутениевые комплексы . Неорганические синтезы . Том. 21. С. 74–78. дои : 10.1002/9780470132524.ch16 . ISBN 9780470132524 .
- ^ Симидзу, С.; Ватанабэ, Н.; Катаока, Т.; Сёдзи, Т.; Абэ, Н.; Моришита, С.; Ичимура, Х. (2005). «Пиридин и производные пиридина». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ . дои : 10.1002/14356007.a22_399 . ISBN 3527306730 .
- ^ Хорнинг, ЕС; Стромберг, В.Л.; Ллойд, ХА (1952). «Перестановки Бекмана. Исследование особых случаев». Журнал Американского химического общества . 74 (20): 5153–5155. дои : 10.1021/ja01140a048 .
- ^ Клейден, Дж .; Гривз, Н.; Уоррен, С .; Уотерс, П. (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета . п. 531 . ISBN 9780198503460 .
- ^ Каппони, М.; Гут, И.Г.; Хеллрунг, Б.; Перси, Г.; Вирц, Дж. (1999). «Равновесия кетонизации фенола в водном растворе». Канадский химический журнал . 77 (5–6): 605–613. дои : 10.1139/cjc-77-5-6-605 .
- ^ Кюндиг, Е.П.; Гарсия, А.Е.; Ломбергет, Т.; Бернардинелли, Г. (2005). «Повторное открытие, выделение и асимметричное восстановление 1,2,3,4-тетрагидронафталин-1,4-диона и исследования его комплекса [Cr(CO) 3 ]». Angewandte Chemie, международное издание . 45 (1): 98–101. дои : 10.1002/anie.200502588 . ПМИД 16304647 .
- ^ Коттон, Флорида ; Уилкинсон, Г. (1999). Продвинутая неорганическая химия (6-е изд.). Джон Уайли и сыновья . ISBN 9780471199571 .
- ^ Мохамед, РК; Петерсон, П.В.; Алабугин, ИВ (2013). «Согласованные реакции с образованием дирадикалов и цвиттер-ионов: электронный, стерический, конформационный и кинетический контроль процессов циклоароматизации». Химические обзоры . 113 (9): 7089–7129. дои : 10.1021/cr4000682 . ПМИД 23600723 .