Фенантрен
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Фенантрен | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 1905428 | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.001.437 |
| Номер ЕС |
|
| 28699 | |
| КЕГГ | |
| МеШ | C031181 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 14 Ч 10 | |
| Молярная масса | 178.234 g·mol −1 |
| Появление | Бесцветное твердое вещество |
| Плотность | 1,18 г/см 3 [1] |
| Температура плавления | 101 ° С (214 ° F; 374 К) [1] |
| Точка кипения | 332 ° С (630 ° F; 605 К) [1] |
| 1,6 мг/л [1] | |
| −127.9·10 −6 см 3 /моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 171 ° С (340 ° F; 444 К) [1] |
| Структура | |
| С 2 в [2] | |
| 0 Д | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
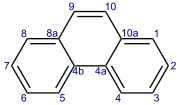
Фенантрен — полициклический ароматический углеводород (ПАУ) формулы C 14 H 10 , состоящий из трех конденсированных бензольных колец. Это бесцветное кристаллоподобное твердое вещество, но оно также может иметь желтый цвет. Фенантрен используется для производства красителей, пластмасс, пестицидов, взрывчатых веществ и лекарств. Его также использовали для производства желчных кислот, холестерина и стероидов. [3]
Фенантрен встречается в природе, а также является искусственным химическим веществом. Обычно люди подвергаются воздействию фенантрена при вдыхании сигаретного дыма, но существует множество путей воздействия. Исследования на животных показали, что фенантрен является потенциальным канцерогеном. [3] Однако, по данным IARC, он не считается вероятным, возможным или подтвержденным канцерогеном для человека. [4]
Три сросшихся кольца фенантрена расположены под углом, как у фенаценов , а не прямо, как у аценов . Соединение с фенантреновым скелетом и атомами азота в положениях 4 и 5 известно как фенантролин .
Физические свойства
[ редактировать ]Фенантрен почти нерастворим в воде, но растворим в большинстве низкополярных органических растворителей, таких как толуол , четыреххлористый углерод , эфир , хлороформ , уксусная кислота и бензол .
Фенантрен флуоресцирует в ультрафиолетовом свете, демонстрируя большой стоксовский сдвиг . [5] Его можно использовать в сцинтилляторах .
Химия
[ редактировать ]Реакции фенантрена обычно происходят в положениях 9 и 10, в том числе:
- Органическое окисление до фенантренхинона хромовой кислотой. [6]
- Органическое восстановление до 9,10-дигидрофенантрена газообразным водородом и никелем Ренея. [7]
- Электрофильное галогенирование до 9-бромфенантрена бромом. [8]
- Ароматическое сульфирование до 2- и 3-фенантренсульфокислот серной кислотой. [9]
- Озонолиз до дифенилальдегида [10]
Канонические формы
[ редактировать ]Фенантрен более стабилен, чем его линейный изомер антрацен . Классическое и устоявшееся объяснение основано на правиле Клара . Новая теория использует так называемые стабилизирующие водородно-водородные связи между атомами водорода C4 и C5. [ нужна ссылка ]
Синтез
[ редактировать ]- Синтез фенантрена Бардхана-Сенгупты классический способ получения фенантренов. [11]
Этот процесс включает электрофильное ароматическое замещение с использованием связанной циклогексанольной группы с использованием пятиокиси дифосфора , которая замыкает центральное кольцо на существующем ароматическом кольце. Дегидрирование с использованием селена превращает и другие кольца в ароматические. Ароматизация шестичленных колец селеном до конца не изучена, но при этом образуется H 2 Se .
Фенантрен можно получить также фотохимическим путем из некоторых диарилэтенов ( реакция Мэллори ):

Другие пути синтеза включают реакцию Хаворта и Вагнера-Меервейна типа расширение кольца , как показано ниже:

Природные явления
[ редактировать ]Раватит – природный минерал, состоящий из фенантрена. [12] Он встречается в небольших количествах среди нескольких мест сжигания угля. Раватит представляет собой небольшую группу органических минералов.
В растениях
[ редактировать ]Производные фенантрена встречаются в растениях в виде фенантреноидов . Они были зарегистрированы на цветковых растениях, главным образом в семействе Orchidaceae и некоторых семействах Dioscoreaceae , Combretaceae и Betulaceae , а также в низшем классе растений Marchantiophyta (печеночники). [13]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Запись CAS RN 85-01-8 в базе данных веществ GESTIS Института охраны труда
- ^ Питер Аткинс, JDP, Физическая химия Аткинса. Оксфорд: 2010. С. 443.
- ^ Jump up to: а б «Информационный бюллетень по фенантрену» (PDF) . archive.epa.gov . Агентство по охране окружающей среды США . Проверено 19 июля 2019 г.
- ^ «Фенантрен» . Сигма-Альдих .
- ^ «Спектр [Фенантрен] | ААТ Биоквест» . www.aatbio.com . Проверено 30 июля 2024 г.
- ^ Органические синтезы , Сб. Том. 4, с. 757 (1963); Том. 34, с. 76 (1954).
- ^ Органические синтезы , Сб. Том. 4, с. 313 (1963); Том. 34, с. 31 (1954).
- ^ Органические синтезы , Сб. Том. 3, с. 134 (1955); Том. 28, с. 19 (1948).
- ^ Органические синтезы , Сб. Том. 2, с. 482 (1943); Том. 16, с. 63 (1936).
- ^ Органические синтезы , Сб. Том. 5, с. 489 (1973); Том. 41, с. 41 (1961).
- ^ «Синтез Бардхана Сенгупты». Комплексные органические реакции и реагенты . Том. 49. 2010. С. 215–219. дои : 10.1002/9780470638859.conrr049 . ISBN 9780470638859 .
- ^ Данные о минералах раватита
- ^ Ковач, Адриана; Васас, Андреа; Хоманн, Юдит (2008). «Природные фенантрены и их биологическая активность». Фитохимия . 69 (5): 1084–1110. Бибкод : 2008PChem..69.1084K . doi : 10.1016/j.phytochem.2007.12.005 . ПМИД 18243254 .
Внешние ссылки
[ редактировать ]- Фенантрен на сайте Scorecard.org

