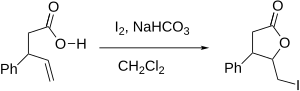
Йодолактонизация
| Галолактонизация | |
|---|---|
| Тип реакции | Реакция образования кольца |
Йодолактонизация (или, в более общем плане, галолактонизация ) — это органическая реакция, в ходе которой образуется кольцо ( лактон ) путем присоединения кислорода и йода по двойной связи углерод-углерод. Это внутримолекулярный вариант реакции синтеза галогенгидрина . Впервые о реакции сообщил М. Дж. Бугальт в 1904 году, и с тех пор она стала одним из наиболее эффективных способов синтеза лактонов. [1] К сильным сторонам реакции относятся мягкие условия и включение в продукт универсального атома йода.
Йодолактонизация использовалась в синтезе многих натуральных продуктов, в том числе имеющих медицинское применение, таких как вернолепин и верноменин. [2] два соединения, используемые для ингибирования роста опухолей, и вибралактон , ингибитор липазы поджелудочной железы . [3] Йодолактонизация также использовалась Элиасом Джеймсом Кори для синтеза многочисленных простагландинов . [4]
История
[ редактировать ]Отчет Бугальта о йодолактонизации представляет собой первый пример надежной лактонизации, которую можно использовать во многих различных системах. Бромолактонизация была фактически разработана за двадцать лет до публикации Бугальтом йодолактонизации. [1] Однако бромлактонизация используется гораздо реже, поскольку простое электрофильное присоединение брома к алкену , как показано ниже, может конкурировать с реакцией бромолактонизации и снижать выход желаемого лактона. [5]

Методы хлоролактонизации впервые появились в 1950-х годах. [1] но используются еще реже, чем бромолактонизация. Использование элементарного хлора сложно с процедурной точки зрения, поскольку при комнатной температуре он представляет собой газ, а продукт электрофильного присоединения может быть быстро получен, как при бромолактонизации. [6]
Механизм
[ редактировать ]Механизм реакции включает образование положительно заряженного иона галония в молекуле, которая также содержит карбоновую кислоту (или другую функциональную группу , являющуюся ее предшественником). Кислород карбоксила действует как нуклеофил , атакуя, открывая галониевое кольцо и вместо этого образуя лактонное кольцо. Реакцию обычно проводят в слабоосновных условиях для повышения нуклеофильности карбоксильной группы.
Объем
[ редактировать ]Реакция иодолактонизации включает в себя ряд нюансов, влияющих на образование продукта, включая региоселективность , предпочтение размера кольца, а также термодинамический и кинетический контроль . С точки зрения региоселективности иодолактонизация преимущественно происходит по наиболее затрудненному атому углерода, соседнему с катионом йодония . Это связано с тем, что более замещенный углерод лучше способен сохранять частичный положительный заряд и, следовательно, более электрофильен и восприимчив к нуклеофильной атаке. Когда несколько двойных связей в молекуле одинаково реакционноспособны, конформационные предпочтения доминируют. Однако когда одна двойная связь более реакционноспособна, эта реакционная способность всегда доминирует независимо от конформационных предпочтений. [7]
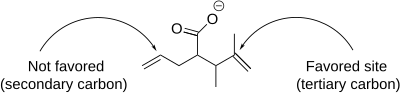
Как пятичленные, так и шестичленные кольца могут образовываться при йодолактонизации, показанной ниже, но пятичленное кольцо образуется преимущественно, как и предсказывают правила Болдуина для замыкания кольца. [8] Согласно правилам, замыкание колец из 5-экзо-тет является предпочтительным, а закрытие колец из 6-эндо-тет не является предпочтительным. [9] Региоселективность каждой иодолактонизации можно предсказать и объяснить с помощью правил Болдуина.

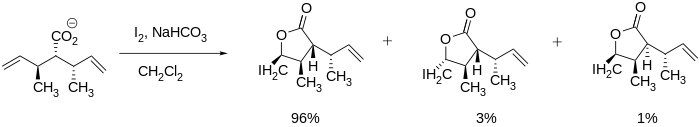
Стереоселективная йодолактонизация наблюдалась в литературе и может быть очень полезной при синтезе больших молекул, таких как вышеупомянутые вернопелин и верноменин, поскольку лактон может образовываться при сохранении других стереоцентров. Замыкание кольца может даже осуществляться стереоцентрами, прилегающими к кратной связи углерод-углерод, как показано ниже. [7]
Бартлетт и его коллеги обнаружили, что даже в системах без существующих стереоцентров стереоселективность достижима. Они смогли синтезировать цис- и транс -пятичленные лактоны, регулируя условия реакции, такие как температура и время реакции. Транс - продукт образовывался в термодинамических условиях (например, при длительном времени реакции), тогда как цис- продукт образовывался в кинетических условиях (например, при относительно более коротком времени реакции). [10]
Приложения
[ редактировать ]Йодолактонизация использовалась в синтезе многих биологически важных продуктов, таких как ингибиторы роста опухоли вернолепин и верноменин, ингибитор панкреатической липазы вибралактон и простагландины - липиды , обнаруженные у животных. Во всех следующих методах полного синтеза йодолактонизация используется в качестве ключевого этапа получения желаемого продукта.
В 1977 году Сэмюэл Данишефски и его коллеги смогли синтезировать ингибиторы роста опухоли dl -вернолепин и dl -верноменин с помощью многостадийного процесса, в котором использовалась лактонизация. [2] Этот синтез демонстрирует использование иодолактонизации для преимущественного образования пятичленного кольца, а не четырех- или шестичленного, как и ожидалось из правил Болдуина.
В 2006 году Чжоу и его коллеги синтезировали еще один природный продукт — вибралактон, ключевым этапом которого было образование лактона. [3] Стереоселективность иодолактонизации устанавливает критическую стереохимическую конфигурацию целевого соединения.
В 1969 году Кори и его коллеги синтезировали простагландин Е 2, используя промежуточный продукт йодолактона. [4] Опять же, стереоселективность йодолактонизации играет важную роль в образовании продукта.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Доул, доктор медицины; Дэвис, Д.И. (1979). «Синтез и синтетическое использование галолактонов». Обзоры химического общества . 8 (2): 171. дои : 10.1039/CS9790800171 .
- ^ Jump up to: а б Данишевский, С.; Шуда, ПФ; Китахара, Т.; Этередж, SJ (1977). «Полный синтез dl -вернолепина и dl -верноменина». Журнал Американского химического общества . 99 (18): 6066. doi : 10.1021/ja00460a038 .
- ^ Jump up to: а б Чжоу, К.; Снайдер, Б.Б. (2008). «Синтез (±)-вибралактона» . Органические письма . 10 (7): 1401–1404. дои : 10.1021/ol800118c . ПМЦ 2745174 . ПМИД 18311992 .
- ^ Jump up to: а б Кори, Э.Дж.; Вайншенкер, Нью-Мексико; Шааф, ТК; Хубер, В. (1969). «Стереоконтролируемый синтез dl -простагландинов F 2α и E 2 ». Журнал Американского химического общества . 91 (20): 5675–5677. дои : 10.1021/ja01048a062 . ПМИД 5808505 .
- ^ Браун, Р.С. (1997). «Исследование ранних этапов электрофильного бромирования путем изучения реакции со стерически обремененными олефинами». Отчеты о химических исследованиях . 30 (3): 131–137. дои : 10.1021/ar960088e .
- ^ Гарратт, генеральный директор; Райан, доктор медицины; Болье, Польша (1980). «Добавление электрофильных реагентов групп 6А и 7А к диметилэндо , эндо - бицикло[2.2.2]окт-5-ен-2,3-дикарбоксилату: конкурентное образование γ- и δ-лактонов». Журнал органической химии . 45 (5): 839. doi : 10.1021/jo01293a016 .
- ^ Jump up to: а б Курт, MJ; Браун, Е.Г.; Льюис, Э.Дж.; МакКью, Джей Си (1988). «Региоселективность при йодолактонизации производных 1,6-гептадиен-4-карбоновой кислоты». Буквы тетраэдра . 29 (13): 1517. doi : 10.1016/S0040-4039(00)80340-8 .
- ^ Болдуин, Джек Э. (1976). «Правила закрытия ринга». Журнал Химического общества, Chemical Communications (18): 734. doi : 10.1039/c39760000734 . ISSN 0022-4936 .
- ^ Хиршманн, Х.; Хэнсон, КР (1977). «Согласованная с отражением стереоспецифическая нумерация». Тетраэдр . 33 (8): 891–897. дои : 10.1016/0040-4020(77)80042-2 . ISSN 0040-4020 .
- ^ Бартлетт, Пенсильвания; Майерсон, Дж. (1978). «Стереоселективное эпоксидирование ациклических олефиновых карбоновых кислот путем иодолактонизации». Журнал Американского химического общества . 100 (12): 3950. doi : 10.1021/ja00480a061 .