Элиас Джеймс Кори
Элиас Джеймс Кори (родился 12 июля 1928 г.) — американский химик-органик . В 1990 году он получил Нобелевскую премию по химии «за разработку теории и методологии органического синтеза ». [3] конкретно ретросинтетический анализ . [4] [5]
Считающийся многими одним из величайших ныне живущих химиков, он разработал множество синтетических реагентов , методологий и методов полного синтеза, а также значительно продвинул науку об органическом синтезе.
Биография [ править ]
Э. Дж. Кори (фамилия была переведена на английский язык от левантийского арабского слова «Хури» , что означает «священник» ) родился в семье ливанских греко-православных иммигрантов Фатимы (урожденной Хашам) и Элиаса Кори в Метуэне, штат Массачусетс , в 50 км (31 милях) к северу от Бостона. [6] Его мать изменила его имя с Уильяма на «Элиас» в честь его отца, который умер через восемнадцать месяцев после рождения Кори. Его овдовевшая мать, брат, две сестры, тетя и дядя жили вместе в просторном доме, переживая Великую депрессию . В детстве Кори был независимым и увлекался такими видами спорта, как бейсбол, футбол и пеший туризм. Он посещал католическую начальную школу и среднюю школу Лоуренса в Лоуренсе, штат Массачусетс .
В возрасте 16 лет Кори поступил в Массачусетский технологический институт , где получил степень бакалавра в 1948 году и степень доктора философии. под руководством профессора Джона К. Шихана в 1951 году. Поступив в Массачусетский технологический институт, Кори имел единственный научный опыт в области математики, и он начал свою карьеру в колледже, получив степень инженера. После первого урока химии на втором курсе он начал переосмысливать свои долгосрочные карьерные планы и получил степень бакалавра химии. Сразу после этого, по приглашению профессора Джона Шиэна, Кори остался в Массачусетском технологическом институте для защиты докторской степени. После окончания аспирантуры ему предложили должность в Университете Иллинойса в Урбане-Шампейне , где он стал профессором химии в 1956 году в возрасте 27 лет. Он был инициирован в качестве члена Зетовского отделения Альфа Хи Сигмы в Университет Иллинойса в 1952 году. [7] В 1959 году он перешел в Гарвардский университет , где в настоящее время является почетным профессором органической химии и ведет активную исследовательскую программу Corey Group. Он выбрал работу в области органической химии из-за «ее внутренней красоты и большого значения для здоровья человека». [8] Он также был советником Pfizer более 50 лет. [9]
Среди многочисленных наград Кори был награжден Национальной медалью науки в 1988 году. [10] Нобелевская премия по химии 1990 г., [5] и Американского химического общества величайшая награда — медаль Пристли — в 2004 году. [11]
Основные вклады [ править ]
Реагенты [ править ]
Кори разработал несколько новых синтетических реагентов:
- PCC (хлорхромат пиридиния) , также называемый реагентом Кори-Саггса , широко используется для окисления спиртов до соответствующих кетонов и альдегидов . [12] PCC имеет ряд преимуществ перед другими коммерческими окислителями. Устойчивое на воздухе твердое вещество желтого цвета, лишь слегка гигроскопично. В отличие от других окислителей, PCC требует всего около 1,5 эквивалентов для завершения однократного окисления (схема 1).

В ходе реакции спирт нуклеофильно вытесняет хлор из электроположительного металлического хрома (VI). Затем хлорид - анион действует как основание, образуя альдегидный продукт и хром (IV).
Слабокислотный характер PCC делает его полезным для реакций циклизации со спиртами и алкенами (схема 2). [13]
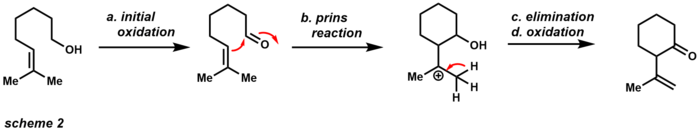
reactivity of PCC under acidic conditions Первоначальное окисление дает соответствующий альдегид, который затем может вступить в реакцию Принса с соседним алкеном . После отщепления и дальнейшего окисления продукт представляет собой циклический кетон . И наоборот, порошкообразный ацетата натрия сореагент ингибирует реакцию после образования альдегида.
Окислительная устойчивость PCC также сделала его полезным в сфере полного синтеза (схема 3). Этот пример показывает, что PCC способен осуществлять окислительную перегруппировку Даубена с третичными спиртами посредством [3,3]-сигматропной перегруппировки. [14]
![[3,3] перегруппировка с PCC](//upload.wikimedia.org/wikipedia/commons/thumb/8/87/PCC_rearrangement3.png/700px-PCC_rearrangement3.png)
[3,3] rearrangement with PCC - т -бутилдиметилсилиловый эфир (ТБС), [15] триизопропилсилиловый эфир (TIPS) и метоксиэтоксиметил (MEM) являются популярными защитными группами для спиртов . Разработка этих защитных групп позволила синтезировать несколько натуральных продуктов которых , функциональные группы не выдерживали стандартных химических превращений. Хотя сообщество синтетических людей пытается свести к минимуму использование защитных групп, все же редко когда опубликованный синтез натуральных продуктов полностью их опускает.С 1972 года группа TBS стала самой популярной защитной группой кремния (схема 4). [16] [17] TBS устойчив к хроматографии и достаточно лабилен, чтобы расщепляться в основных и кислых условиях. TBS Что еще более важно, эфиры устойчивы к таким углеродным нуклеофилам, как реактивы Гриньяра и еноляты. [18] [19] [20]
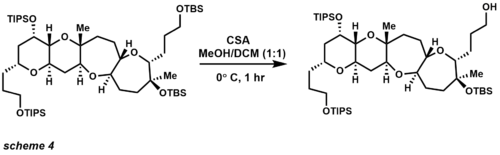
CSA (камфорсульфоновая кислота) избирательно удаляет первичный эфир TBS в присутствии TIPS и третичных эфиров TBS. Другие методы снятия защиты с TBS включают кислоты (также кислоты Льюиса) и фториды .
Защитные группы TIPS обеспечивают повышенную селективность первичной, а не вторичной и третичной защиты от алкоголя. Их эфиры более стабильны в кислых и основных условиях, чем эфиры TBS, но менее лабильны при снятии защиты. [21] В наиболее распространенных реагентах для расщепления используются те же условия, что и в эфире TBS, но с более длительным временем реакции.

Обычно TBAF разрывает эфиры TBS, но затрудненный эфир TBS, указанный выше, выдерживает первичное удаление TIPS (схема 5). [22]
Защитная группа MEM была впервые описана Кори в 1976 году. [23] Эта защитная группа по реакционной способности и стабильности аналогична другим алкоксиметиловым эфирам в кислых условиях. В кислых условиях обычно происходит расщепление защитных групп МЕМ, но координация с галогенидами металлов значительно увеличивает лабильность (схема 6). [24]

- 1,3- Дитианы представляют собой временную модификацию карбонильной группы, которая меняет их реакционную способность в реакциях замещения и присоединения. Дитианирование привело к появлению химии умполунгов , которая теперь является ключевой концепцией в органическом синтезе. [25] Образование дитианов может осуществляться с помощью кислоты Льюиса (схема 7) или непосредственно из карбонильных соединений. [26]

PKa дитианов составляет примерно 30, что позволяет депротонировать с помощью алкиллитиевого реагента, обычно н-бутиллития .
Реакция между дитианами и альдегидами теперь известна как реакция Кори-Зибаха . Дитиан после депротонирования служит ацил-анионом, атакующим входящие электрофилы . Снятие защиты с дитиана, обычно с помощью HgO, приводит к образованию кетонового продукта. [25]

- Кори также начал подробные исследования катионных циклизаций полиолефинов, используемых при ферментативном производстве холестерина из более простых растительных терпенов. [27] Кори установил детали замечательного процесса циклизации, сначала изучив биологический синтез стеринов из сквалена.
Методология [ править ]
Несколько реакций, разработанных в лаборатории Кори, стали обычным явлением в современной синтетической органической химии. С 1950 года в группе Кори было разработано не менее 302 методов. [28] В его честь названо несколько реакций:
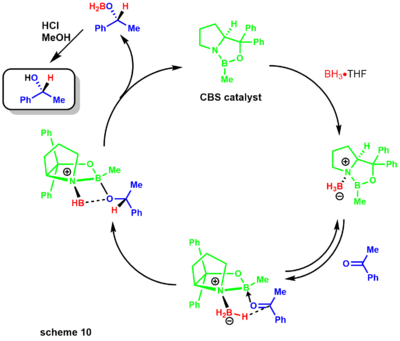
- Восстановление Кори-Ицуно , также известное как восстановление Кори-Бакши-Шибаты, представляет собой энантиоселективное восстановление кетонов до спиртов с помощью оксазаборолидинового катализатора с использованием различных боранов в качестве стехиометрического восстановителя. [29] Группа Кори впервые продемонстрировала синтез катализатора с использованием борана и хиральной аминокислоты пролина (схема 9). [30] [31]

Позже Кори продемонстрировал, что замещенные бораны легче получить и они гораздо более стабильны.
Механизм восстановления начинается с оксазоборолидина, слабоосновного по азоту , координирующегося с борановым восстановителем (схема 10). [31] Плохая отдача азота бору оставляет кислотность Льюиса практически неизменной, обеспечивая координацию с кетоновым субстратом. Комплексообразование субстрата происходит из наиболее доступной неподеленной пары кислорода , ограничивающей вращение вокруг связи BO за счет стерически соседней фенильной группы. [32]
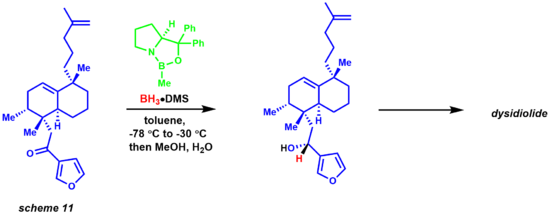
Миграция гидрида от борана к электрофильному кетоновому центру происходит через переходное состояние 6-членного кольца, что приводит к образованию четырехчленного промежуточного соединения кольца, что в конечном итоге обеспечивает хиральный продукт и регенерацию катализатора. [33]
Реакция также оказалась очень полезной для химиков, занимающихся натуральными продуктами (схема 11). [33] [34] Синтез дизидиолида Кори и его соавт. был достигнут посредством энантиоселективного восстановления CBS с использованием комплекса боран-диметилсульфид.
- Синтез алкинов Кори-Фукса — это синтез концевых алкинов путем одноуглеродной гомологизации альдегидов с использованием трифенилфосфина и тетрабромида углерода. [30] [35] Механизм аналогичен комбинированной реакции Виттига и реакции Аппелла . Реакция илида фосфора, образующегося in situ, с альдегидным субстратом дает дибромолефин. [36]

При обработке двумя эквивалентами н -бутиллития в результате галогенового обмена и депротонирования лития образуется ацетилид лития, который подвергается гидролизу с образованием терминального алкинового продукта (схема 12). [30]
Более поздние разработки включают модифицированную процедуру однореакторного синтеза. [37]
Это синтетическое преобразование оказалось успешным при полном синтезе (+)-тейлориона У. Дж. Керром и его сотрудниками (схема 13). [38]

- Окисление Кори-Кима представляло собой новое превращение спиртов в соответствующие альдегиды и кетоны. [30] [39] [40] Эта комбинация хлорида N -хлорсукцинимидосульфония (NCS), диметилсульфида (DMS) и триэтиламина (TEA) предлагает менее токсичную альтернативу окислению на основе хрома.Реагент Кори-Кима образуется in situ , когда сукцинимид и сульфид реагируют с образованием хлорида диметилсукцинимидосульфония (схема 14). [30]

Триэтиламин депротонирует алкоксисульфониевую соль в положении α, получая окисленный продукт. В реакции участвует широкий спектр функциональных групп, но вместо этого аллиловые и бензиловые спирты обычно превращаются в хлориды. [39]
Его применение в синтезе основано на мягких протокольных условиях и совместимости функциональных и защитных групп. При полном синтезе ингенола Кувадзима и его коллеги использовали окисление Кори-Кима путем избирательного окисления менее затрудненного вторичного спирта (схема 15). [41]

- Олефинирование Кори-Винтера представляет собой стереоспецифическое превращение 1,2-диолов в алкены с участием диольного субстрата, тиокарбонилдиимидазола и избытка триалкилфосфита. [30] [42] Точный механизм неизвестен, но был сужен до двух возможных путей. [43] Тионокарбонат и триалкилфосфит образуют либо фосфорилид, либо карбеноидный промежуточный продукт.Реакция является стереоспецифичной для большинства субстратов, если только продукт не приведет к чрезвычайно напряженной структуре, как это было обнаружено, когда Кори и др. попытались образовать пространственно затрудненные транс- алкены в определенных 7-членных кольцах.Стереоспецифичные алкены присутствуют в нескольких природных продуктах, поскольку этот метод продолжает использоваться для получения ряда сложных субстратов. Профессор Т.К.М. Шинг и др. использовали реакцию олефинирования Кори-Винтера для синтеза (+)-боэзеноксида (схема 16). [44]

total synthesis example of corey winter olefination - типа CBS Энантиоселективная реакция Дильса-Альдера была разработана с использованием каркаса, аналогичного энантиоселективному восстановлению CBS. [31] После развития этой реакции реагент CBS оказался очень универсальным реагентом для ряда мощных синтетических превращений. Использование хиральной кислоты Льюиса, такой как катализатор CBS, включает широкий спектр ненасыщенных еноновых субстратов.Реакция, вероятно, протекает через предпереходное состояние высокоорганизованного 6-членного кольца с получением высокоэнантио-обогащенных продуктов (схема 17). [45]
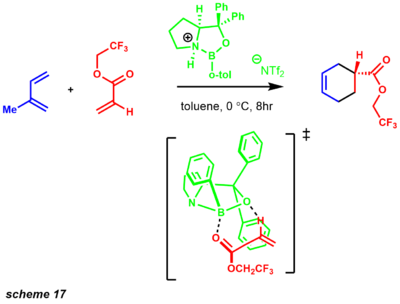
enantioslective diels-alder transition state Это переходное состояние, вероятно, возникает из-за благоприятной упаковки пи с фенильным заместителем. [31] [46] Энантиоселективность процесса обеспечивается приближением диена к диенофилу с противоположной стороны фенильного заместителя.
Реакция Дильса-Альдера — одно из самых мощных превращений в синтетической химии. Синтез природных продуктов с использованием реакции Дильса-Альдера в качестве преобразования был применен, в частности, к образованию шестичленных колец (схема 18). [47]

enantioslective diels-alder in total synthesis - Макролактонизация Кори-Николау среднего и большого размера представляет собой первый метод получения лактонов . [30] [48] Ранее межмолекулярная лактонизация вытесняла внутримолекулярную лактонизацию даже при низких концентрациях. Одним из больших преимуществ этой реакции является то, что она проводится в нейтральных условиях, допуская присутствие кислотных и щелочных функциональных групп. По состоянию на 2016 год этим методом успешно синтезированы кольца из 7–44 членов. [49] [50]
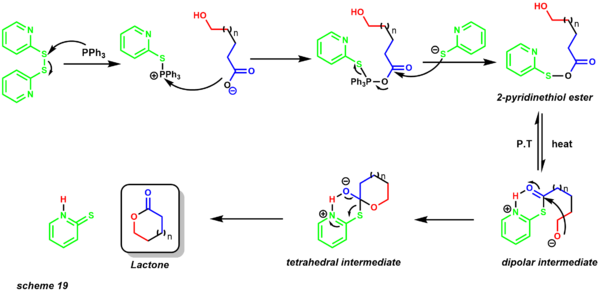
mechanism of Corey-Nicolaou macrolactonization Реакция протекает в присутствии 2,2'-дипиридилдисульфида и трифенилфосфина при кипении с обратным холодильником неполярного растворителя, такого как бензол . Механизм начинается с образования 2-пиридинтиолового эфира (схема 19). Перенос протона обеспечивает диполярное промежуточное соединение, в котором алкоксидный нуклеофил атакует электрофильный карбонильный центр, образуя тетраэдрическое промежуточное соединение, которое дает продукт макролактона. [51]
Один из первых примеров этого протокола был применен к полному синтезу зеараленона (схема 20). [51]

macrolactonization total synthesis example - Реакция Джонсона-Кори-Чайковского синтезирует эпоксиды и циклопропаны . [30] В результате реакции образуется илид серы in situ, который реагирует с енонами, кетонами, альдегидами и иминами с образованием соответствующих эпоксидов, циклопропанов и азиридинов . [52] Были использованы два варианта сера-илида, которые дают разные хемоселективные продукты (схема 21). Метилид диметилсульфоксония дает эпоксиды из кетонов, но дает циклопропаны при использовании енонов. Метилид диметилсульфония превращает кетоны и еноны в соответствующие эпоксиды. Метилид диметилсульфония гораздо более реакционноспособен и менее стабилен, чем метилид диметилсульфоксония, поэтому он образуется при низких температурах. [53]
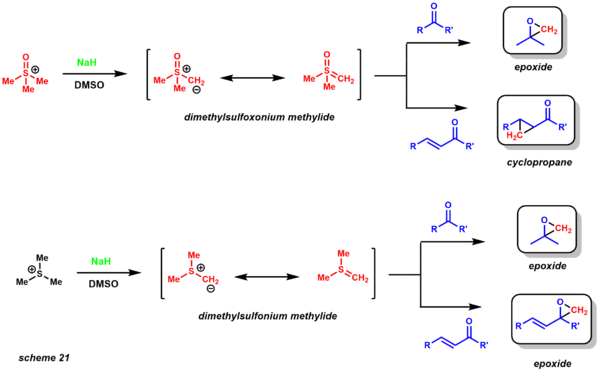
corey-chaykovsky selectivity - Еще одним явным преимуществом этих двух вариантов, учитывая их реакционную способность, является то, что кинетически они обеспечивают разницу в диастереоселективности. Реакция очень хорошо изучена, также были получены энантиоселективные варианты (каталитический и стехиометрический). С точки зрения ретросинтетического анализа эта реакция представляет собой разумную альтернативу традиционным реакциям эпоксидирования алкенами (схема 22). Данишевский использовал эту методологию для синтеза таксола. Диастереоселективность определяется 1,3-взаимодействиями в переходном состоянии, необходимом для замыкания эпоксида. [54]
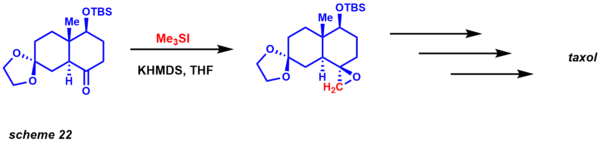
corey-chaykovsky total synthesis example
Полный синтез [ править ]
Э. Дж. Кори и его исследовательская группа выполнили множество полных синтезов . С 1950 года в группе Кори было синтезировано не менее 265 соединений. [55]
Его полный синтез нескольких простагландинов в 1969 году считается классикой. [56] [57] [58] [59] В частности, синтез простагландина F 2α представляет несколько проблем. Присутствие как цис-, так и транс- олефинов, а также пяти асимметричных атомов углерода делает эту молекулу желанной задачей для химиков-органиков. Ретросинтетический анализ Кори выделяет несколько ключевых разногласий, которые приводят к упрощенным предшественникам (схема 23).

Молекулярное упрощение началось сначала с разделения обеих углеродных цепей с помощью реакции Виттига и модификации Хорнера-Уодсворта Эммонса. Реакция Виттига дает цис- продукт, а реакция Хорнера-Уодсворта-Эммонса дает транс- олефин. Опубликованный синтез показывает диастереомерную смесь 1: 1 восстановления карбонила с использованием боргидрида цинка. Однако годы спустя Кори и его коллеги установили сокращение CBS. Одним из примеров, иллюстрирующих этот протокол, был промежуточный продукт синтеза простагландинов, показывающий смесь желаемого диастереомера 9:1 (схема 24). [33]
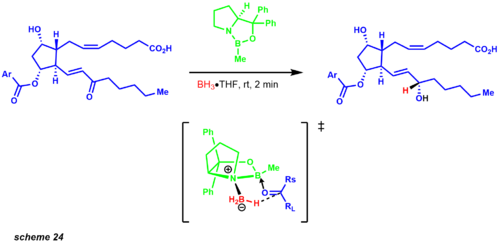
Преобразование иодолактонизации дает аллильный спирт, ведущий к ключевому промежуточному соединению Байера-Виллигера. Это окисление региоселективно вставляет атом кислорода между кетоном и наиболее богатым электронами участком. Ключевое промежуточное соединение приводит к прямому преобразованию к структурной цели Дильса-Альдера, которая обеспечивает углеродный каркас для функционализированного циклопентанового кольца. Позже Кори разработал асимметричную реакцию Дильса-Альдера с использованием хирального оксазоборолидина, что значительно упростило путь синтеза простагландинов.
Другие известные синтезы:
- Лонгифолен [60] [61]
- Гинкголиды А [62] и Б [63] [64]
- Лактацистин [65]
- Мироэстрол [66]
- Эктинэцидин 743 [67]
- Салиноспорамид А [68]
Компьютерные программы [ править ]
Кори и его исследовательская группа создали LHASA — программу, которая использует искусственный интеллект для обнаружения последовательностей реакций, которые могут привести к полному синтезу. [69] Программа была одной из первых, использовавших графический интерфейс для ввода и отображения химических структур. [70]
Публикации [ править ]
Э.Дж. Кори имеет более 1100 публикаций. [71] В 2002 году Американское химическое общество (ACS) признало его «Самым цитируемым автором по химии». В 2007 году он получил первую награду отдела публикаций ACS «Cycle of Excellence High Impact Contributor Award». [72] и был признан химиком номер один с точки зрения влияния исследований по индексу Хирша ( индекс Хирша ). [73] Его книги включают:
- Кори, Э.Дж. (2010). Энантиоселективный химический синтез: методы, логика и практика . Даллас, Техас: Прямое книгоиздание. ISBN 978-0-615-39515-9 . OCLC 868975499 .
- Кори, Э.Дж. (1995). Логика химического синтеза . Нью-Йорк: Джон Уайли. ISBN 0-471-11594-0 . ОСЛК 45734016 .
- Кори, Э.Дж. (2007). Молекулы и медицина . Хобокен, Нью-Джерси: John Wiley & Sons. ISBN 978-0-470-26096-8 . OCLC 156819246 .
- Ли, Цзе (2011). Назовите реакции в гетероциклической химии II . Хобокен, Нью-Джерси: Уайли. ISBN 978-0-470-08508-0 . OCLC 761319808 .
- Ли, Цзе (2007). Назовите реакции превращений функциональных групп . Хобокен, Нью-Джерси: Wiley-Interscience. ISBN 978-0-471-74868-7 . OCLC 85851580 .
Альтом-самоубийство [ править ]
Джейсон Алтом , один из учеников Кори, покончил жизнь самоубийством в 1998 году. [74] Самоубийство Альтома вызвало споры, поскольку он открыто обвинил в своем самоубийстве Кори, своего научного руководителя. [75] В своей прощальной записке в 1998 году Альтом назвал «жестокое обращение со стороны научных руководителей» одной из причин его самоубийства. Предсмертная записка Альтома также содержала четкие инструкции о том, как реформировать отношения между студентами и их руководителями.
Альтом был третьим сотрудником лаборатории Кори, совершившим самоубийство с 1980 года. [76] Сообщается, что Кори был опустошен и сбит с толку смертью своего ученика. [77] Кори сказал: «Это письмо не имеет смысла. В конце концов, Джейсон, должно быть, был в крайней степени бредовым или иррациональным». Кори также заявил, что никогда не подвергал сомнению интеллектуальный вклад Альтома. «Я делал все возможное, чтобы вести Джейсона, как горный гид ведет человека, поднимающегося на гору. Я старался изо всех сил на каждом этапе пути», - заявляет Кори. «Моя совесть чиста. Все, что делал Джейсон, было результатом нашего партнерства. У нас никогда не было ни малейшего разногласия». [74] Американский фонд по предотвращению самоубийств (AFSP) привел статью The New York Times о самоубийстве Альтома как пример проблемного репортажа, утверждая, что Альтом представил предупреждающие признаки депрессии и суицидальных мыслей и что статья сделала Кори козлом отпущения, несмотря на отсутствие вторичных доказательств того, что поведение советника усугубило горе Альтома. [78] [79] По данным The Boston Globe , студенты и преподаватели заявили, что Альтом фактически сохранил поддержку Кори. [77]
Члены группы Кори [ править ]
По состоянию на 2010 год членами Corey Group были около 700 человек, включая известных студентов Эрика Блока . Дэйл Л. Богер , Раджендер Редди Лелети , Уэстон Т. Борден , Дэвид Э. Кейн , Рик Л. Данхайзер , Уильям Л. Йоргенсен , Джон Каценелленбоген , Алан П. Козиковски , Брюс Х. Липшуц , Дэвид Р. Лю , Альберт Мейерс , К.С. Николау , Рёдзи Нойори , Гэри Х. Познер , Бенгт И. Самуэльссон , Дитер Сибах , Винод К. Сингх , Брайан Столц , Элис Тинг , Хисаши Ямамото , Фил Бэран и Джин-Куан Ю. База данных 580 бывших членов и их нынешней принадлежности была создана к 80-летию Кори в июле 2008 года. [80]
- Хоффмана Правила Вудворда
Получив медаль Пристли в 2004 году, Э. Дж. Кори вызвал споры, заявив, что он вдохновил Роберта Бернса Вудворда до разработки правил Вудворда-Хоффмана . Кори написал:
«4 мая 1964 года я предложил своему коллеге Р.Б. Вудворду простое объяснение, включающее симметрию возмущенных (ВЗМО) молекулярных орбиталей для стереоселективных превращений циклобутен → 1,3-бутадиен и 1,3,5-гексатриен → циклогексадиен, которые обеспечил основу для дальнейшего развития этих идей в то, что стало известно как правила Вудворда-Гоффмана». [81]
Это было первое публичное заявление Кори по поводу его утверждения о том, что начиная с 5 мая 1964 года Вудворд излагал объяснения Кори как свои собственные мысли, не упоминая Кори и разговор 4 мая. С тех пор Кори обсуждал свое заявление в частном порядке с Хоффманном и близкими коллегами. 1964. Кори упоминает, что он сделал заявление Пристли , «чтобы исторические записи были верными» . [82]
Заявление и вклад Кори были публично опровергнуты Роальдом Хоффманном в журнале Angewandte Chemie . В опровержении Хоффманн заявляет, что в ходе долгого обсуждения этого вопроса он спросил Кори, почему Кори не обнародовал этот вопрос. Кори ответил, что, по его мнению, такое публичное разногласие нанесет ущерб Гарварду, и что он «не будет рассматривать возможность сделать что-либо против Гарварда, которому я был и остаюсь так предан». Кори также надеялся, что Вудворд сам исправит исторические записи, «когда он станет старше, более внимательным и более чувствительным к своей совести». [83] Вудворд внезапно умер от сердечного приступа во сне в 1979 году.
Награды и почести [ править ]
Э. Дж. Кори получил более 40 крупных наград, включая премию Лайнуса Полинга (1973 г.), медаль Франклина (1978 г.), премию Тетраэдра (1983 г.), премию Вольфа по химии (1986 г.), Национальную медаль науки (1988 г.), премию Японии (1989 г. ). ), Нобелевская премия по химии (1990 г.), премия «Золотая тарелка» Американской академии достижений (1991 г.), [84] Премия Роджера Адамса (1993 г.) и медаль Пристли (2004 г.). [11] Он был введен в Альфа Чи Сигмы в 1998 году. Зал славы [7] По состоянию на 2008 год он был удостоен 19 почетных степеней университетов по всему миру, включая Оксфордский университет (Великобритания), Кембриджский университет (Великобритания) и Национальный университет Чунг Ченг . [85] В 2013 году в Цзянъинь, провинция Цзянсу, Китай, открылся Институт биомедицинских исследований имени Э. Дж. Кори (CIBR). [86]
Кори был избран иностранным членом Королевского общества (ForMemRS) в 1998 году . [2]
Ссылки [ править ]
- ↑ Лауреаты Японской премии. Архивировано 7 апреля 2016 года в Wayback Machine . japanprize.jp
- ^ Jump up to: Перейти обратно: а б «Профессор Элиас Кори, иностранный член ForMemRS» . Лондон: Королевское общество . Архивировано из оригинала 18 октября 2015 года.
- ^ «Нобелевская премия по химии 1990 года» . Нобелевская премия.org . Проверено 25 июля 2015 г.
- ^ Э. Дж. Кори, XM. Ченг, Логика химического синтеза , Уайли, Нью-Йорк, 1995, ISBN 0-471-11594-0 .
- ^ Jump up to: Перейти обратно: а б Кори, Э.Дж. (1991). «Логика химического синтеза: многостадийный синтез сложных карбогенных молекул (Нобелевская лекция)». Энджью. хим. Межд. Эд. англ. 30 (5): 455–465. дои : 10.1002/anie.199104553 .
- ↑ Элиас Джеймс Кори – Автобиография. Архивировано 6 июля 2008 года в Wayback Machine . nobelprize.org
- ^ Jump up to: Перейти обратно: а б Братство - Награды - Зал славы - Альфа Чи Сигма. Архивировано 26 января 2016 г. в Wayback Machine.
- ^ Кори, Э.Дж. (1990). «Автобиография Нобелевской премии» . Nobelprize.org: Официальный сайт Нобелевской премии . Проверено 9 сентября 2010 г.
- ^ «Сборник сочинений Элиаса Дж. Кори, Notes, Pfizer, К 80-летию со дня рождения» . 27 июня 2008 года . Проверено 15 ноября 2013 г.
- ^ Национальный научный фонд - Национальная медаль президента за науку. Архивировано 15 октября 2012 г., в Wayback Machine.
- ^ Jump up to: Перейти обратно: а б См. раздел «Э.Дж. Кори», «Об Э.Дж. Кори», вкладку «Основные награды». «Сборник сочинений Элиаса Дж. Кори» . 12 июля 2008 года . Проверено 15 ноября 2013 г.
- ^ Кори, Э.Дж.; Саггс, В. (1975). «Хлорохромат пиридиния. Эффективный реагент для окисления первичных и вторичных спиртов до карбонильных соединений». Тетраэдр Летт. 16 (31): 2647–2650. дои : 10.1016/s0040-4039(00)75204-x .
- ^ Кори, Э.Дж.; Богер, Д. (1978). «Реакции окислительной катионной циклизации под действием хлорхромата пиридиния». Тетраэдр Летт . 19 (28): 2461–2464. дои : 10.1016/s0040-4039(01)94800-2 .
- ^ Ян; и др. (2010). «Асимметричный полный синтез карибенола А». Журнал Американского химического общества . 132 (39): 13608–13609. дои : 10.1021/ja106585n . ПМИД 20831198 .
- ^ Кори, Э.Дж.; Венкатешварлу, А. (1972). «Защита гидроксильных групп как производных трет-бутилдиметилсилила». Дж. Ам. хим. Соц. 94 (17): 6190–6191. дои : 10.1021/ja00772a043 .
- ^ Мори; и др. (1998). «Формальный полный синтез гемибреветоксина B с помощью стратегии оксиранил-аниона». Дж. Орг. Хим . 63 (18): 6200–6209. дои : 10.1021/jo980320p . ПМИД 11672250 .
- ^ Фюрстнер; и др. (2001). «Алкиновый метатезис: разработка новой каталитической системы на основе молибдена и ее применение для полного синтеза эпотилона А и С». хим. Евро. Дж . 7 (24): 5299–5317. doi : 10.1002/1521-3765(20011217)7:24<5299::aid-chem5299>3.0.co;2-x . ПМИД 11822430 .
- ^ Коценски, PJ Protecting Groups ; Георг Тиме Верлаг: Германия, 2000 г.
- ^ Фризен, RW; и др. (1991). «Высокостереоселективное преобразование α-алленовых спиртов в производные 1,2-синаминоспиртов посредством йодокарбамации». Тетраэдр Летт . 31 (30): 4249–4252. дои : 10.1016/S0040-4039(00)97592-0 .
- ^ Имания; и др. (1992). «Простое создание α-силильных карбанионов». Тетраэдр Летт . 33 (4): 543–546. дои : 10.1016/s0040-4039(00)93991-1 .
- ^ Огилви; и др. (1974). «Селективная защита гидроксильных групп в дезоксинуклеозидах с использованием алкилсилильных реагентов». Тетраэдр Летт . 116 (33): 2865–2868. дои : 10.1016/s0040-4039(01)91764-2 .
- ^ Кадота; и др. (1998). «Стереоконтролируемый полный синтез гемибреветоксина B». Дж. Орг. Хим . 63 (19): 6597–6606. дои : 10.1021/jo9807619 .
- ^ Кори; и др. (1976). «Новый общий метод защиты гидроксильной функции». Тетраэдр Летт . 17 (11): 809–812. дои : 10.1016/s0040-4039(00)92890-9 .
- ^ Чан; и др. (1989). «Полный синтез L-659,699, нового ингибитора биосинтеза холестерина». Дж. Орг. Хим . 54 (24): 5708–5712. дои : 10.1021/jo00285a017 .
- ^ Jump up to: Перейти обратно: а б Кори; и др. (1982). «Тотальный синтез аплазмомицина». Журнал Американского химического общества . 104 (24): 6818–6820. дои : 10.1021/ja00388a074 .
- ^ Кори, Э.Дж.; Зеебах, Д. (1965). «Синтез производных 1,n-дикарбонила с использованием карбанионов из 1,3-дитианов». Энджью. хим. Межд. Эд . 4 (12): 1077–1078. дои : 10.1002/anie.196510771 .
- ^ Вендт, КУ; Шульц, GE; Лю, доктор медицинских наук; Кори, Э.Дж. (2000). «Ферментные механизмы образования полициклических тритерпенов». Angewandte Chemie International Edition на английском языке . 39 (16): 2812–2833. doi : 10.1002/1521-3773(20000818)39:16<2812::aid-anie2812>3.3.co;2-r . ПМИД 11027983 .
- ^ См. вкладку «Методы». «Сборник сочинений Элиаса Дж. Кори» . 12 июля 2008 года . Проверено 15 ноября 2013 г.
- ^ Кори, Э.Дж.; и др. (1998). «Восстановление карбонильных соединений с помощью хиральных оксазаборолидиновых катализаторов: новая парадигма энантиоселективного катализа и новый мощный синтетический метод». Энджью. хим. Межд. Эд . 37 (15): 1986–2012. doi : 10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z . ПМИД 29711061 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час Курти, Л.; Чако, Б. Стратегическое применение названных реакций в органическом синтезе ; Эльзевир: Берлингтон, 2005.
- ^ Jump up to: Перейти обратно: а б с д Кори, Э.Дж.; Курти, Л. Энантиоселективный химический синтез ; Прямое книгоиздание: Даллас, 2010 г.
- ^ Кори, Э.Дж.; Бакши, РК; Шибата, С. (1987). «Высокоэнантиоселективное восстановление кетонов бораном, катализируемое хиральными оксазаборолидинами. Механизм и синтетические последствия». Журнал Американского химического общества . 109 (18): 5551–5553. дои : 10.1021/ja00252a056 .
- ^ Jump up to: Перейти обратно: а б с Кори; и др. (1987). «Стабильный и легко приготовляемый катализатор энантиоселективного восстановления кетонов. Применение в многостадийном синтезе». Журнал Американского химического общества . 109 (25): 7925–7926. дои : 10.1021/ja00259a075 .
- ^ Кори, Э.Дж.; Робертс, Б.Э. (1997). «Тотальный синтез дизидиолида». Журнал Американского химического общества . 119 (51): 12425–12431. дои : 10.1021/ja973023v .
- ^ Кори, Э.Дж.; Фух, П.Л. Тетраэдр Летт. 1972 , 3769
- ^ Эймери и др. Synthesis 2000 , 185.
- ^ Мишель; и др. (1999). «Однореакторный метод синтеза алкинов и бромалкинов из альдегидов». Тетраэдр Летт . 40 (49): 8575–8578. дои : 10.1016/s0040-4039(99)01830-4 .
- ^ Донкервоот; и др. (1996). «Разработка модифицированных реакций Паусона-Ханда с этиленом и использование в полном синтезе (+)-тейлориона». Тетраэдр . 52 (21): 7391–7420. дои : 10.1016/0040-4020(96)00259-1 .
- ^ Jump up to: Перейти обратно: а б Кори, Э.Дж.; Ким, CU (1972). «Новый и высокоэффективный метод окисления первичных и вторичных спиртов до карбонильных соединений». Журнал Американского химического общества . 94 (21): 7586–7587. дои : 10.1021/ja00776a056 .
- ^ Э. Дж. Кори; CU Ким (1974). «Способ окисления втор-трет-1,2-диолов до α-гидроксикетонов без углерод-углеродного расщепления». Буквы тетраэдра . 15 (3): 287–290. дои : 10.1016/S0040-4039(01)82195-X .
- ^ Кувадзима; и др. (2003). «Тотальный синтез ингенола». Журнал Американского химического общества . 125 (6): 1498–1500. дои : 10.1021/ja029226n . ПМИД 12568608 .
- ^ Кори, Э.Дж.; Зима, А.Е. (1963). «Новый стереоспецифический синтез олефинов из 1,2-диолов». Журнал Американского химического общества . 85 (17): 2677–2678. дои : 10.1021/ja00900a043 .
- ^ Блок (1984). «Синтез олефинов путем дезоксигенации вицинальных диолов». Органические реакции . Том. 30. с. 457. дои : 10.1002/0471264180.or030.02 . ISBN 978-0-471-26418-7 .
- ^ Шинг; и др. (1998). «Энантиоспецифические синтезы (+)-кротепоксида, (+)-боэзеноксида, (+)-β-сенэпоксида, (+)-пипоксида ацетата, (-)- изо-кротепоксида, (-)-сенэпоксида и (-)- Тинганооксид из (-)-хинной кислоты 1". Дж. Орг. Хим . 63 (5): 1547–1554. дои : 10.1021/jo970907o .
- ^ Наир; и др. (2007). «Внутримолекулярные реакции 1,3-диполярного циклоприсоединения в целевых синтезах». Тетраэдр . 63 (50): 12247–12275. дои : 10.1016/j.tet.2007.09.065 .
- ^ Кори, Э.Дж.; и др. (2004). «Энантиоселективные и структурно-селективные реакции Дильса-Альдера несимметричных хинонов, катализируемые хиральным катионом оксазаборолидиния. Правила прогнозирующего отбора». Дж. Ам. хим. Соц . 126 (15): 4800–4802. дои : 10.1021/ja049323b . ПМИД 15080683 .
- ^ Кори; и др. (1994). «Демонстрация синтетической силы катализируемых оксазаборолидином энантиоселективных реакций Дильса-Альдера с помощью очень эффективных путей получения кассиола и гибберелловой кислоты». Дж. Ам. хим. Соц . 116 (8): 3611–3612. дои : 10.1021/ja00087a062 .
- ^ Кори; и др. (1975). «Синтез новых макроциклических лактонов из ряда простагландинов и полиэфирных антибиотиков». Журнал Американского химического общества . 97 (3): 653–654. дои : 10.1021/ja00836a036 . ПМИД 1133366 .
- ^ Николау, КЦ (1977). «Синтез макролидов». Тетраэдр . 33 (7): 683–710. дои : 10.1016/0040-4020(77)80180-4 .
- ^ Шин, Инджи; Хонг, Сукчан; Крише, Майкл Дж. (2 ноября 2016 г.). «Полный синтез свинхолида А: описание образования связи C – C, опосредованного водородом» . Журнал Американского химического общества . 138 (43): 14246–14249. дои : 10.1021/jacs.6b10645 . ISSN 0002-7863 . ПМК 5096380 . ПМИД 27779393 .
- ^ Jump up to: Перейти обратно: а б Кори, Э.Дж.; Николау, КЦ (1974). «Эффективный и мягкий лактонизационный метод синтеза макролидов». Журнал Американского химического общества . 96 (17): 5614–5616. дои : 10.1021/ja00824a073 .
- ^ Кори, Э.Дж.; Чайковский (1962). «Диметилсульфоксоний метилид». Журнал Американского химического общества . 84 (5): 867–868. дои : 10.1021/ja00864a040 .
- ^ Кори, Э.Дж.; Чайковский (1965). «Метилид диметилоксосульфония ((CH 3 ) 2 SOCH 2 ) и метилид диметилсульфония ((CH 3 ) 2 SCH 2 ). Образование и применение в органическом синтезе». Журнал Американского химического общества . 87 (6): 1353–1364. дои : 10.1021/ja01084a034 .
- ^ Данишевский; и др. (1996). «Тотальный синтез баккатина III и таксола». Журнал Американского химического общества . 118 (12): 2843–2859. дои : 10.1021/ja952692a .
- ^ См. вкладку «Синтез». «Сборник сочинений Элиаса Дж. Кори» . ejcorey.org. 12 июля 2008 года . Проверено 15 ноября 2013 г.
- ^ Кори, Э.Дж.; Вайншенкер, Нью-Мексико; Шааф, ТК; Хубер, В. (1969). «Стереоконтролируемый синтез dl-простагландинов F2.alpha. и E2». Дж. Ам. хим. Соц. 91 (20): 5675–5677. дои : 10.1021/ja01048a062 . ПМИД 5808505 .
- ^ KC Николау , Э.Дж. Соренсен, Классика в полном синтезе , VCH, Нью-Йорк, 1996, ISBN 3-527-29231-4 .
- ^ Кори, Э.Дж.; Шааф, ТК; Хубер, В.; Колликер, В.; Вайншенкер, Нью-Мексико (1970). «Полный синтез простагландинов F 2α и E 2 как встречающихся в природе форм». Журнал Американского химического общества . 92 (2): 397–8. дои : 10.1021/ja00705a609 . ПМИД 5411057 .
- ^ Обзор см. в Axen, U.; Пайк, JE; и Шнайдер, WP (1973), с. 81 в «Полном синтезе натуральных продуктов» , Vol. 1, Апсаймон, Дж.В. (ред.) Уайли, Нью-Йорк.
- ^ Кори, Э.Дж.; Оно, М.; Ватакенчерри, Пенсильвания; Митра, РБ (1961). «ПОЛНЫЙ СИНТЕЗ d,l-ЛОНГИФОЛЕНА». Дж. Ам. хим. Соц. 83 (5): 1251–1253. дои : 10.1021/ja01466a056 .
- ^ Кори, Э.Дж.; Оно, М.; Митра, РБ; Ватакенчерри, Пенсильвания (1964). «Тотальный синтез лонгифолена». Дж. Ам. хим. Соц. 86 (3): 478–485. дои : 10.1021/ja01057a039 .
- ^ Кори, Э.Дж.; Гош, АК (1988). «Тотальный синтез гинкголида А» . Тетраэдр Летт. 29 (26): 3205–3206. дои : 10.1016/0040-4039(88)85122-0 . ПМК 6781876 . ПМИД 31595095 .
- ^ Кори, Э.Дж.; Канг, М.; Десаи, MC; Гош, АК; Упис, Индиана (1988). «Тотальный синтез (.+-.)-гинкголида Б» . Дж. Ам. хим. Соц. 110 (2): 649–651. дои : 10.1021/ja00210a083 . ПМК 6746322 . ПМИД 31527923 .
- ^ Кори, Э.Дж. (1988). «Лекция Роберта Робинсона. Ретросинтетическое мышление? Основы и примеры». хим. Соц. Откр. 17 : 111–133. дои : 10.1039/cs9881700111 .
- ^ Кори, Э.Дж.; Райхард, Джорджия (1992). «Тотальный синтез лакцистина». Дж. Ам. хим. Соц. 114 (26): 10677–10678. дои : 10.1021/ja00052a096 .
- ^ Кори, Э.Дж.; Ву, Ли (1993). «Энантиоселективный общий синтез мироэстрола». Дж. Ам. хим. Соц. 115 (20): 9327–9328. дои : 10.1021/ja00073a074 .
- ^ Кори, Э.Дж.; Джин, ДЮ; Кания, РС (1996). «Энантиоселективный общий синтез эктинэсайдина 743». Дж. Ам. хим. Соц. 118 (38): 9202–9203. дои : 10.1021/ja962480t .
- ^ Редди Лелети, Раджендер; Кори, Э.Дж. (2004). «Простой стереоконтролируемый синтез салиноспорамида А». Дж. Ам. хим. Соц. 126 (20): 6230–6232. CiteSeerX 10.1.1.472.2554 . дои : 10.1021/ja048613p . ПМИД 15149210 .
- ^ Кори, Э.Дж.; Випке, В. Тодд; Крамер, Ричард Д.; Хоу, В. Джеффри (1 января 1972 г.). «Компьютерный синтетический анализ. Удобная человеко-машинная связь химической структуры с помощью интерактивной компьютерной графики» . Журнал Американского химического общества . 94 (2): 421–430. дои : 10.1021/ja00757a020 . ISSN 0002-7863 .
- ^ Ван, Чжуан; Чжан, Вэньхан; Лю, Бо (26 июня 2021 г.). «Вычислительный анализ синтетического планирования: прошлое и будущее» . Китайский химический журнал . 39 (11): 3127–3143. дои : 10.1002/cjoc.202100273 . ISSN 1001-604X .
- ^ См. Публикации в «Сборник сочинений Элиаса Дж. Кори» . ejcorey.org. 15 ноября 2013 года . Проверено 15 ноября 2013 г.
- ^ Баум, Руди (21 августа 2007 г.). «Э.Дж. Кори: выдающийся химик» . Блог собрания C&EN, 234-е национальное собрание и выставка ACS, 19–23 августа 2007 г., Бостон, Массачусетс . Проверено 8 сентября 2010 г.
- ^ Ван Ноорден, Ричард (23 апреля 2007 г.). «Индекс Хирша оценивает лучших химиков» . RSC: Развитие химических наук, Мир химии . Проверено 9 сентября 2010 г.
- ^ Jump up to: Перейти обратно: а б Шнайдер, Элисон (1998). «Гарвард сталкивается с последствиями самоубийства аспиранта» . Хроника высшего образования . Проверено 21 августа 2010 г.
- ^ Холл, Стивен С. (29 ноября 1998 г.). «Смертельная химия в Гарварде» . Нью-Йорк Таймс .
- ^ Холл, Стивен (29 декабря 1998 г.). «Смертельная химия в Гарварде» . Нью-Йорк Таймс . Проверено 26 сентября 2020 г.
- ^ Jump up to: Перейти обратно: а б Английский, Белла. «Самоубийства аспирантов вызывают большие изменения в химических лабораториях Гарварда» . Архивировано из оригинала 24 января 2001 года . Проверено 24 ноября 2010 г.
{{cite web}}: CS1 maint: bot: статус исходного URL неизвестен ( ссылка ) , The Boston Globe через Archive.org (2 января 2001 г.). - ^ «Для средств массовой информации: примеры хороших и проблемных репортажей, поиск козлов отпущения, журнал New York Times: смертельная химия в Гарварде» . Американский фонд по предотвращению самоубийств (AFSP). 2010. Архивировано из оригинала 25 сентября 2006 года . Проверено 4 ноября 2012 г.
- ^ AFSP неправильно идентифицирует автора и дату статьи в The New York Times как Кейт Б. Ричберг и 28 ноября 1998 г. Автором был Стивен С. Холл, а датой публикации было 29 ноября 1998 г. Ч, Ч; МА (2010). «Для СМИ: проблемные репортажи, поиск козлов отпущения» . Американский фонд по предотвращению самоубийств (AFSP). Архивировано из оригинала 25 сентября 2006 года . Проверено 21 августа 2010 г.
- ^ «Члены группы: Элиас Джеймс Кори» . ejcorey.org . Проверено 22 июля 2021 г.
- ^ См. вкладку Э. Дж. Кори, «Невозможные мечты». Кори, Э.Дж. (30 апреля 2004 г.). «Неосуществимые мечты» . Том. 69, нет. 9. Перспектива JOC. стр. 2917–2919 . Проверено 10 сентября 2010 г.
- ^ Джонсон, Кэролайн Ю. (1 марта 2005 г.). «Чья это была идея?» . Бостон Глобус . Архивировано из оригинала 11 января 2012 года . Проверено 10 сентября 2010 г.
- ^ Хоффман, Роальд (10 декабря 2004 г.). «Заявление о развитии пограничных орбитальных объяснений электроциклических реакций» . Angewandte Chemie, международное издание . 43 (48): 6586–6590. дои : 10.1002/anie.200461440 . ПМИД 15558636 .
- ^ «Обладатели Золотой пластины Американской академии достижений» . www.achievement.org . Американская академия достижений .
- ^ См. Э. Дж. Кори, «Об Э. Дж. Кори», вкладку «Почетные степени». «Сборник сочинений Элиаса Дж. Кори» . 12 июля 2008 года . Проверено 15 ноября 2013 г.
- ^ «Торжественная церемония открытия Института биомедицинских исследований имени Э. Дж. Кори (CIBR)» . Институт биомедицинских исследований им. Э. Дж. Кори. 29 июня 2013. Архивировано из оригинала 20 июня 2015 года . Проверено 26 августа 2013 г.
Внешние ссылки [ править ]
- 1928 рождений
- Живые люди
- Члены Национальной академии наук США
- Американские химики 20-го века
- Американские химики XXI века
- Американские химики-органики
- Американцы ливанского происхождения
- Нобелевские лауреаты по химии
- Американские нобелевские лауреаты
- Преподаватели Гарвардского университета
- Лауреаты премии Вольфа по химии
- Выпускники Школы наук Массачусетского технологического института
- Лауреаты Национальной медали науки
- Иностранные члены Королевского общества
- Факультет Университета Иллинойса Урбана-Шампейн
- Жители Метуэна, Массачусетс
- Выпускники средней школы Лоуренса (Массачусетс)
- Члены Национальной Медицинской Академии
- Лауреаты медали Франклина



![[3,3] перегруппировка с PCC](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/PCC_rearrangement3.png/700px-PCC_rearrangement3.png)



















