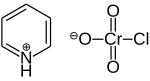
Хлорохромат пиридиния
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Хлорохромат пиридиния | |||
| Другие имена ПКК; Реактив Кори-Саггса | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.043.253 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 5 Н 6 ClCrNO 3 | |||
| Молярная масса | 215.56 g/mol | ||
| Появление | желто-оранжевое твердое вещество [1] | ||
| Температура плавления | 205 ° C (401 ° F; 478 К) | ||
| Растворимость в других растворителях | растворим в ацетоне , ацетонитриле , ТГФ | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Токсичный, окислитель, канцероген, сильный загрязнитель окружающей среды. | ||
| СГС Маркировка : | |||
    | |||
| Опасность | |||
| Х272 , Х317 , Х350 , Х410 | |||
| П201 , П221 , П273 , П280 , П302+П352 , П308+П313 | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | внешний паспорт безопасности | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||

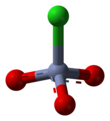
Хлорохромат пиридиния ( PCC ) представляет собой желто-оранжевую [ C соль формулы 5 H 5 NH ] + [CrO 3 Cl] − . Это реагент в органическом синтезе используемый в основном для окисления спиртов , с образованием карбонилов . Известно множество родственных соединений со схожей реакционной способностью. PCC предлагает преимущество селективного окисления спиртов до альдегидов или кетонов, тогда как многие другие реагенты менее селективны. [1]
Структура и подготовка [ править ]
PCC состоит из катиона пиридиния [C 5 H 5 NH] + и тетраэдрический хлорхромат-анион [CrO 3 Cl] − . Также известны родственные соли, такие как хлорхромат 1-бутилпиридиния, [C 5 H 5 N(C 4 H 9 )][CrO 3 Cl] и хлорхромат калия .
PCC коммерчески доступен. Обнаруженный случайно , [3] Первоначально реагент был приготовлен добавлением пиридина к холодному раствору триоксида хрома в концентрированной соляной кислоте : [4]
- C 5 H 5 N + HCl + CrO 3 → [C 5 H 5 NH][CrO 3 Cl]
В одном альтернативном методе образование дыма хромилхлорида (CrO 2 Cl 2 ) во время приготовления вышеупомянутого раствора было сведено к минимуму за счет простого изменения порядка добавления: к твердому триоксиду хрома при перемешивании добавляли холодный раствор пиридина в концентрированной соляной кислоте. . [5]
Использует [ править ]
Окисление спиртов [ править ]
PCC используется в качестве окислителя . В частности, он доказал свою высокую эффективность при окислении первичных и вторичных спиртов до альдегидов и кетонов соответственно. Реагент более селективен, чем родственный реагент Джонса , поэтому вероятность чрезмерного окисления с образованием карбоновых кислот при использовании подкисленного перманганата калия мала, пока в реакционной смеси не присутствует вода. Типичное окисление PCC включает добавление спирта к суспензии PCC в дихлорметане . [6] [7] [8] Общая реакция такая:
- 2 [C 5 H 5 NH][CrO 3 Cl] + 3 R 2 CHOH → 2 [C 5 H 5 NH]Cl + Cr 2 O 3 + 3 R 2 C=O + 3 H 2 O
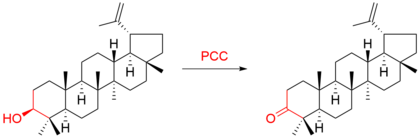
Например, тритерпен лупеол окислился до лупенона : [9]
Окисление Баблера [ править ]
С третичными спиртами сложный эфир хромовой кислоты , образующийся из PCC, может изомеризоваться посредством и [3,3]-сигматропной реакции последующее окисление дает енон в реакции, известной как окисление Баблера:

Этот тип реакции окислительной транспозиции был использован синтетически, например, для синтеза морфина . [10]
Использование других распространенных окислителей вместо ПКК обычно приводит к обезвоживанию, поскольку такие спирты не могут быть окислены напрямую.
Другие реакции [ править ]
PCC также превращает подходящие ненасыщенные спирты и альдегиды в циклогексеноны . Этот путь, окислительная катионная циклизация, иллюстрируется превращением (-)- цитронеллола в (-)- пулегон .
PCC также влияет на аллильное окисление , например, при превращении дигидрофуранов в фураноны . [1]
Сопутствующие реагенты [ править ]
Другие более удобные или менее токсичные реагенты для окисления спиртов включают диметилсульфоксид , который используется в окислениях Сверна и Пфицнера-Моффата , и соединения гипервалентного йода , такие как периодинан Десс-Мартина .
Безопасность [ править ]
Одним из недостатков использования PCC является его токсичность, которую он разделяет с другими соединениями шестивалентного хрома .
См. также [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с Пианкателли, Г.; Луццио, Ф.А. (2007). «Пиридиния хлорохромат». Электронная энциклопедия реагентов для органического синтеза EROS . Джон Уайли и сыновья. дои : 10.1002/9780470842898.rp288.pub2 . ISBN 978-0471936237 .
- ^ «Паспорт безопасности» . Акрос Органикс . 2015 . Проверено 10 июня 2016 г.
- ^ Лоу, Дерек . «Старые вещи» . В Трубопроводе . Наука . Проверено 21 ноября 2015 г.
- ^ Кори, Э.Дж.; Саггс, JW (1975). «Хлорохромат пиридиния. Эффективный реагент для окисления первичных и вторичных спиртов до карбонильных соединений». Буквы тетраэдра . 16 (31): 2647–2650. doi : 10.1016/S0040-4039(00)75204-X .
- ^ Агарвал, С.; Тивари, HP; Шарма, JP (1990). «Хлорохромат пиридиния: усовершенствованный метод его синтеза и использование безводной уксусной кислоты в качестве катализатора реакций окисления». Тетраэдр . 46 (12): 4417–4420. дои : 10.1016/S0040-4020(01)86776-4 .
- ^ Пакетт, Луизиана; Эрл, MJ; Смит, Г. Ф. (1996). «(4R ) -(+)- трет -Бутилдиметилсилокси-2-циклопентен-1-он» . Органические синтезы . 73:36 ; Сборник томов , т. 9, с. 132 .
- ^ Ту, Ю.; Фрон, М.; Ван, З.-Х.; Ши, Ю. (2003). «Синтез 1,2:4,5-Ди -О -изопропилиден-D-эритро-2,3-гексодиуло-2,6-пиранозы. Высокоэнантиоселективный кетоновый катализатор эпоксидирования» . Органические синтезы . 80 :1 .
- ^ Уайт, Джей Ди; Гретер, UM; Ли, К.-С. (2005). «( R )-(+)-3,4-Диметилциклогекс-2-ен-1-он» . Органические синтезы . 82 :108 ; Сборник томов , т. 11, с. 100 .
- ^ Лао, А.; Фудзимото, Ю.; Тацуно, Т. (1984). «Исследования компонентов Artemisia argyi Lévl & Vant» . Химико-фармацевтический вестник . 32 (2): 723–727. дои : 10.1248/cpb.32.723 . Проверено 5 июня 2016 г.
- ^ Киллоран, Патрик М.; Россингтон, Стивен Б.; Уилкинсон, Джеймс А.; Хэдфилд, Джон А. (2016). «Расширение возможностей окисления Баблера – Даубена: 1,3-окислительная транспозиция вторичных аллильных спиртов» . Буквы тетраэдра . 57 (35): 3954–3957. дои : 10.1016/j.tetlet.2016.07.076 .
Дальнейшее чтение [ править ]
- Тодзё, Г.; Фернандес, М. (2006). Тодзё, Г. (ред.). Окисление спиртов до альдегидов и кетонов: Руководство по современной практике . Основные реакции органического синтеза. Нью-Йорк: Спрингер . ISBN 978-0-387-23607-0 .