Селенорганическая химия
Селенорганическая химия — наука, изучающая свойства и реакционную способность селенорганических соединений , химических соединений, содержащих углерод - селен химические связи . [1] [2] [3] Селен вместе с кислородом и серой принадлежит к элементам 16-й группы или халькогенам, и следует ожидать сходства в химии. Селенорганические соединения обнаруживаются в следовых количествах в окружающих водах, почвах и отложениях. [4]
Селен может существовать со степенью окисления -2, +2, +4, +6. Se(II) является доминирующей формой в селенорганической химии. Внизу по колонке группы 16 прочность связи становится все слабее (234 кДж / моль для связи C−Se и 272 кДж/моль для C-S связь ), а длина связи больше ( C−Se 198 вечера, CS 181 вечера и С-О 141 пм). Соединения селена более нуклеофильны , чем соответствующие соединения серы, а также более кислые. p K a Значения XH 2 составляют 16 для кислорода, 7 для серы и 3,8 для селена. В отличие от сульфоксидов , соответствующие селеноксиды нестабильны в присутствии β-протонов, и это свойство используется во многих органических реакциях селена, особенно при окислении селеноксида и отщеплении селеноксида.
Первым селенорганическим соединением, выделенным в 1836 году, был диэтилселенид . [5] [6]
Структурная классификация селенорганических соединений
[ редактировать ]
- Селенолы ( R-SeH ) — селеновые эквиваленты спиртов и тиолов . Эти соединения относительно нестабильны и обычно имеют неприятный запах. Бензолселенол (также называемый селенофенолом или PhSeH) более кислый ( pKa тиофенол 5,9 ), чем ( pKa 6,5 ) , а также легче окисляется до диселенида . Селенофенол получают восстановлением дифенилдиселенида. [7]
- Диселениды ( R-Se-Se-R ) — селеновые эквиваленты пероксидов и дисульфидов . Они являются полезными стабильными при хранении предшественниками более реакционноспособных селенорганических реагентов, таких как селенолы и селанилгалогениды. Наиболее известен в органической химии дифенилдиселенид , получаемый из бромида фенилмагния и селена с последующим окислением продукта PhSeMgBr. [8]
- Селанилгалогениды ( R-Se-Cl, R-Se-Br ) получают галогенированием диселенидов. Бромирование дифенилдиселенида дает фенилселенилбромид (PhSeBr). Эти соединения являются источниками « PhSe + ".
- Селениды ( R-Se-R ), также называемые селеноэфирами , представляют собой селеновые эквиваленты простых эфиров и сульфидов . Одним из примеров является диметилселенид ( (СН 3 ) 2 Se ). Это наиболее распространенные селенорганические соединения. Симметричные селениды обычно получают алкилированием солей селенидов щелочных металлов, например селенида натрия . Несимметричные селениды получают алкилированием селеноатов. Эти соединения обычно реагируют как нуклеофилы , например, с алкилгалогенидами ( R'-X ) с образованием солей селена . [RR'R"Se] + Х − . Двухвалентный селен также может взаимодействовать с мягкими гетероатомами с образованием центров гипервалентного селена. [6] В некоторых случаях они также реагируют как электрофилы, например, с литийорганическими реагентами (R'Li) на атный комплекс. Р'RRSe − Что + .
- Селеноксиды ( R-Se(=O)-R ) представляют собой селеновые эквиваленты сульфоксидов . Большинство из них нестабильны и подвергаются отщеплению селеноксида , но теоретически могут окисляться до селенонов. R-Se(=O) 2 -R , селеновые аналоги сульфонов .
- Селененовая кислота ( R-Se-OH ) являются промежуточными продуктами окисления селенолов. Они встречаются в некоторых селеноферментах, таких как глутатионпероксидаза .
- Селениновые кислоты ( R-Se(=O)-OH ) являются аналогами сульфиновых кислот .
- Селеновые кислоты ( R-Se(=O) 2 -OH ) являются аналогами сульфоновых кислот .
- Пероксиселениновые кислоты ( R-Se(=O)-OOH ) катализирует реакции эпоксидирования и окисления Байера-Виллигера .
- Селенураны представляют собой гипервалентные селенорганические соединения, формально полученные из тетрагалогенидов, таких как SeCl 4 . Примеры типа Ar-SeCl 3 . [9] Хлориды получают хлорированием селененилхлорида .
- Селенираны представляют собой трехчленные кольца (исходное соединение — селениран или селенациклобутан). C 2 H 4 Se ), родственные тииранам , но, в отличие от тииранов, селенираны кинетически нестабильны, вытесняя селен напрямую (без окисления) с образованием алкенов . Это свойство было использовано в синтетической органической химии. [10]
- Марки ( R 2 C=Se ) — селеновые аналоги кетонов. Они редки из-за склонности к олигомеризации . [11] Диселенобензохинон стабилен в виде металлокомплекса. [12] Селеномочевина является примером стабильного соединения, содержащего связь C=Se.
- Тиоселениды ( R-Se-S-R ), соединения со связями селен(II)–сера(II), аналогичные дисульфидам .
Селенорганические соединения в природе
[ редактировать ]Селен в форме селенорганических соединений является важным микроэлементом, отсутствие которого в рационе вызывает дисфункцию сердечной мышцы и скелета. Селенорганические соединения необходимы для защиты клеток от окислительного повреждения и правильного функционирования иммунной системы. Они также могут играть роль в предотвращении преждевременного старения и рака. Источником селена, используемого в биосинтезе, является селенофосфат .
Глутатионоксидаза представляет собой фермент, в активном центре которого находится селенол. Селенорганические соединения обнаружены в высших растениях. Например, при анализе чеснока методом высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией с индуктивно-связанной плазмой (ВЭЖХ-ИСП-МС) было обнаружено, что γ-глутамил- Se- основным Se-содержащим компонентом является метилселеноцистеин. наряду с меньшим количеством Se -метилселеноцистеина . Следовые количества диметилселенида и аллилметилселенида обнаруживаются в дыхании человека после употребления сырого чеснока. [13]
Селеноцистеин и селенометионин
[ редактировать ]Селеноцистеин , называемый двадцать первой аминокислотой, необходим для синтеза белка, управляемого рибосомами, в некоторых организмах. [14] В настоящее время известно более 25 селенсодержащих белков (селенопротеинов). [15] Большинство селен-зависимых ферментов содержат селеноцистеин , который родственен аналогу цистеина , но в нем селен заменяет серу. Эта аминокислота ДНК кодируется особым образом . Селеносульфиды также предлагаются в качестве биохимических промежуточных продуктов.
Селенометионин — это селенидсодержащая аминокислота, которая также встречается в природе, но образуется путем посттранскрипционной модификации.
Селенорганическая химия в органическом синтезе
[ редактировать ]Селенорганические соединения представляют собой специализированный, но полезный набор реагентов, полезных в органическом синтезе, хотя их обычно исключают из процессов, полезных для фармацевтики, из-за проблем регулирования. Их полезность зависит от определенных атрибутов, в том числе
- слабость C-Se и связь
- легкое окисление соединений двухвалентного селена.
Виниловые селениды
[ редактировать ]Виниловые селениды представляют собой селенорганические соединения, которые играют роль в органическом синтезе, особенно в разработке удобных стереоселективных путей получения функционализированных алкенов . [16] Хотя для получения виниловых селенидов упоминаются различные методы, более полезная процедура сосредоточена на нуклеофильном или электрофильном присоединении селенорганического соединения к концевым или внутренним алкинам . [17] [18] [19] [20] Например, нуклеофильное присоединение селенофенола к алкинам предпочтительно дает Z-виниловые селениды после более длительного времени реакции при комнатной температуре. Реакция протекает быстрее при высокой температуре; однако смесь Z- и E-винилселенидов была получена в соотношении почти 1:1. [21] С другой стороны, аддукты зависят от природы заместителей при тройной связи . И наоборот, виниловые селениды могут быть получены катализируемым палладием гидроселенированием алкинов с получением аддукта Марковникова с хорошими выходами. Существуют некоторые ограничения, связанные с методологиями получения виниловых селенидов, проиллюстрированными выше; в описанных процедурах в качестве исходных материалов используются диорганоилдиселениды или селенофенол , которые летучи, нестабильны и имеют неприятный запах. Кроме того, получение этих соединений является сложным.
Селеноксидное окисление
[ редактировать ]Диоксид селена полезен при окислении органических веществ . Конкретно, SeO 2 превратит аллильную метиленовую группу в соответствующий спирт . Эту реакцию вызывают ряд других реагентов.

Что касается механизма реакции , то SeO 2 и аллильный субстрат реагируют посредством перициклического процесса, начиная с еновой реакции , которая активирует C-H Связь . Второй этап представляет собой [2,3] -сигматропную реакцию . Окисления с участием диоксида селена часто осуществляют с использованием каталитических количеств соединения селена и в присутствии жертвующего катализатора или соокислителя, такого как перекись водорода .
Окисления на основе SeO 2 иногда приводят к образованию карбонильных соединений, таких как кетоны , [22] β- Пинен [23] и окисление циклогексанона до 1,2-циклогександиона. [24] Окисление кетонов, имеющих α-метиленовые группы, дает дикетоны. Этот тип окисления оксидом селена называется окислением Райли . [25]
Удаление селеноксида
[ редактировать ]В присутствии β-водорода селенид после окисления дает реакцию отщепления , оставляя после себя алкен и SeO -селенопероксол . SeO - селенопероксол обладает высокой реакционной способностью и не выделяется как таковой. В реакции элиминирования все пять участвующих реакционных центров компланарны и , следовательно, стереохимия реакции является синической . В качестве окислителей используются перекись водорода , озон или MCPBA . Этот тип реакции часто используется с кетонами, приводящими к енонам . Примером является удаление ацетилциклогексанона бензолселенилхлоридом и гидридом натрия . [26]
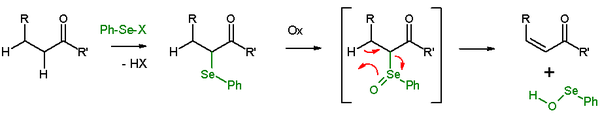
Элиминирование Греко представляет собой аналогичное удаление селеноксида с использованием о-нитрофенилселеноцианата и трибутилфосфина, вызывающее удаление элементов Н 2 О.
Ссылки
[ редактировать ]- ^ А. Криф, Л. Хевеси, Селенорганическая химия I. Преобразования функциональных групп ., Springer, Берлин, 1988. ISBN 3-540-18629-8
- ^ С. Патай, З. Раппопорт (ред.), Химия органических соединений селена и теллура , Джон. Wiley and Sons, Чичестер, Том. 1, 1986 г. ISBN 0-471-90425-2
- ^ Полмье, К. Селеновые реагенты и промежуточные соединения в органическом синтезе ; Болдуин, Дж. Э., Ред.; Pergamon Books Ltd.: Нью-Йорк, 1986 г. ISBN 0-08-032484-3
- ^ Вальшлегер, Д.; Фельдманн, Ф. (2010). Образование, распространение, значение и анализ селенорганических и теллурорганических соединений в окружающей среде . Ионы металлов в науках о жизни. Том. 7. Металлоорганические соединения в окружающей среде и токсикологии. Издательство РСК. стр. 319–364. ISBN 978-1-84755-177-1 .
- ^ Лёвиг, CJ (1836). «О сероводороде и гидроэфире селена». Анналы физики . 37 (3): 550–553. Бибкод : 1836АнП...113..550Л . дои : 10.1002/andp.18361130315 .
- ^ Перейти обратно: а б Мукерджи, Анна Дж.; Заде, Санджио С.; Сингх, Харкеш Б.; Сунодж, Рагхаван Б. (2010). «Селеорганическая химия: роль внутримолекулярных взаимодействий». Химические обзоры . 110 (7): 4357–4416. дои : 10.1021/cr900352j . ПМИД 20384363 .
- ^ Органические синтезы , Сб. Том. 3, с. 771 (1955); Том. 24, с. 89 (1944) Интернет-статья .
- ^ Органические синтезы , Сб. Том. 6, с. 533 (1988); Том. 59, с. 141 (1979) Статья
- ^ Химия гипервалентных соединений (1999) Кин-я Акиба ISBN 978-0-471-24019-8
- ^ Ссылка Развитие химии селенахетероциклических соединений, имеющих практическое значение для синтеза и медицинской биологии Arkivoc 2006 (JE-1901MR) Яцек Млоховски, Кристиан Клоц, Рафал Лисяк, Петр Потачек и Галина Войтович
- ^ Оказаки, Р.; Токито, Н. (2000). «Тяжелые кетоны, более тяжелые элементы, родственные кетону». Отчеты о химических исследованиях . 33 (9): 625–630. дои : 10.1021/ar980073b . ПМИД 10995200 .
- ^ Амури, Х.; Мусса, Дж.; Ренфрю, АК; Дайсон, ПиДжей; Рейджер, Миннесота; Шаморо, Л.-М. (2010). «Открытие, структура и противораковая активность иридиевого комплекса диселенобензохинона». Angewandte Chemie, международное издание . 49 (41): 7530–7533. дои : 10.1002/anie.201002532 . ПМИД 20602399 .
- ^ Блок, Э. (2010). Чеснок и другие луки: знания и наука . Королевское химическое общество. ISBN 978-0-85404-190-9 .
- ^ Эксли, MJ; Бёк, А.; Штадтман, ТК (1991). «Каталитические свойства Escherichia coli мутанта формиатдегидрогеназы , в котором сера заменяет селен» . Учеб. Натл. акад. наук. США . 88 (19): 8450–8454. Бибкод : 1991PNAS...88.8450A . дои : 10.1073/pnas.88.19.8450 . ПМК 52526 . ПМИД 1924303 .
- ^ Папп, Л.В.; Лу, Дж.; Холмгрен, А.; Ханна, К.К. (2007). «От селена к селенопротеинам: синтез, идентичность и их роль в здоровье человека». Антиоксиданты и окислительно-восстановительная сигнализация . 9 (7): 775–806. дои : 10.1089/ars.2007.1528 . ПМИД 17508906 .
- ^ Комассето, Жоау Валдир; Линг, Ло Вай; Петрьяни, Никола; Стефани, Хелио Александр (1997). «Виниловые селениды и теллуриды - получение, реакционная способность и синтетические применения». Синтез . 1997 (4): 373. doi : 10.1055/s-1997-1210 . S2CID 260336441 .
- ^ Комассето, Дж (1983). «Винилселениды». Журнал металлоорганической химии . 253 (2): 131–181. дои : 10.1016/0022-328X(83)80118-1 .
- ^ Зени, Гилсон; Страке, Марсело П.; Ногейра, Кристина В.; Брага, Антонио Л .; Менезес, Пауло Х.; Стефани, Хелио А. (2004). «Гидроселенирование алкинов бутилселенолятом лития: подход к синтезу виниловых селенидов». Органические письма . 6 (7): 1135–8. дои : 10.1021/ol0498904 . ПМИД 15040741 .
- ^ Дабдуб, М (2001). «Синтез (Z)-1-фенилселено-1,4-диорганил-1-бутен-3-инов: гидроселенирование симметричных и несимметричных 1,4-диорганил-1,3-бутадиинов». Тетраэдр . 57 (20): 4271–4276. дои : 10.1016/S0040-4020(01)00337-4 .
- ^ Дорегобаррос, О; Ланг, Э; Деоливейра, К; Пеппе, К; Зени, Г (2002). «Хемио-, регио- и стереоселективное гидроселенирование производных 2-алкин-1-ола, опосредованное йодидом индия (I)». Буквы тетраэдра . 43 (44): 7921. doi : 10.1016/S0040-4039(02)01904-4 .
- ^ Комассето, Дж (1981). «Стереоселективный синтез винилселенидов». Журнал металлоорганической химии . 216 (3): 287–294. дои : 10.1016/S0022-328X(00)85812-X .
- ^ Сборник органических синтезов . Том. 9, с. 396 (1998); Том. 71, с. 181 (1993) Интернет-статья. Архивировано 24 октября 2005 г. в Wayback Machine.
- ^ Сборник органических синтезов . Том. 6, с. 946 (1988); Том. 56, с. 25 (1977). Статья в Интернете. Архивировано 1 ноября 2005 г. на Wayback Machine.
- ^ Органические синтезы , Сб. Том. 4, с. 229 (1963); Том. 32, с. 35 (1952). Статья в Интернете. Архивировано 27 ноября 2005 г. на Wayback Machine.
- ^ Райли, Гарри Листер; Морли, Джон Фредерик; Друг, Норман Альфред Чайлд (1932). «255. Селена диоксид — новый окислитель. Часть I. Его реакция с альдегидами и кетонами». Журнал Химического общества (обновленный) : 1875. doi : 10.1039/JR9320001875 .
- ^ Сборник органических синтезов . Том. 6, с. 23 (1988); Том. 59, с. 58 (1979) Интернет-статья