Стереоселективность
В химии . стереоселективность [ 1 ] — свойство химической реакции , в которой один реагент образует неравную смесь стереоизомеров при нестереоспецифическом создании нового стереоцентра или при нестереоспецифическом преобразовании уже существующего. [ 2 ] Селективность возникает из-за различий в стерических и электронных эффектах на механистических путях, ведущих к образованию разных продуктов. Стереоселективность может различаться по степени, но она никогда не может быть полной, поскольку разница в энергии активации между двумя путями конечна: оба продукта, по крайней мере, возможны и просто различаются по количеству. Однако в благоприятных случаях минорный стереоизомер может быть не обнаружен используемыми аналитическими методами.
Энантиоселективная энантиомер реакция — это реакция, в которой один образуется предпочтительно по сравнению с другим, в реакции, которая создает оптически активный продукт из ахирального исходного материала с использованием хирального катализатора, фермента или хирального реагента. Степень селективности измеряют по энантиомерному избытку . Важным вариантом является кинетическое разрешение , при котором ранее существовавший хиральный центр вступает в реакцию с хиральным катализатором, ферментом или хиральным реагентом, так что один энантиомер реагирует быстрее, чем другой, и оставляет после себя менее реакционноспособный энантиомер, или при котором предварительный -существующий хиральный центр влияет на реакционную способность реакционного центра в другом месте той же молекулы.
Диастереоселективная реакция — это реакция , в которой один диастереомер образуется с предпочтением к другому (или в которой подмножество всех возможных диастереомеров доминирует в смеси продуктов), устанавливая предпочтительную относительную стереохимию. В этом случае образуются одновременно два или более хиральных центра, так что предпочтение отдается одной относительной стереохимии, [ 3 ] или ранее существовавший хиральный центр (который не обязательно должен быть оптически чистым) искажает стереохимический результат во время создания другого. Степень относительной селективности измеряют по диастереомерному избытку .
Стереоконвергенцию можно считать противоположностью стереоспецифичности, когда реакция двух разных стереоизомеров дает один стереоизомер продукта.
Качество стереоселективности касается исключительно продуктов и их стереохимии. Из числа возможных стереоизомерных продуктов реакция выбирает один или два для образования.
Стереомутация – это общий термин, обозначающий превращение одного стереоизомера в другой. Например, рацемизация (как в реакциях S N 1), эпимеризация (как при взаимном превращении D-глюкозы и D-маннозы в трансформации Лобри де Брюйна-Ван Экенштейна ) или асимметричная трансформация (превращение рацемата в чистый энантиомер или в смесь, в которой один энантиомер присутствует в избытке, или смесь диастереоизомеров с одним диастереоизомером или смесь, в которой преобладает один диастереоизомер). [ 4 ]
Примеры
[ редактировать ]Примером умеренной стереоселективности является дегидрогалогенирование 2-йодбутана, которое дает 60% транс -2-бутена и 20% цис -2-бутена. [ 5 ] алкенов Поскольку геометрические изомеры также классифицируются как диастереомеры, эту реакцию также можно назвать диастереоселективной.
Правило Крама предсказывает основной диастереомер, образующийся в результате диастереоселективного нуклеофильного присоединения к карбонильной группе рядом с хиральным центром. Хиральный центр не обязательно должен быть оптически чистым, поскольку относительная стереохимия будет одинаковой для обоих энантиомеров. В приведенном ниже примере (S)-альдегид реагирует с тиазолом с образованием (S,S)-диастереомера, но только небольшого количества (S,R)-диастереомера: [ 6 ]
Эпоксидирование Шарплесса является примером энантиоселективного процесса, в котором ахиральный субстрат аллилового спирта превращается в оптически активный эпоксидный спирт. В случае хиральных аллильных спиртов происходит кинетическое разрешение. Другой пример — асимметричное дигидроксилирование по Шарплессу . В приведенном ниже примере ахиральный алкен дает только один из четырех возможных стереоизомеров. [ 7 ]
При стереогенном центре, расположенном рядом с карбокатионом, замещение может быть стереоселективным. [ 8 ] и внутримолекулярный [ 9 ] [ 10 ] реакции. В реакции, изображенной ниже, нуклеофил (фуран) может приближаться к карбокатиону, образующемуся с наименее защищенной стороны от объемистой трет-бутильной группы, что приводит к высокой лицевой диастереоселективности:
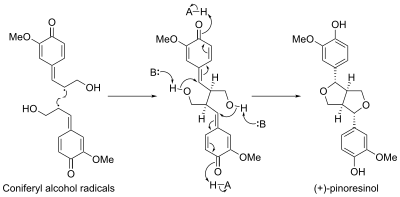
Стереоселективный биосинтез
[ редактировать ]В биосинтезе пинорезинола участвует белок, называемый диригентным белком . Первый диригентный белок был обнаружен у Forsythia intermedia . Было обнаружено, что этот белок управляет стереоселективным биосинтезом (+)- пинорезинола из мономеров кониферилового спирта . [ 11 ] второй энантиоклементарный диригентный белок был идентифицирован Недавно у Arabidopsis thaliana , который управляет энантиоселективным синтезом (-)-пинорезинола. [ 12 ]
См. также
[ редактировать ]Примечания и ссылки
[ редактировать ]- ^ (а) «Контроль перекрытия карбанионоидных реакций. I. Стереоселективность при щелочном эпоксидировании», Циммерман, HE; Сингер, Л.; Тьягараджан, BSJ Am. хим. Сок., 1959, 81, 108-116. (б) Элиэль, Э., «Стереохимия углеродных соединений», McGraw-Hill, 1962, стр. 434–436.
- ^ Например, реакция S N 1 разрушает ранее существовавший стереоцентр, а затем создает новый.
- ^ Или получается меньше, чем все возможные относительные стереохимии.
- ^ Элиэль, Э.Л. и Уиллен С.Х., «Стереохимия органических соединений», John Wiley & Sons, 2008, стр. 1209.
- ^ Влияние силы и размера основания на реакции элиминирования, стимулируемые основаниями. Ричард А. Барч, Джеральд М. Прусс, Брюс А. Бушоу, Карл Э. Вигерс Дж. Ам. хим. Соц. ; 1973 год ; 95(10); 3405-3407. два : 10.1021/ja00791a067
- ^ Органические синтезы, Сб. Том. 10, с.140 (2004); Том. 77, с.78 (2000). Связь
- ^ Органические синтезы, Сб. Том. 10, с.603 (2004); Том. 79, с.93 (2002). Связь
- ^ Диастереоселективные реакции циклизации Фриделя-Крафтса с 2-замещенными 1-фенил-1,2,3,4-тетрагидронафталинами Фридрих Мюльтау, Thorsten Bach Synthesis 2005 : 3428-3436 два : 10.1055/s-2005-918482
- ^ Высокая лицевая диастереоселективность во внутри- и межмолекулярных реакциях хиральных бензильных катионов Фридрих Мюльтау, Оливер Шустер и Торстен Бах J. Am. хим. Соц. , 2005 , 127 (26), стр. 9348–9349. два : 10.1021/ja050626v
- ^ Стереоселективные реакции со стабилизированными карбокатионами Пьер Джорджо Коцци и Фидес Бенфатти Ангью. хим. Межд. Эд. 2009 , 48 два : 10.1002/anie.200905235
- ^ Дэвин Л.Б., Ван Х.Б., Кроуэлл А.Л. и др. (1997). «Стереоселективное бимолекулярное связывание фенокси-радикала с помощью вспомогательного (направляющего) белка без активного центра». Наука . 275 (5298): 362–6. дои : 10.1126/science.275.5298.362 . ПМИД 8994027 . S2CID 41957412 .
- ^ Пикель Б., Константин М.А., Пфаннштайл Дж., Конрад Дж., Бейфусс Ю., Шаффер А. (март 2007 г.). «Энантиоклементарный диригентный белок для энантиоселективного лакказо-катализируемого окислительного сочетания фенолов» . Ангеванде Хеми . 53 (4): 273–284. дои : 10.1007/s10086-007-0892-x . S2CID 195313754 .