Синтез оксазола по Фишеру
| Синтез оксазола по Фишеру | |
|---|---|
| Назван в честь | Герман Эмиль Фишер |
| Тип реакции | Реакция образования кольца |
Синтез Фишера — химический синтез оксазола циангидрина из оксазола и альдегида в присутствии безводной соляной кислоты . [1] Этот метод был открыт Эмилем Фишером в 1896 году. [2] Сам циангидрин получается из отдельного альдегида. Реагенты самого синтеза оксазола — циангидрин альдегида и сам другой альдегид — обычно присутствуют в эквимолярных количествах. [3] Оба реагента обычно имеют ароматическую группу, которая появляется в определенных положениях образующегося гетероцикла .
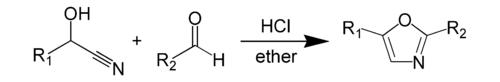
Более конкретный пример синтеза оксазола по Фишеру включает реакцию нитрила миндальной кислоты с бензальдегидом с образованием 2,5-дифенилоксазола. [4]
История
[ редактировать ]Фишер разработал синтез оксазола Фишера во время своего пребывания в Берлинском университете . Синтез оксазола Фишера был одним из первых синтезов, разработанных для получения 2,5-дизамещенных оксазолов. [4]
Механизм
[ редактировать ]Синтез оксазола по Фишеру представляет собой тип реакции дегидратации , которая может происходить в мягких условиях с перегруппировкой групп, которая кажется невозможной. Реакция происходит путем растворения реагентов в сухом эфире и пропускания через раствор сухого газообразного хлористого водорода . Продукт, представляющий собой 2,5-дизамещенный оксазол, выпадает в осадок в виде гидрохлорида и может быть превращен в свободное основание добавлением воды или кипячением со спиртом. [1]
Цианогидрины используемые и альдегиды, для синтеза, обычно являются ароматическими , однако были случаи, когда алифатические использовались соединения.Первым этапом механизма является присоединение газообразного HCl к циангидрину 1 . Цианогидрин в отрывает водород от HCl, то время как ион хлорида атакует углерод в цианогруппе . Этот первый шаг приводит к образованию промежуточного иминохлорида 2 , вероятно, в виде гидрохлоридной соли. Это промежуточное соединение затем реагирует с альдегидом ; гидроксильная отрывает водород группа 2 от азота, в то время как пара азота атакует электрофильный карбонильный углерод альдегида неподеленная .Следующий этап приводит к атаке S N 2 хлороксазолина с последующей потерей воды с образованием промежуточного 4 . Далее происходит таутомеризация кольцевого протона . Последний этап включает удаление и потерю молекулы HCl с образованием продукта 6 , который представляет собой 2,5-диарилоксазол. [4]
Приложения
[ редактировать ]Диарилазолы являются распространенными структурными мотивами как в натуральных продуктах, так и в потенциальных лекарствах, однако их трудно синтезировать. Диарилоксазолы обычно получают посредством синтеза оксазола Фишера или синтеза Робинсона-Габриэля , где оксазольное кольцо создается посредством любого синтеза. [5]
Синтез оксазола Фишера также оказался полезен при синтезе 2-(4-бромфенил)5-фенилоксазола, начиная с бензальдегидциангидрина и 4-бромбензальдегида. Однако хлорирование оксазольного кольца приводит к образованию 2,5-бис(4-бромфенил)-4-хлороксазола 7 наряду с 2,5-бис(4-бромфенил)-4-оксазолидиноном 8 . Последнее соединение обычно является побочным продуктом . [6]

Другим полезным примером является двухэтапный синтез халординола, исходного соединения алкалоидов рутовых, в одном горшке . Начальные этапы следуют синтезу оксазола Фишера, хотя кислотно-катализируемая циклизация происходит в две стадии, а не в одну, что обеспечивает образование дихлорпромежуточного соединения , предотвращая образование региоизомера . [4]

В недавних исследованиях [ нужна ссылка ] пересмотр синтеза оксазола Фишера привел к синтезу 2,5-дизамещенных оксазолов из альдегидов и α-гидроксиамидов. Однако, в отличие от синтеза оксазола по Фишеру, новый метод не ограничивается диарилоксазолами. [7]
Ссылки
[ редактировать ]- ^ Jump up to: а б Уайли, Р.Х. Химия оксазолов. хим. Отв. 1945 , 37 , 401. ( два : 10.1021/cr60118a002 )
- ^ Фишер, Э. Бер. 1896 , 29 , 205.
- ^ Ли, Дж. Дж. Фишер Синтез оксазола. В реакциях на имя: сборник подробных механизмов и синтетических приложений , 4-е изд.; Springer-Verlag Berlin Heidelberg: Нью-Йорк, 2003 , 229–230. (Обзор). ( [1] Архивировано 4 марта 2016 г. в Wayback Machine )
- ^ Jump up to: а б с д Маклад Н. Назовите реакции в гетероциклической химии II ; Ли, Джей-Джей; Уайли и сыновья; Хобокен, Нью-Джерси, 2011 , 225–232. ( [2] )
- ^ Стротман, Н.А.; Чобанян, HR; Он, Дж.; Го, Ю.; Дормер, П.Г.; Джонс, CM; Стивс, Дж. Е. Региоселективные соединения Сузуки, контролируемые катализатором, в обоих положениях дигалоидимадозов, дигалооксазолов и дигалотиазолов. Дж. Орг. хим. 2010 , 75 , 1733-1739. ( два : 10.1021/jo100148x )
- ^ Турчи, И. Дж. Химия оксазола: обзор последних достижений. Индийский англ. Че. Прод. Рез. Дев. 1981 , 20 , 32-76. ( [3] ) (Обзор).
- ^ Корнфорт, JW; Корнфорт, Р.Х. 218. Механизм и расширение синтеза оксазола Фишера. Дж. Ам. хим. Соц. 1949 , 1028-1030. ( дои : 10.1039/JR9490001028 )