Циангидрин
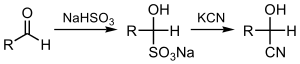
В органической химии циангидрин , или гидроксинитрил — это функциональная группа обнаруженная в органических соединениях , в которых циано- и гидроксигруппа присоединены к одному и тому же атому углерода. Общая формула R 2 C(OH)CN , где R представляет собой H, алкил или арил . Цианогидрины — промышленно важные предшественники карбоновых кислот и некоторых аминокислот . Цианогидрины могут образовываться в результате реакции циангидрина , которая включает обработку кетона или альдегида цианистым водородом (HCN) в присутствии избыточного количества цианида натрия (NaCN) в качестве катализатора: [ 1 ]
- RR'C=O + HCN → RR'C(OH)CN
В этой реакции нуклеофильный Китай − Ион атакует электрофильный карбонильный углерод в кетоне с последующим протонированием HCN, тем самым регенерируя цианид-анион . Цианогидрины получают также замещением сульфита цианидными солями: [ 2 ]
Цианогидрины являются промежуточными продуктами синтеза аминокислот Стрекера . В водной кислоте они гидролизуются до α-гидроксикислоты .
Ацетонциангидрины
[ редактировать ]Ацетонциангидрин , (CH 3 ) 2 C(OH)CN — циангидрин ацетона . Он образуется как промежуточный продукт при промышленном производстве метилметакрилата . [ 3 ] В лаборатории эта жидкость служит источником HCN, который очень летуч. [ 4 ] Таким образом, ацетонциангидрин можно использовать для получения других циангидринов, для превращения HCN в Михаэля и для формилирования аренов акцепторы . Обработка этого циангидрина гидридом лития дает безводный цианид лития:
Препаративные методы
[ редактировать ]Цианогидрины сначала были получены добавлением HCN и катализатора (основания или фермента) к соответствующему карбонилу. [ 5 ] В лабораторных масштабах использование HCN (токсичного) в основном не поощряется, по этой причине ищут другие менее опасные реагенты для цианирования. Образование HCN in situ можно обеспечить с помощью прекурсоров, таких как ацетонциангидрин. Альтернативно, цианосилильные производные, такие как TMS-CN, позволяют как цианировать, так и защищать за одну стадию без необходимости использования HCN. [ 6 ] Сообщалось о подобных процедурах, основанных на образовании эфиров, фосфатов и карбонатов. [ 7 ] [ 8 ] [ 9 ]

Другие циангидрины
[ редактировать ]Манделонитрил с формулой C 6 H 5 CH (OH)CN встречается в небольших количествах в косточках некоторых фруктов. [ 2 ] Известны родственные цианогенные гликозиды, такие как амигдалин . [ 1 ]

Гликолонитрил , также называемый гидроксиацетонитрилом или формальдегидциангидрином, представляет собой органическое соединение с формулой HOCH 2 CN. Это простейший циангидрин, полученный из формальдегида . [ 10 ]
-
гликолонитрил
-
ацетон циангидрин
-
манделонитрил
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Дэвид Т. Моури (1948). «Получение нитрилов». хим. Откр. 42 (2): 189–283. дои : 10.1021/cr60132a001 . ПМИД 18914000 .
- ^ Перейти обратно: а б Корсон, Б.Б.; Додж, РА; Харрис, ЮАР; Да, Дж.С. (1941). «Миндальная кислота» . Органические синтезы ; Сборник томов , т. 1, с. 336 .
- ^ Уильям Бауэр-младший «Метакриловая кислота и ее производные» в Энциклопедии промышленной химии Ульмана, 2002, Wiley-VCH, Вайнхайм. дои : 10.1002/14356007.a16_441 . Дата публикации статьи в Интернете: 15 июня 2000 г.
- ^ Арутунян, С.А. Энциклопедия реагентов для органического синтеза "Ацетонциангидрин", 2001, John Wiley & Sons. два : 10.1002/047084289X.ra014
- ^ Норт, М.; Усанов Д.Л.; Янг, К. Льюис. Асимметричный синтез циангидрина, катализируемый кислотой. хим. Ред. 2008, 108 (12), 5146–5226. doi: 10.1021/cr800255k.
- ^ Лиди, В.; Сандермейер, В. Реакции расщепления триметилсилилцианида, новый метод получения O-(триметилсилил)циангидринов. Хим. Бер. 1973, 106 (2), 587–593. doi:10.1002/cber.19731060224
- ^ Шолль, М.; Лим, СК; Фу, Г.К. Удобное и эффективное преобразование альдегидов в ацилированные циангидрины с использованием цианида трибутилолова в качестве катализатора. Дж. Орг. хим. 1995, 60 (19), 6229–6231. дои: 10.1021/jo00124a052.
- ^ Йонеда, Р.; Харусава, С.; Курихара, Т. Цианофосфат: эффективное промежуточное соединение для хемоселективного превращения карбонильных соединений в нитрилы. Дж. Орг. хим. 1991, 56 (5), 1827–1832. дои: 10.1021/jo00005a031.
- ^ Джул, М.; Петерсен, Арканзас; Ли, Ж.-В. Синтез циангидрина с использованием CO2 и простые итеративные реакции омологации. хим. – Евро. J. 2020. doi: 10.1002/chem.202003623.
- ^ Годри, Р. (1955). «Гликолонитрил» . Органические синтезы ; Сборник томов , т. 3, с. 436 .
Внешние ссылки
[ редактировать ]- ИЮПАК в Золотой книге Определение циангидринов [1]