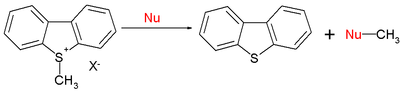
нуклеофил

В химии нуклеофил , — это химическая разновидность которая образует связи путем отдачи электронной пары . все молекулы и ионы, имеющие свободную пару электронов или хотя бы одну пи-связь Нуклеофилами могут быть . Поскольку нуклеофилы отдают электроны, они являются основаниями Льюиса .
Нуклеофильность описывает способность нуклеофила связываться с положительно заряженными атомными ядрами . Нуклеофильность, иногда называемая нуклеофильной силой, относится к нуклеофильному характеру вещества и часто используется для сравнения сродства атомов . Нейтральные нуклеофильные реакции с растворителями , такими как спирты и вода, называются сольволизом . Нуклеофилы могут принимать участие в нуклеофильном замещении , при котором нуклеофил притягивается к полному или частичному положительному заряду, а также в нуклеофильном присоединении . Нуклеофильность тесно связана с основностью . Разница между ними заключается в том, что основность является термодинамическим свойством (т.е. относится к состоянию равновесия), а нуклеофильность — это кинетическое свойство, которое связано со скоростями определенных химических реакций. [1]
История и этимология
[ редактировать ]Термины нуклеофил и электрофил были введены Кристофером Келком Ингольдом в 1933 году. [2] замена терминов «анионоид» и «катионоид», предложенных ранее А. Дж. Лэпвортом в 1925 году. [3] Слово нуклеофил происходит от ядра и греческого слова φιλος, philos , что означает друг.
Характеристики
[ редактировать ]В целом, в группе периодической таблицы, чем более основной ион (чем выше pK a сопряженной кислоты), тем более реакционноспособным он является как нуклеофил. Внутри ряда нуклеофилов с одним и тем же атакующим элементом (например, кислородом) порядок нуклеофильности будет соответствовать основности. Сера, как правило, является лучшим нуклеофилом, чем кислород. [ нужна ссылка ]
Нуклеофильность
[ редактировать ]Было разработано множество схем, пытающихся количественно оценить относительную нуклеофильную силу. Следующие эмпирические данные были получены путем измерения скоростей многих реакций с участием многих нуклеофилов и электрофилов. Нуклеофилы, обладающие так называемым альфа-эффектом , обычно не используются в этом типе лечения. [ нужна ссылка ]
Уравнение Суэйна – Скотта
[ редактировать ]Первая такая попытка обнаружена в уравнении Суэйна – Скотта. [4] [5] получено в 1953 году:
Это соотношение свободной энергии связывает псевдопервого порядка константу скорости реакции (в воде при 25 °C) k реакции, нормированную на скорость реакции k 0 стандартной реакции с водой в качестве нуклеофила, с нуклеофильным соединением. константа n для данного нуклеофила и константа субстрата s , которая зависит от чувствительности субстрата к нуклеофильной атаке (определяется как 1 для бромистого метила ).
Такая обработка приводит к следующим значениям типичных нуклеофильных анионов: ацетат 2,7, хлорид 3,0, азид 4,0, гидроксид 4,2, анилин 4,5, йодид 5,0 и тиосульфат 6,4. Типичные константы субстрата составляют 0,66 для этилтозилата , 0,77 для β-пропиолактона , 1,00 для 2,3-эпоксипропанола , 0,87 для бензилхлорида и 1,43 для бензоилхлорида .
Уравнение предсказывает, что при нуклеофильном замещении бензилхлорида анион реагирует в 3000 раз быстрее , азид - чем вода.
Уравнение Ричи
[ редактировать ]Уравнение Ричи, полученное в 1972 году, представляет собой еще одно соотношение свободной энергии: [6] [7] [8]
где Н + – параметр, зависящий от нуклеофила, а k 0 для – константа скорости реакции воды. параметр, зависящий от подложки, такой как s В этом уравнении отсутствует в уравнении Свейна-Скотта. Уравнение гласит, что два нуклеофила реагируют с одинаковой относительной реакционной способностью независимо от природы электрофила, что нарушает принцип реакционной способности-селективности . По этой причине это уравнение также называют постоянным соотношением селективности .
В оригинальной публикации данные были получены путем реакции выбранных нуклеофилов с выбранными электрофильными карбокатионами, такими как катионы тропилия или диазония :
или (не показаны) ионы на основе малахитового зеленого . С тех пор были описаны многие другие типы реакций.
Типичный Ричи Н. + значения (в метаноле ): 0,5 для метанола , 5,9 для цианид -аниона, 7,5 для метоксид -аниона, 8,5 для азид -аниона и 10,7 для тиофенол- аниона. Значения относительной реакционной способности катионов составляют -0,4 для катиона малахитового зеленого, +2,6 для катиона бензолдиазония и +4,5 для катиона тропилия .
Уравнение Майра – Патца
[ редактировать ]В уравнении Майра – Патца (1994): [9]
второго порядка Константа скорости реакции k при 20 ° C для реакции связана с параметром нуклеофильности N , параметром электрофильности E и параметром наклона, зависящим от нуклеофила s . Константа s определяется как 1 с 2-метил-1-пентеном в качестве нуклеофила.
Многие константы были получены в результате реакции так называемых ионов бензгидрилия в качестве электрофилов : [10]
и разнообразная коллекция π-нуклеофилов:
Типичные значения E составляют +6,2 для R = хлора , +5,90 для R = водорода , 0 для R = метокси и -7,02 для R = диметиламина .
Типичные значения N с s в скобках составляют -4,47 (1,32) для электрофильного ароматического замещения толуолу . (1), -0,41 (1,12) для электрофильного присоединения к 1-фенил-2-пропену (2) и 0,96 (1) для присоединения к 2-метил-1-пентену (3), -0,13 (1,21) для реакции с трифенилаллисиланом (4), 3,61 (1,11) для реакции с 2-метилфураном (5), +7,48 (0,89) для реакции с изобутенилтрибутилстаннаном (6 ) и +13,36 (0,81) для реакции с енамином 7. [11]
К кругу органических реакций относятся также SN2-реакции : [12]
При E = -9,15 для иона S-метилдибензотиофения типичные нуклеофильные значения N(s) составляют 15,63 (0,64) для пиперидина , 10,49 (0,68) для метоксида и 5,20 (0,89) для воды. Короче говоря, нуклеофильность по отношению к центрам sp 2 или sp 3 следует той же схеме.
Единое уравнение
[ редактировать ]В целях унификации описанных выше уравнений уравнение Майра переписано в виде: [12]
где s E - параметр наклона, зависящий от электрофилов, и s N - параметр наклона, зависящий от нуклеофила. Это уравнение можно переписать несколькими способами:
- при s E = 1 для карбокатионов это уравнение равно исходному уравнению Майра – Патца 1994 г.:
- при s N = 0,6 для большинства n нуклеофилов уравнение принимает вид
- или исходное уравнение Скотта – Суэйна, записанное как:
- при s E = 1 для карбокатионов и s N = 0,6 уравнение принимает вид:
- или исходное уравнение Ричи, записанное как:
Типы
[ редактировать ]Примерами нуклеофилов являются анионы, такие как Cl − , или соединение с неподеленной парой электронов, такое как NH 3 ( аммиак ) и PR 3 . [ нужна ссылка ]
В приведенном ниже примере кислород гидроксид-иона отдает электронную пару для образования новой химической связи с углеродом на конце молекулы бромпропана . Связь между углеродом и бромом затем подвергается гетеролитическому делению , при этом атом брома забирает отданный электрон и превращается в бромид- ион (Br − ), поскольку реакция S N 2 происходит при атаке с обратной стороны. Это означает, что гидроксид-ион атакует атом углерода с другой стороны, точно противоположной иону брома. Из-за этой обратной атаки реакции S N 2 приводят к инверсии конфигурации электрофила . Если электрофил хиральный S N продукта , он обычно сохраняет свою хиральность, хотя абсолютная конфигурация 2 переворачивается по сравнению с конфигурацией исходного электрофила. [ нужна ссылка ]
Амбидентный нуклеофил
[ редактировать ]Амбидентный нуклеофил — это тот, который может атаковать из двух или более мест, в результате чего образуются два или более продуктов. Например, роданид- ион (SCN − ) может атаковать как серу, так и азот. По этой причине реакция S N 2 алкилгалогенида с SCN − часто приводит к смеси алкилтиоцианата (R-SCN) и алкилизотиоцианата ( R-NCS). Аналогичные соображения применимы и к синтезу нитрила Кольбе . [ нужна ссылка ]
Галогены
[ редактировать ]Хотя галогены не являются нуклеофильными в своей двухатомной форме (например, I 2 не является нуклеофилом), их анионы являются хорошими нуклеофилами. В полярных протонных растворителях F − является самым слабым нуклеофилом, и я − самый сильный; этот порядок меняется на обратный в полярных апротонных растворителях. [13]
Углерод
[ редактировать ]Углеродные нуклеофилы часто представляют собой металлоорганические реагенты , такие как реакции Гриньяра , реакции Блеза , реакции Реформатского и реакции Барбье или реакции с участием литийорганических реагентов и ацетилидов . Эти реагенты часто используются для осуществления нуклеофильного присоединения . [ нужна ссылка ]
Енолы также являются углеродными нуклеофилами. Образование енола катализируется кислотой или основанием . Енолы являются амбидентными нуклеофилами, но, как правило, нуклеофильны по альфа-атому углерода . Енолы обычно используются в реакциях конденсации , включая конденсацию Кляйзена и реакции альдольной конденсации . [ нужна ссылка ]
Кислород
[ редактировать ]Примерами кислородных нуклеофилов являются вода (H 2 O), гидроксид- анион, спирты , алкоксид- анионы, перекись водорода и карбоксилат-анионы .Нуклеофильная атака не происходит при межмолекулярной водородной связи.
сера
[ редактировать ]Из сернистых нуклеофилов сероводорода и его солей встречаются тиолы (RSH), тиолат-анионы (RS − ), анионы тиолкарбоновых кислот (RC(O)-S − ) и анионы дитиокарбонатов (RO-C(S)-S − ) и дитиокарбаматы (R 2 N-C(S)-S − ) используются чаще всего.
В целом сера очень нуклеофильна из-за своего большого размера , что делает ее легко поляризуемой, а ее неподеленные пары электронов легко доступны.
Азот
[ редактировать ]Азотные нуклеофилы включают аммиак , азид , амины , нитриты , гидроксиламин , гидразин , карбазид , фенилгидразин , семикарбазид и амид .
Металлические центры
[ редактировать ]Хотя металлоцентры (например, Li + , Зн 2+ , наук 3+ и т. д.) чаще всего являются катионными и электрофильными (кислоты Льюиса) по своей природе, некоторые металлические центры (особенно те, которые находятся в низкой степени окисления и/или несут отрицательный заряд) являются одними из самых сильных зарегистрированных нуклеофилов и иногда называются «супернуклеофилами». ." Например, используя йодистый метил в качестве электрофила сравнения, Ph 3 Sn – примерно в 10000 раз более нуклеофильен, чем я – , тогда как форма Co(I) витамина B 12 (витамин B 12s ) составляет около 10 7 раз более нуклеофильны. [14] Другие супернуклеофильные металлоцентры включают карбонилметаллат-анионы с низкой степенью окисления (например, CpFe(CO) 2 – ). [15]
Примеры
[ редактировать ]В следующей таблице показана нуклеофильность некоторых молекул с метанолом в качестве растворителя: [16]
| Относительная нуклеофильность | Молекулы |
|---|---|
| Очень хороший | Я⁻, HS⁻, RS⁻ |
| Хороший | Br⁻, OH⁻, RO⁻, CN⁻, N 3 ⁻ |
| Справедливый | NH 3 , Cl⁻, F⁻, RCO 2 ⁻ |
| Слабый | Н 2 О, ДУХ |
| Очень слабый | РКО 2 Н |
См. также
[ редактировать ]- Электрофил - химическая разновидность, принимающая электронную пару от нуклеофила.
- Кислоты и основания Льюиса - Теория химической связи
- Нуклеофильная абстракция - тип металлоорганической реакции.
- Дополнение к пи-лигандам — правило металлоорганической химии.
Ссылки
[ редактировать ]- ^ Нуклеофильность - периодические тенденции и связь с основностью. Эйнар Уггеруд. https://doi.org/10.1002/chem.200500639
- ^ Ингольд, СК (1933). «266. Значение таутомерии и реакций ароматических соединений в электронной теории органических реакций». Журнал Химического общества (обновленный) : 1120. doi : 10.1039/jr9330001120 .
- ^ Лэпворт, А. (1925). «Заменяемость атомов галогенов атомами водорода». Природа . 115 :625.
- ^ Количественная корреляция относительных ставок. Сравнение гидроксид-иона с другими нуклеофильными реагентами по отношению к алкилгалогенидам, сложным эфирам, эпоксидам и ацилгалогенидам К. Гарднер Суэйн, Карлтон Б. Скотт Дж. Ам. хим. Соц. ; 1953 год ; 75(1); 141-147. Абстрактный
- ^ «Уравнение Суэйна – Скотта». Сборник химической терминологии ИЮПАК . 2014. doi : 10.1351/goldbook.S06201 .
- ^ «Уравнение Ричи». Сборник химической терминологии ИЮПАК . 2014. doi : 10.1351/goldbook.R05402 .
- ^ Нуклеофильная реактивность по отношению к катионам Кэлвин Д. Ричи Acc. хим. Рез.; 1972 год ; 5(10); 348-354. Абстрактный
- ^ Реакции сочетания катион-анионов. XIII. Корреляция реакций нуклеофилов с эфирами Calvin D. Ritchie J. Am. хим. Соц. ; 1975 год ; 97(5); 1170–1179. Абстрактный
- ^ Майр, Герберт; Патц, Матиас (1994). «Шкалы нуклеофильности и электрофильности: система упорядочения полярных органических и металлоорганических реакций». Angewandte Chemie International Edition на английском языке . 33 (9): 938. doi : 10.1002/anie.199409381 .
- ^ Майр, Герберт; Баг, Торстен; Должен, Матиас Ф; Геринг, Николь; Иррганг, Бернхард; Янкер, Бриджит; Кемпф, Бернхард; Лоос, Роберт; Офиал, Армин Р.; Ременников, Григорий; Шиммель, Хольгер (2001). «Эталонные шкалы для характеристики катионных электрофилов и нейтральных нуклеофилов». Журнал Американского химического общества . 123 (39): 9500–12. дои : 10.1021/ja010890y . ПМИД 11572670 . S2CID 8392147 .
- ^ Интернет-база данных параметров реактивности, поддерживаемая группой Майра, доступна по адресу http://www.cup.uni-muenchen.de/oc/mayr/.
- ^ Jump up to: а б Фан, Тхань Бинь; Брюгст, Мартин; Майр, Герберт (2006). «К общей шкале нуклеофильности?». Angewandte Chemie, международное издание . 45 (23): 3869–74. CiteSeerX 10.1.1.617.3287 . дои : 10.1002/anie.200600542 . ПМИД 16646102 .
- ^ Дополнительные примечания к Chem 2401 . Томпсон, Элисон и Пинкок, Джеймс, химический факультет Университета Далхаузи
- ^ Шрауцер, Г.Н.; Дойч, Э.; Виндгассен, Р.Дж. (апрель 1968 г.). «Нуклеофильность витамина B (суб12)» . Журнал Американского химического общества . 90 (9): 2441–2442. дои : 10.1021/ja01011a054 . ISSN 0002-7863 . ПМИД 5642073 .
- ^ Десси, Раймонд Э.; Пол, Рудольф Л.; Кинг, Р. Брюс (ноябрь 1966 г.). «Металлоорганическая электрохимия. VII. 1 Нуклеофильность металлических и металлоидных анионов металлов IV, V, VI, VII и VIII групп» . Журнал Американского химического общества . 88 (22): 5121–5124. дои : 10.1021/ja00974a015 . ISSN 0002-7863 .
- ^ Ян Хант. «Глава 8: Нуклеофилы» . chem.ucalgary.ca . Университет Калгари . Проверено 15 апреля 2024 г.