Соединение диазония
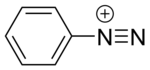
Соединения диазония или соли диазония представляют собой группу органических соединений, имеющих общую функциональную группу. [Р-Н + ≡N]X − где R может быть любой органической группой, такой как алкил или арил , а X представляет собой неорганический или органический анион, такой как галогенид . Исходное соединение, где R представляет собой водород, представляет собой диазенилий .
Общие свойства и реакционная способность
[ редактировать ]Катионы арениазония и родственные виды
[ редактировать ]По данным рентгеновской кристаллографии C-N + Связь ≡N в типичных солях диазония линейна. Н + ≡N Расстояние связи в тетрафторборате бензолдиазония составляет 1,083(3) Å , [1] что практически идентично таковому для молекулы диазота (N≡N).
Линейные константы свободной энергии σ m и σ p указывают на то, что диазониевая группа является сильно электроноакцепторной. Таким образом, диазониозамещенные фенолы и бензойные кислоты значительно снижают значения p K a по сравнению с их незамещенными аналогами. p K a фенольного протона 4-гидроксибензолдиазония составляет 3,4, [2] против 9,9 для самого фенола. Другими словами, диазониевая группа снижает р Ка (повышает кислотность ) в миллион раз. Это также приводит к снижению реакционной способности солей аренедиазония, когда в ароматическом кольце присутствуют электронодонорные группы. [3]
Стабильность солей арендиазония очень чувствительна к противоиону. Хлорид фенилдиазония взрывоопасен, но с тетрафторборатом бензолдиазония легко справиться на рабочем столе. [ нужна ссылка ]
Реакции S N 1 и S N 2 не происходят.
Реакционная способность ароматического замещения солей арилдиазония в основном характеризуется арильными радикалами, как показано в реакциях ниже.
Отделение диазота от соли диазония также может привести к образованию арильных катионов, которые являются промежуточными продуктами в некоторых реакциях, таких как реакция Зандмейера . Такое отклонение оказывается в некоторой степени обратимым, о чем свидетельствует изотопное перемешивание атомов азота. [3]
Соли арениазония являются универсальными реагентами, как описано в следующих разделах. [4] После электрофильного ароматического замещения химия диазония является наиболее часто применяемой стратегией получения ароматических соединений.
Катионы алканедиазония и родственные виды
[ редактировать ]Соли алканедиазония не имеют синтетического значения из-за их чрезвычайной и неконтролируемой реакционной способности в отношении замещения S N 2/S N 1/E1. Однако эти катионы представляют теоретический интерес. Кроме того, считается, что карбоксилат метилдиазония является промежуточным продуктом при метилировании карбоновых кислот диазометаном , что является обычным превращением. [5] [6]
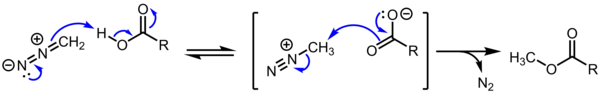
Потеря N 2 является как энтальпийно, так и энтропийно выгодным:
- [ CH3N2 2] + → [ГЛАВА 3 ] + + N 2 , ΔH = −43 ккал/моль
- [Ч 3 СН 2 Н 2 ] + → [Ч 3 Ч 2 ] + + N 2 , ΔH = −11 ккал/моль
Для вторичных и третичных разновидностей алканедиазония изменение энтальпии, по расчетам, близко к нулю или отрицательное, с минимальным активационным барьером. Следовательно, вторичные и (особенно) третичные виды алканедиазония являются либо несвязанными, несуществующими видами, либо, в лучшем случае, чрезвычайно мимолетными промежуточными соединениями. [7]
Водный K a метилдиазония p ( [ CH3N2 2] + ) оценивается в <10. [8]
Подготовка
[ редактировать ]Процесс образования соединений диазония называется «диазотированием», «диазонированием» или «диазотированием». Впервые о реакции сообщил Питер Грисс в 1858 году, который впоследствии открыл несколько реакций этого нового класса соединений. Чаще всего соли диазония получают обработкой ароматических аминов азотистой кислотой и дополнительной кислотой. Обычно азотистая кислота образуется на месте (в той же колбе) из нитрита натрия и избытка минеральной кислоты (обычно водного раствора HCl, H 2 SO 4 , р- H 3 CC 6 H 4 SO 3 H , или H[BF4 ] ) :
- ArNH 2 + HNO 2 + HX → [ArN 2 ] + Х − + 2 Н 2 О

Хлоридные соли катиона диазония, традиционно получаемые из анилина, нитрита натрия и соляной кислоты , нестабильны при комнатной температуре и классически получаются при 0–5 ° C. Однако можно выделить соединения диазония в виде тетрафторбората или тозилата . солей [9] которые являются стабильными твердыми веществами при комнатной температуре. [10] Часто предпочтительно, чтобы соль диазония оставалась в растворе, но она имеет тенденцию к пересыщению . Операторы были ранены или даже убиты в результате неожиданной кристаллизации соли с последующей ее детонацией. [11]
Из-за этих опасностей соединения диазония часто не выделяются. Вместо этого они используются на месте . Этот подход проиллюстрирован на примере получения аренсульфонильного соединения: [12]
Реакции диазосочетания
[ редактировать ]Первое использование солей диазония заключалось в производстве водостойких окрашенных тканей путем погружения ткани в водный раствор соединения диазония с последующим погружением в раствор связующего вещества (богатое электронами кольцо, подвергающееся электрофильному замещению). Основное применение соединений диазония остается в красочной и пигментной промышленности. [13]
Наиболее распространенной реакцией солей диазония остается азосочетание , которое используется в производстве азокрасителей . [14] В этом процессе соединение диазония подвергается атаке, т.е. связывается с богатыми электронами субстратами. Когда партнерами сочетания являются арены, такие как анилин и фенолы, процесс является примером электрофильного ароматического замещения :
- [АрН 2 ] + + Ar'H → ArN 2 Ar' + H +
Другим коммерчески важным классом партнеров сочетания являются ацетоуксусные амиды, о чем свидетельствует получение пигмента желтого 12, диарилидного пигмента . [15]
Получающиеся в результате азосоединения часто являются полезными красителями и фактически называются азокрасителями . [13] Глубокие цвета красителей отражают их расширенное сопряжение . Например, краситель анилиновый желтый получают путем смешивания анилина и холодного раствора соли диазония и последующего энергичного встряхивания. Анилиновый желтый получают в виде желтого твердого вещества. [16] Точно так же холодный основной раствор нафталин-2-ола (бета-нафтола) дает интенсивно оранжево-красный осадок. [16] Метилоранж — пример азокрасителя, который используется в лаборатории в качестве индикатора pH .
Смещение № 2 группа
[ редактировать ]Катионы арендиазония вступают в ряд реакций, в которых Группа N 2 заменяется другой группой или ионом. Некоторые из основных из них следующие. [17] [18]
Биариловая муфта
[ редактировать ]Пара катионов диазония может образовывать биарилы . Это превращение иллюстрируется сочетанием соли диазония, полученной из антраниловой кислоты, с образованием дифеновой кислоты ( (C 6 H 4 CO 2 H) 2 ). [19] В аналогичной реакции та же соль диазония теряет № 2 и CO 2 дает бензин . [20]
Замена галогенидами
[ редактировать ]Реакция Зандмейера
[ редактировать ]Хлорид бензолдиазония при нагревании с хлоридом меди или бромидом меди, растворенными соответственно в HCl или HBr, дает хлорбензол или бромбензол соответственно.
- [С 6 Н 5 Н 2 ] + + CuCl → C 6 H 5 Cl + N 2 + Cu +
Реакция Гаттермана
[ редактировать ]В реакции Гаттермана хлорид бензолдиазония нагревается с медным порошком и HCl или HBr с образованием хлорбензола и бромбензола соответственно. Он назван в честь немецкого химика Людвига Гаттермана . [21]
- 2 Cu + 2 [C 6 H 5 N 2 ] + → 2 меди + + (C 6 H 5 ) 2 + 2 N 2 (инициирование)
- [С 6 Н 5 Н 2 ] + + HX → C 6 H 5 X + N 2 + H + (С + катализ)
Замена йодидом
[ редактировать ]Катионы арендиазония реагируют с йодидом калия с образованием арилйодида: [22]
- [С 6 Н 5 Н 2 ] + + КИ → С 6 Н 5 И + К + + Н 2
Замена фторидом
[ редактировать ]Фторбензол получают термическим разложением тетрафторбората бензолдиазония . Преобразование называется реакцией Бальца-Шимана . [23]
- [С 6 Н 5 Н 2 ] + [БФ 4 ] − → С 6 Н 5 Ж + БФ 3 + Н 2
Традиционная реакция Бальца-Шимана была предметом многих мотиваций, например, использование гексафторфосфата (V) ( [ПФ 6 ] − ) и гексафторантимонат(V) ( [СбФ 6 ] − ) вместо тетрафторбората ( [БФ 4 ] − ). Диазотирование можно осуществлять с помощью солей нитрозония, таких как гексафторантимонат нитрозония (V). [НЕТ] + [СбФ 6 ] − . [24]
Разные замены
[ редактировать ]Замена водородом
[ редактировать ]Катионы арендиазония восстанавливаются фосфорноватистой кислотой . [25] этанол , [26] станнит натрия [27] или щелочной тиосульфат натрия [28] дает бензол:
- [С 6 Н 5 Н 2 ] + кл. − + H 3 PO 2 + H 2 O → C 6 H 6 + N 2 + H 3 PO 3 + HCl
- [С 6 Н 5 Н 2 ] + кл. − + CH 3 CH 2 OH → C 6 H 6 + N 2 + CH 3 CHO + HCl
- [С 6 Н 5 Н 2 ] + кл. − + NaOH + Na 2 SnO 2 → C 6 H 6 + N 2 + Na 2 SnO 3 + NaCl
Альтернативный способ, предложенный Baeyer & Pfitzinger, заключается в замене диазогруппы на H: сначала превратить ее в гидразин путем обработки SnCl 2 затем окислить его до углеводорода кипячением с раствором сульфата меди. [29]
Замена гидроксильной группой
[ редактировать ]Фенолы получают нагреванием водных растворов солей арендиазония: [30] [31] [32] [33]
- [С 6 Н 5 Н 2 ] + + H 2 O → C 6 H 5 OH + N 2 + H +
Эта реакция носит немецкое название Phenolverkochung («приготовление с получением фенолов»). Образующийся фенол может реагировать с солью диазония, и поэтому реакцию проводят в присутствии кислоты, которая подавляет эту дальнейшую реакцию. [34] Гидроксилирование типа Зандмейера также возможно с использованием Cu 2 O и С 2+ в воде.
Замена нитрогруппой
[ редактировать ]Нитробензол можно получить обработкой фторбората бензолдиазония нитритом натрия в присутствии меди. Альтернативно, диазотирование анилина может быть проведено в присутствии оксида меди, который образует нитрит меди на месте:
- [С 6 Н 5 Н 2 ] + + CuNO 2 → C 6 H 5 NO 2 + N 2 + Cu +
Замена на цианогруппу
[ редактировать ]Цианогруппу обычно невозможно ввести путем нуклеофильного замещения галогенаренов , но такие соединения легко получить из солей диазония. Показательным является получение бензонитрила с использованием реагента цианида меди :
- [С 6 Н 5 Н 2 ] + + CuCN → C 6 H 5 CN + Cu + + Н 2
Эта реакция представляет собой особый тип реакции Зандмейера .
Замена трифторметильной группой
[ редактировать ]Две исследовательские группы сообщили о трифторметилировании солей диазония в 2013 году. Гуссен сообщил о получении Комплекс CuCF 3 из CuSCN, TMSCF 3 и Cs 2 CO 3 . Напротив, Фу сообщил о трифторметилировании с использованием реагента Умемото ( S -трифторметилдибензотиофения тетрафторборат) и порошка меди (условия типа Гаттермана). Их можно описать следующим уравнением:
- [С 6 Н 5 Н 2 ] + + [CuCF 3 ] → C 6 H 5 CF 3 + [Cu] + + Н 2
Скобка указывает на то, что другие лиганды меди, вероятно, присутствуют, но не указаны.
Замена тиоловой группой
[ редактировать ]Соли диазония можно превратить в тиолы в двухэтапной процедуре. Обработка хлорида бензолдиазония этилксантогенатом калия с последующим гидролизом промежуточного эфира ксантогената дает тиофенол :
- [С 6 Н 5 Н 2 ] + + C 2 H 5 OCS − 2 → C 6 H 5 SC(S)OC 2 H 5 + N 2
- C 6 H 5 SC(S)OC 2 H 5 + H 2 O → C 6 H 5 SH + HOC(S)OC 2 H 5
Замена арильной группой
[ редактировать ]Арильную группу можно соединить с другой с помощью солей арендиазония. Например, обработка хлорида бензолдиазония бензолом (ароматическим соединением) в присутствии гидроксида натрия дает дифенил :
- [С 6 Н 5 Н 2 ] + кл. − + C 6 H 6 → (C 6 H 5 ) 2 + N 2 + HCl
Эта реакция известна как реакция Гомберга-Бахмана . Аналогичная конверсия достигается также обработкой хлорида бензолдиазония этанолом и медным порошком.
Замена на боронатную сложноэфирную группу
[ редактировать ]Группу Bpin (пинаколатобора), используемую в реакциях кросс-сочетания Сузуки-Мияуры , можно установить реакцией соли диазония с бис(пинаколато)дибором в присутствии пероксида бензоила (2 моль %) в качестве инициатора: [35] Альтернативно подобное борилирование может быть достигнуто с использованием карбонильных комплексов переходных металлов, включая декакарбонил димарганца. [36]
- [С 6 Н 5 Н 2 ] + Х − + pinB-Bpin → C 6 H 5 Bpin + X-Bpin + N 2
Замена формильной группой
[ редактировать ]Формильную группу –CHO можно ввести обработкой арилдиазониевой соли формальдоксимом ( H 2 C=NOH ), с последующим гидролизом арилальдоксима с образованием арилальдегида. [37] Эта реакция известна как реакция Бука. [38]
Другие дедиазотизации
[ редактировать ]- органическим восстановлением на электроде
- мягкими восстановителями, такими как аскорбиновая кислота ( витамин С ) [39]
- гамма - излучением сольватированных электронов, генерируемых в воде
- фотоиндуцированный перенос электронов
- восстановление катионами металлов, чаще всего медной солью.
- анион-индуцированное дедиазонирование: противоион, такой как йод, обеспечивает перенос электрона к катиону диазония, образуя арильный радикал и радикал йода.
- дедиазонирование, индуцированное растворителем, где растворитель служит донором электронов
Реакция Меервейна
[ редактировать ]Хлорид бензолдиазония реагирует с соединениями, содержащими активированные двойные связи, с образованием фенилированных продуктов. Реакция называется арилированием Меервейна :
- [С 6 Н 5 Н 2 ] + кл. − + ArCH=CH−COOH → ArCH=CH−C 6 H 5 + N 2 + CO 2 + HCl
Металлические комплексы
[ редактировать ]Катионы диазония в реакциях с металлокомплексами ведут себя аналогично НЕТ + . Например, комплексы низковалентных металлов добавляют с солями диазония. Иллюстративные комплексы [Fe(CO) 2 (PPh 3 ) 2 (N 2 Ph)] + и хиральный комплекс металла Fe(CO)(NO)(PPh 3 )(N 2 Ph) . [40]
Реакции прививки
[ редактировать ]В потенциальном применении в нанотехнологиях соли диазония 4-хлорбензолдиазония тетрафторборат очень эффективно функционализируют одностенные нанотрубки . [41] Чтобы отшелушить нанотрубки, их смешивают с ионной жидкостью в ступке пестиком . Соль диазония добавляют вместе с карбонатом калия , и после измельчения смеси при комнатной температуре поверхность нанотрубок покрывается хлорфенильными группами с эффективностью 1 на 44 атома углерода. Эти добавленные заместители не позволяют трубкам образовывать плотные пучки из-за больших сил сцепления между ними, что является постоянной проблемой в технологии нанотрубок.
Также возможно функционализировать кремниевые пластины солями диазония, образующими арильный монослой. В одном исследовании поверхность кремния промывают фтористым аммонием, оставляя ее покрытой кремний-водородными связями (гидридная пассивация). [42] Реакция поверхности с раствором соли диазония в ацетонитриле в течение 2 часов в темноте является самопроизвольным процессом по свободнорадикальному механизму : [43]

К настоящему времени прививка солей диазония к металлам осуществлена на железа , кобальта , никеля , платины , палладия , цинка , меди и золота . поверхности [44] Сообщалось также о прививке на алмазные поверхности. [45] Одним из интересных вопросов является фактическое расположение арильной группы на поверхности. Исследование in silico [46] показывает, что в периоде 4 элементов от титана до меди энергия связи уменьшается слева направо, поскольку число d-электронов увеличивается. Металлы слева от железа расположены под наклоном или плоско на поверхности, что способствует образованию пи-связи между металлом и углеродом , а металлы справа от железа расположены в вертикальном положении, что способствует образованию сигма-связи между металлом и углеродом . Это также объясняет, почему до сих пор была возможна прививка солей диазония к металлам, расположенным справа от железа в периодической таблице .
Восстановление до гидразиновой группы
[ редактировать ]Соли диазония можно восстановить хлоридом олова ( SnCl 2 ) до соответствующих производных гидразина . Эта реакция особенно полезна при синтезе индола по Фишеру соединений триптановых и индометацина . Использование дитионита натрия является улучшением по сравнению с хлоридом олова, поскольку это более дешевый восстановитель, вызывающий меньше проблем с окружающей средой.
Биохимия
[ редактировать ]Ионы алканедиазония , редко встречающиеся в органической химии, считаются возбудителями канцерогенов. В частности, , что нитрозамины считается подвергаются метаболической активации с образованием разновидностей алканедиазония.

Безопасность
[ редактировать ]Твердые галогениды диазония часто взрывоопасны, и сообщалось о смертельных случаях и травмах. [11]
Природа анионов влияет на стабильность соли. Перхлораты арениазония, такие как перхлорат нитробензолдиазония, использовались для инициирования взрывчатых веществ.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Циглер, Мирослав; Пшибыльская, Мария; Элофсон, Ричард Маклауд (1982). «Кристаллическая структура тетрафторбората бензолдиазония, C 6 H 5 N 2 + •BF 4 − 1 " . Canadian Journal of Chemistry . 60 (22): 2852–2855. doi : 10.1139/v82-407 .
- ^ Д. Браво-Диас, Карлос (15 октября 2010 г.), «Диазогидроксиды, диазоэфиры и родственные виды», в Раппопорте, Цви (ред.), PATai's Chemistry of Functional Groups , John Wiley & Sons, Ltd, doi : 10.1002/ 9780470682531.pat0511 , ISBN 9780470682531
- ^ Jump up to: а б Пей, Цзянь. Основная химия ( органическая 4-е изд.).
- ^ Норман, Китайская республика (Ричард Освальд Чендлер) (2017). Принципы органического синтеза (3-е изд.). ЦРК Пресс. ISBN 9780203742068 . OCLC 1032029494 .
- ^ Стрейтвизер, Эндрю; Шеффер, Уильям Д. (июнь 1957 г.). «Стереохимия первичного углерода. VI. Реакция оптически активного 1-аминобутана-1-d с азотистой кислотой. Механизм реакции амина с азотистой кислотой1». Журнал Американского химического общества . 79 (11): 2888–2893. дои : 10.1021/ja01568a054 .
- ^ Фридман, Лестер; Юревич, Энтони Т.; Бэйлесс, Джон Х. (март 1969 г.). «Влияние растворителя на равновесие ионов диазоалкана-алкандиазония при дезаминировании аминов». Журнал Американского химического общества . 91 (7): 1795–1799. дои : 10.1021/ja01035a032 .
- ^ Кэри, Фрэнсис А. (2007). Передовая органическая химия . Сундберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. ISBN 9780387448978 . OCLC 154040953 .
- ^ Фей, На; Заутер, Базилиус; Джиллингем, Деннис (2016). «P K a кислот Бренстеда контролирует их реакционную способность с диазосоединениями» . Химические коммуникации . 52 (47): 7501–7504. дои : 10.1039/C6CC03561B . ПМИД 27212133 .
- ^ Филимонов Виктор Дмитриевич; Трусова Марина; Постников, Павел; Краснокутская Елена Александровна; Ли, Ён Мин; Хван, Хо Юн; Ким, Хёнук; Чи, Ки-Ван (18 сентября 2008 г.). «Необычайно стабильные, универсальные и чистые тозилаты арендиазония: их получение, структура и синтетическая применимость». Органические письма . 10 (18): 3961–3964. дои : 10.1021/ol8013528 . ISSN 1523-7060 . ПМИД 18722457 .
- ^ Мигелач, М.; Сильяновска, А.; Кошмрль, Дж. (2021). «Удобный подход к тозилатам арендиазония» . Красители Пигм. 184 : 108726. doi : 10.1016/j.dyepig.2020.108726 .
- ^ Jump up to: а б «Отчет о происшествии с CRHF в Великобритании: перенасыщенная соль диазония приводит к летальному исходу» . Британский форум по опасностям химических реакций. Архивировано из оригинала 6 октября 2018 года . Проверено 13 мая 2010 г.
- ^ Р. В. Хоффман (1981). «м-трифторметилбензолсульфонилхлорид». Орг. Синтез. 60 : 121. дои : 10.15227/orgsyn.060.0121 .
- ^ Jump up to: а б Клаус Хунгер, Петер Мишке, Вольфганг Рипер и др. «Азокрасители» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a03_245 .
- ^ Химия диазония и диазогрупп: Часть 1. С. Патай, Ред. 1978 Уайли-Блэквелл. ISBN 0-471-99492-8 . Химия диазония и диазогрупп: Часть 2. Под ред. С. Патаи. 1978 Уайли-Блэквелл. ISBN 0-471-99493-6 .
- ^ К. Голод. В. Хербст «Органические пигменты» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм, 2012. два : 10.1002/14356007.a20_371
- ^ Jump up to: а б Кларк, Джим. «химгид» . Проверено 28 сентября 2011 г.
- ^ Марч, Дж. «Передовая органическая химия», 4-е изд. Дж. Уайли и сыновья, 1992: Нью-Йорк. ISBN 978-0-471-60180-7 .
- ^ Мэри Энн Фокс; Джеймс К. Уайтселл (2004). Органическая химия (3, иллюстрированное изд.). Джонс и Бартлетт Обучение. стр. 535–538. ISBN 978-0-7637-2197-8 .
- ^ Аткинсон, скорая помощь; Лоулер, HJ (1927). «Дифеновая кислота». Орг. Синтез. 7:30 . дои : 10.15227/orgsyn.007.0030 .
- ^ Логулло, FM; Зейтц, А.Х.; Фридман, Л. (1968). «Бензолдиазоний-2-карбокси- и бифенилен». Орг. Синтез. 48 : 12. дои : 10.15227/orgsyn.048.0012 .
- ^ Л. Гаттерманн (1894). «Исследования диазосоединений» . Отчеты Немецкого химического общества . 23 (1): 1218–1228. дои : 10.1002/cber.189002301199 .
- ^ Лукас, HJ; Кеннеди, ER (1939). «Йодбензол». Орг. Синтез. 19:55 . дои : 10.15227/orgsyn.019.0055 .
- ^ Наводнение, DT (1933). «Фторбензол». Орг. Синтез. 13:46 . дои : 10.15227/orgsyn.013.0046 . .
- ^ Фуруя, Такеру; Кляйн, Йоханнес EMN; Риттер, Тобиас (2010). «Образование связи C – F для синтеза арилфторидов» . Синтез . 2010 (11): 1804–1821. дои : 10.1055/s-0029-1218742 . ПМЦ 2953275 . ПМИД 20953341 .
- ^ Рейнхард Брукнер, изд. Майкл Хармата; Органические механизмы, реакции, стереохимия и синтез, 3-е изд., стр. 246, ISBN 978-3-8274-1579-0
- ^ ДеТарр, DF; Косуге, Т. (1958). «Механизмы реакций солей диазония. VI. Реакции солей диазония со спиртами в кислых условиях; данные о переносе гидрида1». Журнал Американского химического общества . 80 (22): 6072–6077. дои : 10.1021/ja01555a044 .
- ^ Фридлендер, Бер., 1889, 587, 22.
- ^ Гранмуген, Бер., 1907, 40, 858.
- ^ Байер и Пфитцингер, Бер., 1885, 18, 90, 786.
- ^ HE Ungnade, EF Orwoll (1943). «3-Бром-4-гидрокситолуол». Орг. Синтез. 23:11 . дои : 10.15227/orgsyn.023.0011 .
- ^ Казем-Ростами, Масуд (2017). «Простое получение фенола». Синлетт . 28 (13): 1641–1645. дои : 10.1055/s-0036-1588180 . S2CID 99294625 .
- ^ Кэри, ФА; Сундберг, Р.Дж. (2007). Продвинутая органическая химия . Том. Б, Глава 11: Спрингер. стр. 1028 .
{{cite book}}: CS1 maint: местоположение ( ссылка ) - ^ Хазаи, Ардешир; Казем-Ростами, Масуд; Заре, Абдолкарим; Мусави-Заре, Ахмад Реза; Садегпур, Махди; Афхами, Аббас (2013). «Синтез, характеристика и применение полисульфона на основе триазина в качестве адсорбента красителя». Журнал прикладной науки о полимерах . 129 (6): 3439–3446. дои : 10.1002/app.39069 .
- ^ РГФ Манске (1928). « М -Нитрофенол». Орг. Синтез. 8 : 80. дои : 10.15227/orgsyn.008.0080 .
- ^ Ву, Цзе; Гао, Юэцю; Цю, Гуаньиньшэн; Он, Линман (20 августа 2014 г.). «Удаление аминогрупп из анилинов реакциями на основе солей диазония». Органическая и биомолекулярная химия . 12 (36): 6965–6971. дои : 10.1039/C4OB01286K . ISSN 1477-0539 . ПМИД 25093920 .
- ^ Фэрламб, Ян; Ферт, Джеймс Д.; Хаммарбак, Л. Андерс; Берден, Томас Дж.; Иствуд, Джонатан Б.; Дональд, Джеймс Р.; Горбачевский, Крис С.; МакРоби, Мэтью Т.; Трамазёр, Адам; Кларк, Ян П.; Таури, Майкл; Робинсон, Алан; Кригер, Жан-Филипп; Линам, Джейсон М. (2020). «Борилирование солей арила диазония, инициированное светом и марганцем: механистический взгляд на сверхбыструю временную шкалу, выявленный с помощью спектроскопического анализа с временным разрешением» . Химия – Европейский журнал . 27 (12): 3979–3985. дои : 10.1002/chem.202004568 . ПМИД 33135818 . S2CID 226232322 .
- ^ «Процедура органического синтеза» . 2-бром-4-метилбензальдегид . Архивировано из оригинала 20 декабря 2013 г. Проверено 4 мая 2021 г.
- ^ Бич, WF (1 января 1954 г.). «Получение ароматических альдегидов и кетонов из солей диазония» . Журнал Химического общества (возобновленный) : 1297–1302. дои : 10.1039/JR9540001297 . ISSN 0368-1769 .
- ^ Пиначо Крисостомо Фернандо (2014). «Аскорбиновая кислота как инициатор прямого CH-арилирования (гетеро)аренов нитрозированными анилинами in situ». Angewandte Chemie, международное издание . 53 (8): 2181–2185. дои : 10.1002/anie.201309761 . ПМИД 24453180 .
- ^ Саттон, Д. (1993). «Металлоорганические диазосоединения». хим. Преподобный . 93 (3): 905–1022. дои : 10.1021/cr00019a008 .
- ^ Прайс, Б. Кэтрин (2005). «Зеленая химическая функционализация одностенных углеродных нанотрубок в ионных жидкостях». Журнал Американского химического общества . 127 (42): 14867–14870. дои : 10.1021/ja053998c . ПМИД 16231941 .
- ^ Майкл П. Стюарт; Франсиско Майя; Дмитрий В. Косынкин; и др. (2004). «Прямая ковалентная прививка сопряженных молекул на поверхности Si, GaAs и Pd из солей арендиазония». Дж. Ам. хим. Соц. 126 (1): 370–8. дои : 10.1021/ja0383120 . ПМИД 14709104 .
- ^ Последовательность реакции: реакция поверхности кремния с фторидом аммония создает гидридный слой. Электрон переносится с поверхности кремния на соль диазония при уменьшении потенциала разомкнутой цепи, оставляя катион-радикал кремния и радикал диазония. На следующем этапе протон и молекула азота выбрасываются, и два радикальных остатка рекомбинируются, создавая поверхностную связь кремния с углеродом.
- ^ Беланжер, Даниэль; Пинсон, Джин (2011). «Электротрансплантация: мощный метод модификации поверхности» . Обзоры химического общества . 40 (7): 3995–4048. дои : 10.1039/c0cs00149j . ISSN 0306-0012 . ПМИД 21503288 .
- ^ СК Луд; М. Стинакерс; П. Бруно; и др. (2006). «Химическая прививка самоорганизующихся монослоев бифенила на ультрананокристаллический алмаз». Дж. Ам. хим. Соц. 128 (51): 16884–91. дои : 10.1021/ja0657049 . ПМИД 17177439 .
- ^ Дэн Цзян; Бобби Г. Самптер; Шэн Дай (2006). «Структура и связь между арильной группой и металлическими поверхностями». Дж. Ам. хим. Соц. 128 (18): 6030–1. дои : 10.1021/ja061439f . ПМИД 16669660 . S2CID 41590197 .
- ^ Трикер, Арканзас; Пройсманн, Р. (1991). «Канцерогенные N -нитрозамины в пище: возникновение, образование, механизмы и канцерогенный потенциал». Исследования мутаций/Генетическая токсикология . 259 (3–4): 277–289. дои : 10.1016/0165-1218(91)90123-4 . ПМИД 2017213 .
Внешние ссылки
[ редактировать ]- В. Ройш. «Реакции аминов» . Виртуальный текст органической химии . Мичиганский государственный университет . Архивировано из оригинала 12 декабря 2012 г.



