Реакция Зандмейера
| Реакция Зандмейера | |
|---|---|
| Назван в честь | Трауготт Сандмейер |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | реакция Зандмейера |
| RSC Идентификатор онтологии | RXNO: 0000021 |
Реакция Зандмейера — это химическая реакция, используемая для синтеза арилгалогенидов из солей арилдиазония с использованием солей меди в качестве реагентов или катализаторов. [ 1 ] [ 2 ] [ 3 ] [ 4 ] Это пример радикально-нуклеофильного ароматического замещения . Реакция Зандмейера обеспечивает метод, с помощью которого можно выполнять уникальные превращения бензола, такие как галогенирование , цианирование , трифторметилирование и гидроксилирование .
Реакция была открыта в 1884 году швейцарским химиком Трауготтом Зандмейером , когда он попытался синтезировать фенилацетилен из хлорида бензолдиазония и ацетилида меди(I) . Вместо этого основным продуктом, который он выделил, был хлорбензол . [ 5 ] В настоящее время реакцией Зандмейера называют любой метод замещения ароматической аминогруппы путем получения ее диазониевой соли с последующим ее замещением нуклеофилом в присутствии каталитических солей меди (I).
Наиболее часто используемыми реакциями Зандмейера являются реакции хлорирования, бромирования, цианирования и гидроксилирования с использованием CuCl , CuBr , CuCN и Cu 2 O соответственно. Совсем недавно было разработано трифторметилирование солей диазония, которое называется реакцией типа Зандмейера. Соли диазония реагируют также с боронатами, иодидом, тиолами , водой, фосфорноватистой кислотой и др. [ 6 ] а фторирование можно провести с использованием тетрафторборат-анионов ( реакция Бальца-Шимана ). Однако, поскольку эти процессы не требуют металлического катализатора, их обычно не называют реакциями Зандмейера. Во многих разработанных вариантах также использовались соли других переходных металлов, включая медь (II), железо (III) и кобальт (III). [ 7 ] Благодаря широкой синтетической применимости реакция Зандмейера, наряду с другими превращениями соединений диазония, является комплементарной электрофильному ароматическому замещению .
Механизм реакции
[ редактировать ]Реакция Зандмейера является примером радикально-нуклеофильного ароматического замещения (S RN Ar). Радикальный механизм реакции Зандмейера подтверждается обнаружением побочных биарильных продуктов. [ 8 ] Замещение ароматической диазогруппы галогеном или псевдогалогеном инициируется по механизму одноэлектронного переноса, катализируемому медью(I), с образованием арильного радикала с потерей газообразного азота. [ 9 ] [ 10 ] [ 11 ] [ 8 ] Замещенный арен , возможно, образуется в результате прямого переноса Cl, Br, CN или OH от частиц меди (II) к арильному радикалу с образованием замещенного арена и регенерации катализатора меди (I). В альтернативном предложении временный промежуточный продукт меди (III), образующийся в результате сочетания арильного радикала с частицами меди (II), подвергается быстрому восстановительному элиминированию с образованием продукта и регенерацией меди (I). [ 12 ] [ 13 ] [ 14 ] Однако доказательства существования такого медьорганического промежуточного соединения слабы и в основном косвенны. [ 15 ] [ 16 ] и точный путь может зависеть от субстрата и условий реакции.
Одиночный перенос электрона
[ редактировать ]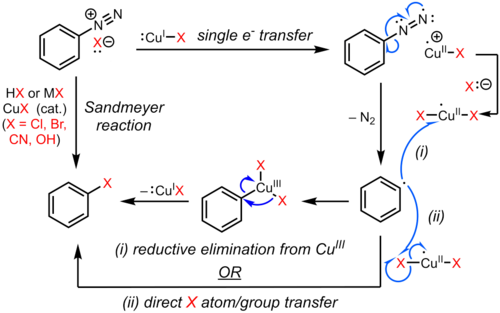
Синтетические приложения
[ редактировать ]Вариации реакции Зандмейера были разработаны для различных синтетических применений. Эти реакции обычно протекают через образование арилдиазониевой соли с последующей реакцией с солью меди (I) с образованием замещенного арена:
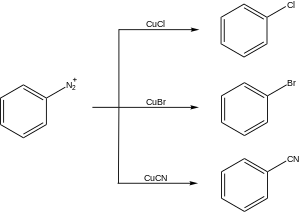
Существует множество синтетических применений реакции Зандмейера.
ион галогена
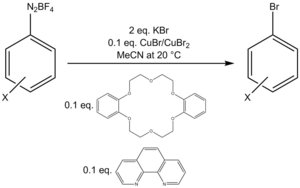
[ редактировать ]Одним из наиболее важных применений реакции Зандмейера является образование арилгалогенидов. Растворителем выбора для синтеза йодаренов является дииодметан . [ 17 ] [ 18 ] для синтеза бромаренов бромоформ тогда как используют . Для синтеза хлораренов . хлороформ предпочтительным растворителем является [ 19 ] Синтез (+)- куркуфенола , биоактивного соединения, проявляющего противогрибковую и противораковую активность, использует реакцию Зандмейера для замены аминогруппы бромгруппой. [ 20 ]

В одном протоколе бромирования используется смесь Cu(I)/Cu(II) с дополнительными количествами бидентатного лиганда фенантролина и катализатора фазового переноса дибензо-18-краун-6 для превращения соли тетрафторбората арилдиазония в арилбромид. [ 21 ]
В реакции Бальца-Шимана используется тетрафторборат и образуется галогенидзамещенный продукт, фторбензол , который не получается при использовании фторидов меди . В этой реакции проявляются мотивы, характерные для реакции Зандмейера. [ 22 ]
Цианирование
[ редактировать ]Другое применение реакции Зандмейера — цианирование , которое позволяет образовывать бензонитрилы , важный класс органических соединений. Ключевое промежуточное соединение в синтезе антипсихотического препарата Флуанксол синтезируется путем цианирования по реакции Зандмейера. [ 23 ]

Реакция Сандмейера также использовалась при синтезе неоамфимедина, соединения, которое, как предполагается, воздействует на топоизомеразу II в качестве противоракового препарата. [ 24 ]

Трифторметилирование
[ редактировать ]Показано, что реакции типа Зандмейера можно использовать для получения арильных соединений, функционализированных трифторметильными заместителями. Этот процесс трифторметилирования обеспечивает уникальные химические свойства с широким спектром практических применений. В частности, фармацевтические препараты с группами CF 3 обладают повышенной метаболической стабильностью , липофильностью и биодоступностью . Реакции трифторметилирования типа Зандмейера характеризуются мягкими условиями реакции и большей толерантностью к функциональным группам по сравнению с более ранними методами трифторметилирования. [ 25 ] [ 26 ] Пример реакции трифторметилирования типа Зандмейера представлен ниже. [ 27 ]

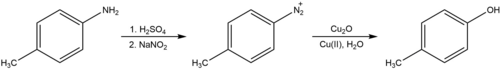
Гидроксилирование
[ редактировать ]Реакцию Зандмейера также можно использовать для превращения ариламинов в фенолы путем образования арилдиазониевой соли. В присутствии медного катализатора, такого как оксид меди (I) , и избытка нитрата меди (II) эта реакция легко протекает в нейтральной воде комнатной температуры. [ 28 ] Это контрастирует с классической процедурой (известной под немецким названием Verkochung ), которая требует кипячения соли диазония в водной кислоте, процесса, который, как полагают, включает в себя арильный катион вместо радикала и, как известно, приводит к образованию других побочные продукты нуклеофильного присоединения в дополнение к желаемому продукту гидроксилирования.
Ссылки
[ редактировать ]- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 984–985, ISBN 978-0-471-72091-1
- ^ Трауготт Зандмейер (1884 г.). «О замене амидной группы хлором в ароматических веществах» . Отчеты Немецкого химического общества . 17 (3): 1633–1635. дои : 10.1002/cber.18840170219 .
- ^ Трауготт Зандмейер (1884 г.). «О замене амидной группы хлором, бромом и цианом в ароматических веществах» . Отчеты Немецкого химического общества . 17 (4): 2650–2653. дои : 10.1002/cber.188401702202 .
- ^ Людвиг Гаттерманн (1890). «Исследования диазосоединений» . Отчеты Немецкого химического общества . 23 (1): 1218–1228. дои : 10.1002/cber.189002301199 .
- ^ Ходжсон, Герберт Х. (1 апреля 1947 г.). «Реакция Зандмейера». Химические обзоры . 40 (2): 251–277. дои : 10.1021/cr60126a003 . ISSN 0009-2665 . ПМИД 20291034 .
- ^ Ван, Зеронг (2010). «Реакция Зандмейера». Комплексные органические реакции и реагенты . John Wiley & Sons, Inc., стр. 2471–2475. ISBN 9780470638859 .
- ^ Член парламента Дойл, Б. Зигфрид и Дж. Ф. Деллария (1977). «Реакции дезаминирования алкилнитрит-металлогалогенидов. 2. Заместительное дезаминирование ариламинов алкилнитритами и галогенидами меди (II). Прямое и чрезвычайно эффективное превращение ариламинов в арилгалогениды». Дж. Орг. хим. 42 (14): 2426–2431. дои : 10.1021/jo00434a017 .
- ^ Jump up to: а б Галли, Карло (август 1988 г.). «Радикальные реакции ионов арендиазония: легкий ввод в химию арильного радикала». Химические обзоры . 88 (5): 765–792. дои : 10.1021/cr00087a004 .
- ^ Дж. К. Кочи (1957). «Механизм реакций Зандмейера и Меервейна». Дж. Ам. хим. Соц. 79 (11): 2942–2948. дои : 10.1021/ja01568a066 .
- ^ Х. Х. Ходжсон (1947). «Реакция Зандмейера». хим. Откр. 40 (2): 251–277. дои : 10.1021/cr60126a003 . ПМИД 20291034 .
- ^ Нонхебель, округ Колумбия; Уотерс, Вашингтон (8 октября 1957 г.). «Исследование механизма реакции Зандмейера». Труды Королевского общества A: Математические, физические и технические науки . 242 (1228): 16–27. Бибкод : 1957РСПСА.242...16Н . дои : 10.1098/rspa.1957.0150 . S2CID 97536209 .
- ^ Анслин, Эрик В. (2006). Современная физическая органическая химия . Догерти, Деннис А., 1952-. Саусалито, Калифорния: Университетская наука. ISBN 978-1891389313 . OCLC 55600610 .
- ^ К., Воллхардт, К. Питер (29 января 2018 г.). Органическая химия: строение и функции . Шор, Нил Эрик, 1948- (8-е изд.). Нью-Йорк. ISBN 9781319079451 . OCLC 1007924903 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кэри, Фрэнсис А. (2007). Передовая органическая химия. Часть Б. Реакции и синтез . Сундберг, Ричард Дж., 1938- (5-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. ISBN 9781601195494 . ОСЛК 223941000 .
- ^ Тиммс, Аллан В.; Уолтон, Пол Х.; Роуэлл, Саймон С.; Хэнсон, Питер (28 июня 2004 г.). «Стимулирование гидроксилирования Зандмейера (гомолитического гидроксидедиазонирования) и гидродедиазонирования путем хелатирования медного катализатора: бидентатные лиганды». Органическая и биомолекулярная химия . 2 (13): 1838–1855. дои : 10.1039/B404699D . ISSN 1477-0539 . ПМИД 15227536 .
- ^ Тиммс, Аллан В.; Уолтон, Пол Х.; Тейлор, Алек Б.; Роуэлл, Саймон С.; Хэнсон, Питер (22 мая 2002 г.). «Реакции Зандмейера. Часть 6. Механистическое исследование стадий восстановления и переноса лиганда при цианировании Зандмейера». Журнал Химического общества, Perkin Transactions 2 (6): 1126–1134. дои : 10.1039/B200747A . ISSN 1364-5471 .
- ^ У. Б. Смит; О. К. Хо (1990). «Применение изоамилнитрит-дииодметанового пути к арилйодидам». Дж. Орг. Хим . 55 (8): 2543–2545. дои : 10.1021/jo00295a056 .
- ^ В. Наир; С.Г. Ричардсон (1982). «Модификация оснований нуклеиновых кислот с помощью радикальных промежуточных продуктов: синтез дигалогенированных пуриновых нуклеозидов». Синтез . 1982 (8): 670–672. дои : 10.1055/s-1982-29896 .
- ^ ДЖИГ Кадоган; Д. А. Рой; Д.М. Смит (1966). «Альтернатива реакции Зандмейера». Дж. Хим. Соц. : 1249–1250. дои : 10.1039/J39660001249 .
- ^ Ким, Сунг-Гон; Ким, Джехак; Юнг, Хиджон (апрель 2005 г.). «Эффективный полный синтез (+)-куркуфенола посредством асимметричного органокатализа». Буквы тетраэдра . 46 (14): 2437–2439. дои : 10.1016/j.tetlet.2005.02.047 .
- ^ P. Beletskaya; Alexander S. Sigeev; Alexander S. Peregudov; Pavel V. Petrovskii (2007). "Catalytic Sandmeyer Bromination". Synthesis . 2007 (16): 2534–2538. doi : 10.1055/s-2007-983784 .
- ^ Ван, Зеронг (2009). Комплексные органические реакции и реагенты . Хобокен, Нью-Джерси: Джон Уайли. стр. 185–190. ISBN 9780471704508 .
- ^ Нильсен, Мартин Анкер; Нильсен, Майкл Ким; Питтельков, Томас (ноябрь 2004 г.). «Масштабирование и оценка безопасности реакции Зандмейера». Исследования и разработки органических процессов . 8 (6): 1059–1064. дои : 10.1021/op0498823 .
- ^ ЛаБарбера, Дэниел В.; Бугни, Тим С.; Ирландия, Крис М. (октябрь 2007 г.). «Полный синтез неоамфимедина» . Журнал органической химии . 72 (22): 8501–8505. дои : 10.1021/jo7017813 . ПМК 2547140 . ПМИД 17900144 .
- ^ Браун, Дункан Л. (3 февраля 2014 г.). «Реакция трифторметилирования Зандмейера: метод преобразования C–N в C–CF». Angewandte Chemie, международное издание . 53 (6): 1482–1484. дои : 10.1002/anie.201308997 . ПМИД 24376150 .
- ^ Дай, Цзянь-Цзинь; Сяо, Бинь; Лю, Чжао-Цзин; Лю, Лэй, Яо (12 июня 2013 г.). Реакция трифторметилирования». Журнал Американского химического общества . 135 (23): 8436–8439. doi : 10.1021/ja404217t . PMID 23718557 .
- ^ Данун, Грегори; Баярмагнай, Билгуун; Грюнберг, Матиас Ф.; Гуссен, Лукас Дж. (29 июля 2013 г.). «Трифторметилирование Сандмейером тетрафторборатов арендиазония». Angewandte Chemie, международное издание . 52 (31): 7972–7975. дои : 10.1002/anie.201304276 . ПМИД 23832858 .
- ^ Коэн, Теодор ; Дитц, Альберт Г.; Скупой, Джейн Р. (1 июня 1977 г.). «Простое получение фенолов из ионов диазония путем генерации и окисления арильных радикалов солями меди». Журнал органической химии . 42 (12): 2053–2058. дои : 10.1021/jo00432a003 . ISSN 0022-3263 .