Цианирование
В органическом синтезе цианирование — присоединение или замещение цианидной группы в различных субстратах . Такие преобразования имеют высокую ценность, поскольку они генерируют связи CC. Кроме того, нитрилы представляют собой универсальные функциональные группы.
Цианирование с образованием sp 3 нитрилы
[ редактировать ]Обычно алкилнитрилы образуются посредством цианирования типа SN 1 или SN 2 алкилэлектрофилами. Показательным является синтез бензилцианида по реакции бензилхлорида и цианида натрия. [ 1 ] В некоторых случаях цианид меди . вместо цианида натрия используют [ 2 ]
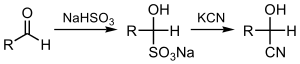
Цианирование кетонов или альдегидов дает соответствующие циангидрины , что можно осуществить непосредственно с помощью цианид-иона ( реакция циангидрина ) или с помощью бисульфита с последующим замещением сульфита: [ 3 ] [ 4 ]
Родственной реакцией является гидроцианирование , в ходе которого устанавливаются элементы H-CN.
Цианирование аренов
[ редактировать ]Цианирование аренов открывает доступ к производным бензойной кислоты , а также позволяет использовать сами арилнитрилы в качестве чистых химикатов:

Известно множество механистически различных путей образования цианатаренов:
С ареном как двухэлектронным электрофилом
[ редактировать ]В то время как классическая реакция Розенмунда фон-Брауна использует стехиометрический цианид меди (I) в качестве источника цианирования, [ 5 ] были разработаны новые варианты, которые являются каталитическими по меди : [ 6 ]

Кроме того, катализируемые палладием цианирования арилгалогенидов широко исследованы . Обычно KCN или его менее токсичный заменитель Zn(CN) 2 используют в качестве источников нуклеофильных цианидов . Чтобы еще больше уменьшить токсичности проблемы феррицианид калия , в качестве источника цианида также использовался каталитические циклы . Считается, что протекают по стандартному пути Pd (0/II) с восстановительным элиминированием, образующим ключевую связь CC. Деактивация Pd(II) избытком цианида является распространенной проблемой. [ 7 ] Разработаны условия палладиевого катализа арилиодидов, бромидов и даже хлоридов: [ 8 ]

Цианирование, катализируемое никелем, позволяет избежать использования драгоценных металлов и может использовать бензилцианид или ацетонитрил в качестве источника цианида за счет восстановительного разрыва связи CC: [ 9 ]

Цианирование Сандмейера — это способ превращения производных анилина в бензонитрилы. [ 10 ] Обычно постулируется, что цианирование является двухэлектронным, тогда как с радикальными медиаторами в отсутствие металлов реакция, скорее всего, будет радикальной. [ 11 ]
С ареном как двухэлектронным нуклеофилом
[ редактировать ]Металлированные арены могут быть цианированы электрофильными источниками цианидов, включая цианамиды , цианаты , диметилмалононитрил или этил(этоксиметилен)цианоацетат. Эти методы могут осуществляться с участием переходных металлов или без него: [ 12 ]

С ареном как радикальным электрофилом
[ редактировать ]радикальные подходы к цианированию арена CH Известны . Фотоокислительно-восстановительные медиаторы (металлические или органические) наиболее распространены: [ 13 ] [ 14 ]

Ссылки
[ редактировать ]- ^ Адамс, Роджер; Таль, А. Ф. (1922). «Бензилцианид». Органические синтезы . 2 : 9. дои : 10.15227/orgsyn.002.0009 .
- ^ Й. В. Супневский; П. Л. Зальцберг (1928). «Аллилцианид». Орг. Синтез . 8 :4. дои : 10.15227/orgsyn.008.0004 .
- ^ Моури, Дэвид Т. (1948). «Получение нитрилов» . Химические обзоры . 42 (2): 189–283. дои : 10.1021/cr60132a001 . ISSN 0009-2665 . ПМИД 18914000 .
- ^ Корсон, Б.Б.; Додж, РА; Харрис, ЮАР; Да, Дж. С. (1926). «Миндальная кислота». Орг. Синтез . 6:58 . дои : 10.15227/orgsyn.006.0058 .
- ^ Варцеха, Клаус-Дитер. «цианидное замещение бромбензола» .
- ^ Ву, Джефф (2002). «Каталитическая реакция Розенмунда – фон Брауна в ионных жидкостях на основе галогенидов». Буквы тетраэдра . 43 (3): 387–389. дои : 10.1016/s0040-4039(01)02168-2 .
- ^ Коэн, Дэниел (2015). «Мягкое палладий-катализируемое цианирование (гетеро)арилгалогенидов и трифлатов в водных средах» . Органические письма . 17 (2): 202–205. дои : 10.1021/ol5032359 . ПМК 4301087 . ПМИД 25555140 .
- ^ Цзинь, Фуцян (2000). «Реакции цианирования арилхлоридов, катализируемые палладием». Буквы тетраэдра . 41 (18): 3271–3273. дои : 10.1016/s0040-4039(00)00384-1 .
- ^ Уэда, Ёхей (2019). «Никель-катализируемое цианирование арилгалогенидов и трифлатов с использованием ацетонитрила посредством разрыва связи C–CN при содействии 1,4-бис (триметилсилил)-2,3,5,6-тетраметил-1,4-дигидропиразина» . Химическая наука . 10 (4): 994–999. дои : 10.1039/c8sc04437f . ПМК 6349056 . ПМИД 30774893 .
- ^ Х. Т. Кларк; Р. Р. Рид (1925). «о-толунитрил и п-толунитрил». Орг. Синтез . 4:69 . дои : 10.15227/orgsyn.004.0069 .
- ^ Барберо, Маргарита (2016). «Цианирование по Сандмейеру о-бензолдисульфонимидов арендиазония без содержания меди». Органическая и биомолекулярная химия . 14 (4): 1437–1441. дои : 10.1039/c5ob02321a . hdl : 2318/1554335 . ПМИД 26676962 .
- ^ Ривз, Джонатан (2015). «Траннитрилирование диметилмалононитрила в арил-гриньяровские и литиевые реагенты: практический метод синтеза арилнитрила». Журнал Американского химического общества . 137 (29): 9481–9488. дои : 10.1021/jacs.5b06136 . ПМИД 26151426 .
- ^ Равелли, Давиде; Протти, Стефано; Фаньони, Маурицио (2016). «Реакции образования углерод-углеродной связи через фотогенерированные промежуточные продукты». Химические обзоры . 116 (17): 9850–9913. doi : 10.1021/acs.chemrev.5b00662 . ПМИД 27070820 .
- ^ Ли, Цзе Джек (2015). Активация связей CH в органическом синтезе . CRC Press, Taylor & Francisco Group.