Диазо

В органической химии диазогруппа состоящую представляет собой органическую группу, из двух связанных атомов азота в концевом положении. с нейтральным зарядом, Органические соединения содержащие диазогруппу, связанную с атомом углерода , называются диазосоединениями или диазоалканами. [а] и описываются общей структурной формулой Р 2 С=Н + =Н − . Простейшим примером диазосоединения является диазометан . СН 2 Н 2 . Диазосоединения ( R 2 C=N 2 ) не следует путать с азосоединениями ( R−N=N−R ) или с соединениями диазония ( R−N + 2 ).
Структура [ править ]
Электронная структура диазосоединений характеризуется π-электронной плотностью, делокализованной по α-углероду и двум атомам азота, а также ортогональной π-системой с электронной плотностью, делокализованной только по концевым атомам азота. Поскольку все резонансные формы диазосоединений, удовлетворяющие правилу октетов, имеют формальные заряды, они являются членами класса соединений, известных как 1,3-диполи . Одними из наиболее стабильных диазосоединений являются α-диазо-β-дикетоны и α-диазо-β-диэфиры, в которых электронная плотность дополнительно делокализована в электроноакцепторную карбонильную группу. Напротив, большинство диазоалканов без электроноакцепторных заместителей, включая сам диазометан, взрывоопасны. Коммерчески значимым диазосоединением является этилдиазоацетат (N 2 CHCOOEt). Группой изомерных соединений с лишь немногими схожими свойствами являются диазирины , в которых углерод и два атома азота связаны в кольцо.
четыре резонансные структуры : Можно нарисовать [1]
Соединения с диазогруппой следует отличать от соединений диазония , которые имеют ту же концевую азогруппу, но несут общий положительный заряд, и азосоединений , в которых азогруппа соединяет два органических заместителя.
История [ править ]
Диазосоединения были впервые получены Питером Гриссом , который открыл новую универсальную химическую реакцию, как подробно описано в его статье 1858 года «Предварительное уведомление о влиянии азотистой кислоты на аминонитро- и аминодинитрофенол». [2] [3]
Синтез [ править ]
Существует несколько методов получения диазосоединений. [4] [5]
Из аминов [ править ]
, замещенные альфа-акцептором, Первичные алифатические амины R-CH 2 -NH 2 (R = COOR, CN, CHO, COR) реагируют с азотистой кислотой с образованием диазосоединения.
Из диазометиловых соединений [ править ]
Примером электрофильного замещения с использованием диазометилового соединения является реакция между ацилгалогенидом и диазометаном . [6] например, первый шаг в синтезе Арндта-Эйстерта .
Путем диазопереноса [ править ]
При диазопереносе некоторые углеродные кислоты реагируют с тозилазидом в присутствии слабого основания, такого как триэтиламин или DBU . Побочным продуктом является соответствующий тозиламид ( п -толуолсульфонамид). Эту реакцию еще называют диазопереносом Регитца . [7] Примерами являются синтез трет-бутилдиазоацетата. [8] и диазомалонат. [9] Метилфенилдиазоацетат получают таким способом путем обработки метилфенилацетата п-ацетамидобензолсульфонилазидом в присутствии основания. [10] [11]

Механизм включает атаку енолята на концевой азот, перенос протона и изгнание аниона сульфонамида. Использование β-карбонилальдегида приводит к деформилирующему варианту переноса Регица, который полезен для получения диазосоединений, стабилизированных только одной карбонильной группой. [13]

Из N -алкил- N -нитрозосоединений [ править ]
Диазосоединения можно получить реакцией N элиминирования - алкил- N -нитрозосоединений, [14] например, при синтезе диазометана из Диазалда или МННГ :
(Механизм, показанный здесь, является одним из возможных вариантов. [15] Альтернативный механизм аналогичного образования диазометана из N- нитрозосульфонамида см. на странице Диазалда .)
Из гидразонов [ править ]
Гидразоны окисляются дегидрирование ( ) , например, оксидом серебра или оксидом ртути, например, при синтезе 2-диазопропана из гидразона ацетона . [16] Другими окислителями являются тетраацетат свинца , диоксид марганца и реактив Сверна . Тозилгидразоны RRC=N-NHT реагируют с основанием, например триэтиламином, при синтезе кротилдиазоацетата. [17] и в синтезе фенилдиазометана из PhCHNHT и метилата натрия . [18]
Реакция карбонильной группы с гидразином 1,2-бис(трет-бутилдиметилсилил)гидразин с образованием гидразона сопровождается реакцией с дифториодбензолом иодана с образованием диазосоединения: [19] [20]
Из азидов [ править ]
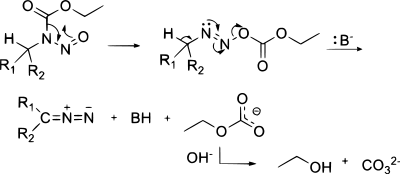
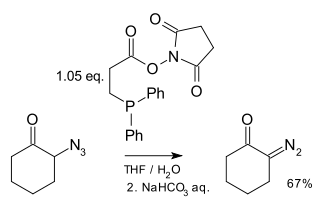
Описан один метод синтеза диазосоединений из азидов с использованием фосфинов : [21]
Реакция [ править ]
В циклоприсоединениях [ править ]
Диазосоединения реагируют как 1,3-диполи в диазоалкановых 1,3-диполярных циклоприсоединениях .
карбена предшественников качестве В
Диазосоединения используются в качестве предшественников карбенов , образующихся при термолизе или фотолизе , например при перегруппировке Вольфа . Как таковые они используются в циклопропанировании , например, в реакции этилдиазоацетата со стиролом . [22] Некоторые диазосоединения могут образовывать алкены в формальной реакции димеризации карбена .
Диазосоединения являются промежуточными продуктами Бэмфорда-Стивенса тозилгидразонов реакции с алкенами, опять же с промежуточным карбеном:
В реакции Дойла-Кирмса некоторые диазосоединения реагируют с аллилсульфидами с образованием гомоаллилсульфида. Внутримолекулярные реакции диазокарбонильных соединений открывают доступ к циклопропанам. При расширении кольца Бюхнера диазосоединения реагируют с ароматическими кольцами с расширением кольца.
Как нуклеофил [ править ]
Реакция Бюхнера -Куртиуса-Шлоттербека дает кетоны из альдегидов и алифатических диазосоединений:
Тип реакции – нуклеофильное присоединение .
Встречаемость в природе [ править ]
Несколько семейств природных продуктов содержат диазогруппу. Кинамицины с и ломаивитицин представляют собой интеркаляции ДНК диазофункциональными группами в качестве «боевых частей». В присутствии восстановителя происходит потеря N 2 с образованием расщепляющего ДНК флуоренильного радикала.
Одним из биохимических процессов образования диазо является путь L -аспартат-нитросукцинат (ANS). Он включает в себя последовательность ферментативно-опосредованных окислительно-восстановительных реакций с образованием нитрита посредством промежуточного соединения нитроянтарной кислоты. Этот путь, по-видимому, активен у нескольких различных видов Streptomyces , а гомологичные гены широко распространены у актинобактерий . [23]
См. также [ править ]
Примечания [ править ]
- ^ Термин «диазоалкан» используется некоторыми авторами для обозначения любого замещенного диазометана (т.е. всех диазосоединений). Однако другие авторы используют этот термин исключительно для обозначения диазосоединений с алкильными заместителями, которые не содержат других функциональных групп (что исключает такие соединения, как диазо(дифенил)метан или этилдиазоацетат).
Ссылки [ править ]
- ^ Ф.А. Кэри Р.Дж. Сундберг. Передовая органическая химия , 2-е издание.
- ^ Тревор И. Уильямс, «Грисс, (Иоганн) Питер (1829–1888)», Оксфордский национальный биографический словарь , Oxford University Press, 2004 г.
- ^ Питер Грисс (1858) «Предварительное уведомление о реакции азотистой кислоты с пикрамовой кислотой и аминонитрофенолом» , Annals of Chemistry and Pharmacie , 106 : 123-125.
- ^ Марч, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура, 3-е издание , Нью-Йорк: Wiley, ISBN 9780471854722 , OCLC 642506595
- ^ Новые синтезы диазосоединений Герхард Маас Ангью. хим. Межд. Эд. 2009 , 48, 8186 – 8195 два : 10.1002/anie.200902785
- ^ Пример органического синтеза , Сб. Том. 3, с.119 (1955); Том. 26, с.13 (1946). Связь
- ^ М. Регитц, Ангью. Chem., 79, 786 (1967); Энджью. хим. Стажер. Эд. англ., 6, 733 (1967).
- ^ Органические синтезы, Сб. Том. 5, с.179 (1973); Том. 48, с.36 (1968). Связь
- ^ Органические синтезы, Сб. Том. 6, с.414 (1988); Том. 59, с.66 (1979). Связь
- ^ Хью М.Л. Дэвис; Вэнь-хао Ху; Донг Син (2015). «Метилфенилдиазоацетат». ЭЭРОС : 1–10. doi : 10.1002/047084289X.rn00444.pub2 . ISBN 978-0-470-84289-8 .
- ^ Сельварадж, Рамаджеям; Чинтала, Шриниваса Р.; Тейлор, Майкл Т.; Фокс, Джозеф М. (2014). «3-Гидроксиметил-3-фенилциклопропен». Орг. Синтез . 91 : 322. дои : 10.15227/orgsyn.091.0322 .
- ^ Шишков, ИВ; Ромингер, Ф.; Хофманн, П. (2009). «Удивительно стабильные α-карбонилкарбены меди (I): синтез, структура и механистические исследования реакций циклопропанирования алкенов». Металлоорганические соединения . 28 (4): 1049–1059. дои : 10.1021/om8007376 .
- ^ Курти, Ласло (2005). Стратегическое применение названных реакций в органическом синтезе: предпосылки и подробные механизмы . Чако, Барбара. Берлингтон: Elsevier Science. ISBN 978-0-08-057541-4 . OCLC 850164343 .
- ^ Пример: Органический синтез, Сб. Том. 6, с.981 (1988); Том. 57, с.95 (1977). Связь
- ^ Химия диазония и диазогрупп. Часть 1 . Патай, Сол., Wiley InterScience (онлайн-сервис). Чичестер: Уайли. 1978. ISBN 978-0-470-77154-9 . OCLC 501316965 .
{{cite book}}: CS1 maint: другие ( ссылка ) - ^ Органические синтезы, Сб. Том. 6, с.392 (1988); Том. 50, с.27 (1970). Связь
- ^ Органические синтезы, Сб. Том. 5, с.258 (1973); Том. 49, с.22 (1969). Связь
- ^ Органические синтезы, Сб. Том. 7, с.438 (1990); Том. 64, с.207 (1986). http://www.orgsyn.org/orgsyn/prep.asp?prep=CV7P0438
- ^ Лей, X.; Порко Джа, Дж. (2006). «Тотальный синтез диазобензофлуоренового антибиотика (-)-кинамицина C1». Журнал Американского химического общества . 128 (46): 14790–14791. дои : 10.1021/ja066621v . ПМИД 17105273 .
- ^ Синтезирован неуловимый натуральный продукт Стю Борман Новости химии и техники , 31 октября 2006 г. Ссылка. Архивировано 28 августа 2008 г. на Wayback Machine .
- ^ Фосфин-опосредованное превращение азидов в диазосоединения Эдди Л. Майерс и Рональд Т. Рейнс Энджью. хим. Межд. Эд. 2009 , 48, 2359 –2363 два : 10.1002/anie.200804689
- ^ Органические синтезы, Сб. Том. 6, с.913 (1988); Том. 50, с.94 (1970). Связь
- ^ Хагихара, Рёта; Кацуяма, Ёхей; Сугай, Ёсинори; Онака, Хироясу; Ониши, Ясуо (2018). «Новые производные десферриоксамина, синтезированные с использованием специфического для вторичного метаболизма пути биосинтеза азотистой кислоты у Streptomyces davawensis ». Дж. Антибиот . 71 (11): 911–919. дои : 10.1038/s41429-018-0088-1 . ПМИД 30120394 .