Окисление Сверна
| Окисление Сверна | |
|---|---|
| Назван в честь | Дэниел Сверн |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Swern-окисление |
| RSC Идентификатор онтологии | RXNO: 0000154 |
| | |
В органической химии , окисление Сверна названное в честь Дэниела Сверна , представляет собой химическую реакцию , в результате которой образуется первичный или вторичный спирт (( −OH ) окисляется до альдегида ( −CH=O ) или кетон ( >C=O ) с использованием оксалилхлорида , диметилсульфоксида (ДМСО) и органического основания , такого как триэтиламин . [ 1 ] [ 2 ] [ 3 ] Это одна из многих реакций окисления, обычно называемых окислением «активированного ДМСО». Реакция известна своим мягким характером и широкой толерантностью к функциональным группам . [ 4 ] [ 5 ] [ 6 ] [ 7 ]

Побочными продуктами являются диметилсульфид ((CH 3 ) 2 S), окись углерода (CO), диоксид углерода (CO 2 ) и – когда в качестве основания используется триэтиламин – хлорид триэтиламмония (Et 3 NHCl). Из летучих побочных продуктов диметилсульфид имеет сильный, распространяющийся запах, а окись углерода очень токсична, поэтому реакцию и обработку необходимо проводить в вытяжном шкафу. Диметилсульфид представляет собой летучую жидкость (температура кипения 37 °C) с неприятным запахом даже в низких концентрациях. [ 8 ] [ 9 ] [ 10 ]
Механизм
[ редактировать ]Первой стадией окисления Сверна является низкотемпературная реакция ДМСО, 1a , формально являющегося резонансным вкладчиком 1b , с оксалилхлоридом, 2 . Первое промежуточное соединение 3 быстро разлагается с выделением углекислого газа и монооксида углерода и образованием хлорида хлор(диметил)сульфония 4 .
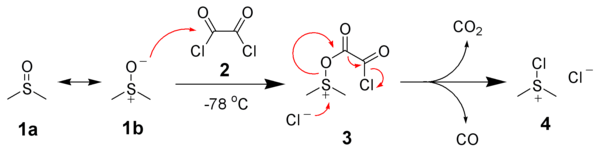
После добавления спирта 5 хлорид хлор(диметил)сульфония 4 реагирует со спиртом с образованием ключевого промежуточного иона алкоксисульфония 6 . Добавление по меньшей мере 2 эквивалентов основания (обычно триэтиламина) приведет к депротонированию иона алкоксисульфония с образованием илида серы 7 . пятичленного кольца В переходном состоянии илид серы 7 разлагается с образованием диметилсульфида и желаемого карбонильного соединения 8 .

Вариации
[ редактировать ]При использовании оксалилхлорида в качестве дегидратирующего агента температура реакции должна быть ниже -60 °C, чтобы избежать побочных реакций. С цианурхлоридом [ 11 ] или трифторуксусный ангидрид [ 12 ] вместо оксалилхлорида реакцию можно нагреть до -30 ° C без побочных реакций. Другими методами активации ДМСО для инициирования образования ключевого интермедиата 6 являются использование карбодиимидов ( окисление Пфитцнера-Моффатта ), пиридинового комплекса триоксида серы ( окисление Париха-Деринга ) или уксусного ангидрида ( окисление Олбрайта-Гольдмана ). Промежуточное соединение 4 также можно получить из диметилсульфида и N -хлорсукцинимида ( окисление Кори-Кима ).
В некоторых случаях использование триэтиламина в качестве основания может привести к эпимеризации альфа -углерода с образованием вновь образованного карбонила. Использование более объемистого основания, такого как диизопропилэтиламин , может смягчить эту побочную реакцию.
Соображения
[ редактировать ]Диметилсульфид, побочный продукт окисления Сверна, является одним из самых неприятных запахов, известных в органической химии. Люди могут обнаружить это соединение в концентрациях от 0,02 до 0,1 частей на миллион. [ 13 ] Простое решение этой проблемы — промыть использованную стеклянную посуду отбеливателем или раствором оксона , которые окислят диметилсульфид обратно в диметилсульфоксид или диметилсульфон , оба из которых не имеют запаха и нетоксичны. [ 14 ]
Условия реакции допускают окисление чувствительных к кислоте соединений, которые могут разлагаться в условиях кислотного окисления, таких как окисление Джонса . Например, в синтезе изовелерального сесквитерпена Томпсоном и Хиткоком , [ 15 ] на последнем этапе используется протокол Сверна, позволяющий избежать перегруппировки чувствительного к кислоте фрагмента циклопропанметанола.

См. также
[ редактировать ]- Окисление спирта
- Окисление спиртов до альдегидов сульфонием.
- Хлорохромат пиридиния
- Окисление Джонса
- Окисление Оппенауэра
- Окисление Пфицнера-Моффатта
- Окисление Париха – Деринга
- Окисление Олбрайта-Гольдмана
- Окисление Кори-Кима
- периодинана Десса – Мартина Окисление
- Лей-окисление ( окисление TPAP )
- ТЕМПО окисление
Ссылки
[ редактировать ]- ^ Омура, К.; Сверн, Д. (1978). «Окисление спиртов «активированным» диметилсульфоксидом. Препаративное, стерическое и механистическое исследование». Тетраэдр . 34 (11): 1651–1660. дои : 10.1016/0040-4020(78)80197-5 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Манкузо, AJ; Браунфейн, Д.С.; Сверн, Д. (1979). «Строение продукта реакции диметилсульфоксид-оксалилхлорид. Окисление гетероароматических и разнообразных спиртов до карбонильных соединений». Дж. Орг. хим. 44 (23): 4148–4150. дои : 10.1021/jo01337a028 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Манкузо, AJ; Хуанг, С.-Л.; Сверн, Д. (1978). «Окисление длинноцепочечных и родственных спиртов до карбонилов диметилсульфоксидом, «активируемым» оксалилхлоридом». Дж. Орг. хим. 43 (12): 2480–2482. дои : 10.1021/jo00406a041 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дондони, А.; Перроне, Д. (2004). «Синтез 1,1-диметилэтил-( S )-4-формил-2,2-диметил-3-оксазолидинкарбоксилата окислением спирта» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 10, с. 320 . - ^ Бишоп, Р. (1998). «9-Тиабицикло[3.3.1]нонан-2,6-дион» . Органические синтезы ; Сборник томов , т. 9, с. 692 .
- ^ Леопольд, Э.Дж. (1990). «Селективное гидроборирование 1,3,7-триена: гомогераниол» . Органические синтезы ; Сборник томов , т. 7, с. 258 .
- ^ Тодзё, Г.; Фернандес, М. (2006). Окисление спиртов до альдегидов и кетонов: Руководство по современной практике . Спрингер. ISBN 0-387-23607-4 .
- ^ Манкузо, AJ; Сверн, Д. (1981). «Активированный диметилсульфоксид: полезные реагенты для синтеза». Синтез (обзор). 1981 (3): 165–185. дои : 10.1055/s-1981-29377 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Тидвелл, Т.Т. (1990). «Окисление спиртов до карбонильных соединений посредством илидов алкоксисульфония: Моффатт, Сверн и родственные окисления». Орг. Реагировать. (Обзор). 39 : 297–572. дои : 10.1002/0471264180.или039.03 . ISBN 0471264180 .
- ^ Тидвелл, Т.Т. (1990). «Окисление спиртов активированным диметилсульфоксидом и родственные реакции: обновленная информация». Синтез (обзор). 1990 (10): 857–870. дои : 10.1055/s-1990-27036 .
- ^ Де Лука Лидия (2001). «Мягкая и эффективная альтернатива классическому окислению Сверна». Журнал органической химии . 66 (23): 7907–7909. дои : 10.1021/jo015935s . ПМИД 11701058 .
- ^ Омура, кандзи; Шарма, Ашок К.; Сверн, Дэниел (1976). «Диметилсульфоксид-трифторуксусный ангидрид. Новый реагент для окисления спиртов до карбонилов». Дж. Орг. хим. 41 (6): 957–962. дои : 10.1021/jo00868a012 .
- ^ Мортон, TH (2000). «Архивирование запахов». В Бхушане, Н.; Розенфельд, С. (ред.). О молекулах и разуме . Оксфорд: Издательство Оксфордского университета. стр. 205–216.
- ^ Аткинс, Уильям Дж. Младший; Буркхардт, Элизабет Р.; Матос, Карл (2006). «Безопасное обращение с боранами в больших масштабах». Орг. Процесс Рез. Дев . 10 (6): 1292–1295. дои : 10.1021/op068011l .
- ^ Томпсон, СК; Хиткок, Швейцария (1992). «Полный синтез некоторых сесквитерпенов марасмана и лактарана». Дж. Орг. хим. 57 (22): 5979–5989. дои : 10.1021/jo00048a036 .