Окисление Оппенауэра
| Окисление Оппенауэра | |
|---|---|
| Назван в честь | Руперт Виктор Оппенауэр |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | оппенауэровское окисление |
| RSC Идентификатор онтологии | RXNO: 0000047 |
Окисление Оппенауэра , названное в честь Руперта Виктора Оппенауэра , [1] Это щадящий метод селективного окисления вторичных спиртов до кетонов .

Реакция представляет собой противоположное восстановление Меервейна-Понндорфа-Верли . [2] Спирт окисляют изопропоксидом алюминия в избытке ацетона . Это смещает равновесие в сторону продукта.
Окисление как является высокоселективным по отношению к вторичным спиртам и не окисляет другие чувствительные функциональные группы, такие амины и сульфиды . [3] спирты редко окисляются этим методом из-за конкурирующей альдольной конденсации альдегидных Хотя первичные спирты могут быть окислены в условиях Оппенауэра, первичные продуктов. Окисление Оппенауэра до сих пор используется для окисления кислотолабильных субстратов. Этот метод был в значительной степени вытеснен методами окисления, основанными на хроматах (например, хлорхромат пиридиния ) или диметилсульфоксиде (например, окисление Сверна ) или окислении Десса-Мартина из-за использования относительно мягких и нетоксичных реагентов (например, реакция проводится в ацетоне). /бензольные смеси). Окисление Оппенауэра обычно используется в различных промышленных процессах, таких как синтез стероидов , гормонов , алкалоидов , терпенов и т. д.
Механизм
[ редактировать ]На первом этапе этого механизма спирт (1) координируется с алюминием , образуя комплекс (3), который затем, на втором этапе, депротонируется ионом алкоксида алкоксида (4) с образованием промежуточного (5). . На третьем этапе как окислитель ацетон (7), так и спирт- субстрат связываются с алюминием. Ацетон координируется с алюминием, который активирует его для переноса гидрида из алкоксида. Катализируемый алюминием гидридный сдвиг от α-углерода спирта к карбонильному углероду ацетона протекает по шестичленному переходному состоянию (8). Желаемый кетон (9) образуется после переноса гидрида. [4]
Преимущества
[ редактировать ]Преимуществом окисления Оппенауэра является использование относительно недорогих и нетоксичных реагентов. Условия реакции мягкие и щадящие, поскольку субстраты обычно нагревают в смесях ацетона и бензола . Еще одно преимущество окисления Оппенауэра, которое делает его уникальным по сравнению с другими методами окисления, такими как хлорхромат пиридиния (PCC) и периодинан Десса-Мартина, заключается в том, что вторичные спирты окисляются намного быстрее, чем первичные спирты, таким образом может быть достигнута хемоселективность . Кроме того, не происходит чрезмерного окисления альдегидов до карбоновых кислот , в отличие от других методов окисления, таких как окисление Джонса . [4]
Модификации
[ редактировать ]Реакция Веттштейна-Оппенауэра
[ редактировать ]В реакции Веттштейна-Оппенауэра, открытой Веттштейном в 1945 году, Δ 5–3β-гидроксистероиды окисляются до Δ 4,6-3-кетостероидов с бензохиноном в качестве акцептора водорода . Эта реакция полезна тем, что позволяет в одну стадию получить Δ 4,6-3-кетостероиды. [5]
Модификация Вудворда
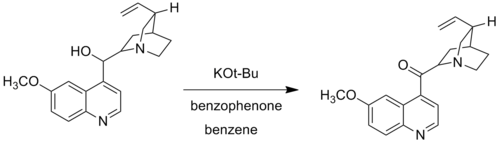
[ редактировать ]В модификации Вудворда Вудворд заменил трет-бутоксидом калия алкоксид алюминия . Модификация Вудворда окисления Оппенауэра, также называемая окислением Оппенауэра-Вудворда , используется, когда определенные спиртовые группы не окисляются в стандартных условиях реакции Оппенауэра. Например, Вудворд использовал трет-бутоксид калия и бензофенон для окисления хинина в хининон, поскольку традиционная алюминиевая каталитическая система не смогла окислить хинин из-за комплекса, образованного при координации льюисовского основного азота с алюминиевым центром. [6]
Другие модификации
[ редактировать ]на основе алкоксида алюминия о нескольких модифицированных катализаторах Сообщалось также . Например, Маруока и его коллеги сообщили о высокоактивном алюминиевом катализаторе, который использовался при окислении карвеола в карвон (член семейства химических веществ, называемых терпеноидами ) с отличным выходом (94%). [7]
В другой модификации [8] катализатором является триметилалюминий , а в качестве окислителя используется альдегид 3-нитробензальдегид , например, при окислении изоборнеола до камфоры .
Синтетические приложения
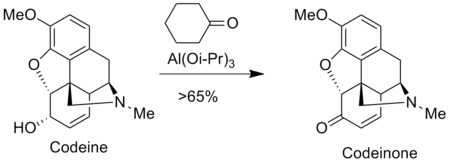
[ редактировать ]Окисление Оппенауэра используется для приготовления анальгетиков в фармацевтической промышленности, таких как морфин и кодеин . Например, кодеинон получают окислением кодеина Оппенауэром . [9]
Окисление Оппенауэра также используется для синтеза гормонов . Прогестерон получают путем окисления прегненолона по Оппенауэру . [10]
Небольшая вариация окисления Оппенауэра также используется для синтеза производных стероидов . была разработана эффективная каталитическая версия окисления Оппенауэра с использованием рутениевого катализатора. Например, для окисления 5-ненасыщенных 3β- гидроксистероидов до соответствующего производного 4-ен-3-она [11]
Окисление Оппенауэра применяется также при синтезе лактонов из 1,4 и 1,5- диолов . [12]
Побочные реакции
[ редактировать ]Распространенной побочной реакцией окисления Оппенауэра является основанием катализируемая альдольная конденсация альдегидного - продукта, который содержит α-водороды с образованием либо β-гидроксиальдегидов , либо α, β ненасыщенных альдегидов . [13]
Другая побочная реакция - это Тищенко реакция альдегидных продуктов без α-водорода, но ее можно предотвратить, используя безводные растворители. [4] Другой общей побочной реакцией является миграция двойной связи при окислении субстратов аллилового спирта . [14]

См. также
[ редактировать ]- Окисление спирта
- Хлорохромат пиридиния
- Окисление Джонса
- Окисление Пфицнера-Моффатта
- Окисление Париха – Деринга
- Окисление Олбрайта-Гольдмана
- Окисление Сверна
- Окисление Кори-Кима
- периодинана Десса – Мартина Окисление
- Лей-окисление ( окисление TPAP )
- ТЕМПО окисление
Ссылки
[ редактировать ]- ^ Оппенауэр, Р.В. (1937). «Способ дегидратации вторичных спиртов до кетонов. I. Для получения стеролкетонов и половых гормонов» [Дегидратация вторичных спиртов до кетонов. I. Получение стеролкетонов и половых гормонов. Рек. Трав. Хим. Pays-Bas (на немецком языке). 56 (2): 137–144. дои : 10.1002/recl.19370560206 .
- ^ Уайлдс, Алабама (1944). «Восстановление алкоксидами алюминия (восстановление Меервейна-Понндорфа-Верли)». Орг. Реагировать. 2 (5): 178–223. дои : 10.1002/0471264180.или002.05 .
- ^ Отвос, Л.; Грубер, Л.; Мейзель-Агостон, Дж. (1965). «Меервейн-Понндорф-Верлей-Оппенауэр. Исследование механизма реакции с радиоуглеродом. Рацемизация вторичных спиртов». Акта Хим. акад. наук. Хунг . 43 : 149–153.
- ^ Jump up to: а б с Кори, Э.Дж.; Николау, КЦ (2005). Стратегическое применение названных реакций в органическом синтезе . Эльзевир. ISBN 978-7-03-019190-8 .
- ^ Манделл, Л. (1955). «Механизм окисления Веттштейна-Оппенауэра». Дж. Ам. хим. Соц. 78 (13): 3199–3201. дои : 10.1021/ja01594a061 .
- ^ Вудворд, РБ; Вендлер, Нидерланды; Брутчи, Ф.Дж. (1945). «Хининон1». Дж. Ам. хим. Соц. 67 (9): 1425. doi : 10.1021/ja01225a001 .
- ^ Оой, Т.; Оцука, Х.; Миура, Т.; Итикава, Х.; Маруока, К. (2002). «Практическое окисление спиртов по Оппенауэру (ОПП) модифицированным алюминиевым катализатором». Органические письма . 4 (16): 2669–72. дои : 10.1021/ol020094c . ПМИД 12153205 .
- ^ Грейвс, ЧР; Цзэн, бакалавр наук; Нгуен, ST (2006). «Эффективное и селективное окисление спирта, катализируемое Al, с помощью химии Оппенауэра». Журнал Американского химического общества . 128 (39): 12596–7. дои : 10.1021/ja063842s . ПМИД 17002323 .
- ^ Стефан Карон; Роберт В. Даггер; Салли Гут Руджери; Джон А. Рэган и Дэвид Х. Браун Рипин (2006). «Крупномасштабное окисление в фармацевтической промышленности». хим. Откр. 106 (7): 2943–89. дои : 10.1021/cr040679f . ПМИД 16836305 .
- ^ Дьюик, П. (2001). Лекарственные натуральные продукты: биосинтетический подход (2-е изд.). Уайли и сыновья. п. 243. ИСБН 0471496405 .
- ^ Алмейда, Мария Л.С.; Кочовский, Павел; Беквалль, Ян-Э. (1996). «Катализируемое рутением окисление 3β-гидроксистероидов по типу Оппенауэра. Высокоэффективное проникновение в стероидные гормоны с функциональностью 4-ен-3-она». Дж. Орг. хим. 61 (19): 6587–6590. дои : 10.1021/jo960361q . ПМИД 11667525 .
- ^ Эйгнерова Л.; Касал, А. (1976). «Внутримолекулярный гидридный сдвиг при окислении Оппенауэра некоторых дигидроксистероидов». ХимПлюсХим . 41 (4): 1056–1065. дои : 10.1135/cccc19761056 .
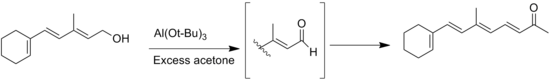
- ^ Милас, Н.А.; Гросси, Форекс; Пеннер, SE; Кан, С. (1948). «Синтез 1-[циклогексен-1'-ил]-3-метил-1,3,5-октатриен-7-она (C 15 кетона) 1 ". Журнал Американского химического общества . 70 (3): 1292. doi : 10.1021/ja01183a522 .
- ^ Райх, Р.; Кина, JFW (1972). «Окисление Оппенауэра с использованием 1-метил-4-пиперидона в качестве акцептора гидрида». Синтетические коммуникации . 2 (5): 323. дои : 10.1080/00397917208061988 .
- ^ Райх, Ричард; Киана, Джон Ф.В. (1972). «Окисление Оппенауэра с использованием 1-метил-4-пиперидона в качестве акцептора гидрида». Синтетические коммуникации . 2 (5): 323–325. дои : 10.1080/00397917208061988 .