Фармацевтическая промышленность

Фармацевтическая промышленность – это отрасль медицины , которая обнаруживает, разрабатывает, производит и продает фармацевтические товары для использования в качестве лекарств , которые действуют путем введения (или самостоятельного приема ) пациентам, использующим такие лекарства, с целью лечения и/или предотвращения заболевания (а также, возможно, облегчение симптомов заболевания и/или травмы ). [1] [2] Фармацевтические компании могут торговать « генерическими » лекарствами и медицинскими устройствами без использования интеллектуальной собственности , « брендовыми » материалами, специально связанными с историей конкретной компании, или и тем, и другим в разных контекстах. Различные подразделения отрасли (которые включают отдельные области, такие как производство биологических препаратов ) подчиняются множеству законов и правил , которые регулируют все финансовые процессы, включая патентование , тестирование эффективности, оценку безопасности и маркетинг этих препаратов. В 2020 году на мировом фармацевтическом рынке было произведено в общей сложности лекарств на сумму 1 228,45 миллиарда долларов, и это показало совокупный годовой темп роста (CAGR) 1,8%, учитывая результаты недавних событий (включая пандемию COVID-19 ). [3]
In historical terms, a pharmaceutical industry as an intellectual concept arose within the middle to late 1800s inside of certain nation-states with developed economies such as Germany, Switzerland, and the United States given that multiple businesses engaging in synthetic organic chemistry, such as a number of firms generating dyestuffs derived from coal tar on a large scale, sought out new applications of their artificial materials in terms of human health. This trend of increased capital investment occurred in tandem with the scholarly study of pathology as a field advancing significantly, and a variety of businesses set up cooperative relationships with academic laboratories evaluating human injury and disease. Examples of industrial companies with a pharmaceutical focus that have endured to this day after such distant beginnings include Bayer (based out of Germany) and Pfizer (based out of the U.S.).[4]
History[edit]
Mid-1800s – 1945: From botanicals to the first synthetic drugs[edit]
The modern era of pharmaceutical industry began with local apothecaries that expanded from their traditional role of distributing botanical drugs such as morphine and quinine to wholesale manufacture in the mid-1800s, and from discoveries resulting from applied research. Intentional drug discovery from plants began with the isolation between 1803 and 1805 of morphine – an analgesic and sleep-inducing agent – from opium by the German apothecary assistant Friedrich Sertürner, who named this compound after the Greek god of dreams, Morpheus.[5] By the late 1880s, German dye manufacturers had perfected the purification of individual organic compounds from tar and other mineral sources and had also established rudimentary methods in organic chemical synthesis.[4] The development of synthetic chemical methods allowed scientists to systematically vary the structure of chemical substances, and growth in the emerging science of pharmacology expanded their ability to evaluate the biological effects of these structural changes.
Epinephrine, norepinephrine, and amphetamine[edit]
By the 1890s, the profound effect of adrenal extracts on many different tissue types had been discovered, setting off a search both for the mechanism of chemical signalling and efforts to exploit these observations for the development of new drugs. The blood pressure raising and vasoconstrictive effects of adrenal extracts were of particular interest to surgeons as hemostatic agents and as treatment for shock, and a number of companies developed products based on adrenal extracts containing varying purities of the active substance. In 1897, John Abel of Johns Hopkins University identified the active principle as epinephrine, which he isolated in an impure state as the sulfate salt. Industrial chemist Jōkichi Takamine later developed a method for obtaining epinephrine in a pure state, and licensed the technology to Parke-Davis. Parke-Davis marketed epinephrine under the trade name Adrenalin. Injected epinephrine proved to be especially efficacious for the acute treatment of asthma attacks, and an inhaled version was sold in the United States until 2011 (Primatene Mist).[6][7] By 1929 epinephrine had been formulated into an inhaler for use in the treatment of nasal congestion.
While highly effective, the requirement for injection limited the use of epinephrine[clarification needed] and orally active derivatives were sought. A structurally similar compound, ephedrine, was identified by Japanese chemists in the Ma Huang plant and marketed by Eli Lilly as an oral treatment for asthma. Following the work of Henry Dale and George Barger at Burroughs-Wellcome, academic chemist Gordon Alles synthesized amphetamine and tested it in asthma patients in 1929. The drug proved to have only modest anti-asthma effects but produced sensations of exhilaration and palpitations. Amphetamine was developed by Smith, Kline and French as a nasal decongestant under the trade name Benzedrine Inhaler. Amphetamine was eventually developed for the treatment of narcolepsy, post-encephalitic parkinsonism, and mood elevation in depression and other psychiatric indications. It received approval as a New and Nonofficial Remedy from the American Medical Association for these uses in 1937,[8] and remained in common use for depression until the development of tricyclic antidepressants in the 1960s.[7]
Discovery and development of the barbiturates[edit]

In 1903, Hermann Emil Fischer and Joseph von Mering disclosed their discovery that diethylbarbituric acid, formed from the reaction of diethylmalonic acid, phosphorus oxychloride and urea, induces sleep in dogs. The discovery was patented and licensed to Bayer pharmaceuticals, which marketed the compound under the trade name Veronal as a sleep aid beginning in 1904. Systematic investigations of the effect of structural changes on potency and duration of action led to the discovery of phenobarbital at Bayer in 1911 and the discovery of its potent anti-epileptic activity in 1912. Phenobarbital was among the most widely used drugs for the treatment of epilepsy through the 1970s, and as of 2014, remains on the World Health Organizations list of essential medications.[9][10] The 1950s and 1960s saw increased awareness of the addictive properties and abuse potential of barbiturates and amphetamines and led to increasing restrictions on their use and growing government oversight of prescribers. Today, amphetamine is largely restricted to use in the treatment of attention deficit disorder and phenobarbital in the treatment of epilepsy.[11][12]
In 1958, Leo Sternbach discovered the first benzodiazepine, chlordiazepoxide (Librium). Dozens of other benzodiazepines have been developed and are in use, some of the more popular drugs being diazepam (Valium), alprazolam (Xanax), clonazepam (Klonopin), and lorazepam (Ativan). Due to their far superior safety and therapeutic properties, benzodiazepines have largely replaced the use of barbiturates in medicine, except in certain special cases. When it was later discovered that benzodiazepines, like barbiturates, significantly lose their effectiveness and can have serious side effects when taken long-term, Heather Ashton researched benzodiazepine dependence and developed a protocol to discontinue their use.
Insulin[edit]
A series of experiments performed from the late 1800s to the early 1900s revealed that diabetes is caused by the absence of a substance normally produced by the pancreas. In 1869, Oskar Minkowski and Joseph von Mering found that diabetes could be induced in dogs by surgical removal of the pancreas. In 1921, Canadian professor Frederick Banting and his student Charles Best repeated this study and found that injections of pancreatic extract reversed the symptoms produced by pancreas removal. Soon, the extract was demonstrated to work in people, but development of insulin therapy as a routine medical procedure was delayed by difficulties in producing the material in sufficient quantity and with reproducible purity. The researchers sought assistance from industrial collaborators at Eli Lilly and Co. based on the company's experience with large scale purification of biological materials. Chemist George B. Walden of Eli Lilly and Company found that careful adjustment of the pH of the extract allowed a relatively pure grade of insulin to be produced. Under pressure from Toronto University and a potential patent challenge by academic scientists who had independently developed a similar purification method, an agreement was reached for non-exclusive production of insulin by multiple companies. Prior to the discovery and widespread availability of insulin therapy the life expectancy of diabetics was only a few months.[13]
Early anti-infective research: Salvarsan, Prontosil, Penicillin and vaccines[edit]
The development of drugs for the treatment of infectious diseases was a major focus of early research and development efforts; in 1900, pneumonia, tuberculosis, and diarrhea were the three leading causes of death in the United States and mortality in the first year of life exceeded 10%.[14][15][failed verification]
In 1911 arsphenamine, the first synthetic anti-infective drug, was developed by Paul Ehrlich and chemist Alfred Bertheim of the Institute of Experimental Therapy in Berlin. The drug was given the commercial name Salvarsan.[16] Ehrlich, noting both the general toxicity of arsenic and the selective absorption of certain dyes by bacteria, hypothesized that an arsenic-containing dye with similar selective absorption properties could be used to treat bacterial infections. Arsphenamine was prepared as part of a campaign to synthesize a series of such compounds, and was found to exhibit partially selective toxicity. Arsphenamine proved to be the first effective treatment for syphilis, a disease untl then had been incurable and led inexorably to severe skin ulceration, neurological damage, and death.[17]
Ehrlich's approach of systematically varying the chemical structure of synthetic compounds and measuring the effects of these changes on biological activity was pursued broadly by industrial scientists, including Bayer scientists Josef Klarer, Fritz Mietzsch, and Gerhard Domagk. This work, also based on the testing of compounds available from the German dye industry, led to the development of Prontosil, the first representative of the sulfonamide class of antibiotics. Compared to arsphenamine, the sulfonamides had a broader spectrum of activity and were far less toxic, rendering them useful for infections caused by pathogens such as streptococci.[18] In 1939, Domagk received the Nobel Prize in Medicine for this discovery.[19][20] Nonetheless, the dramatic decrease in deaths from infectious diseases that occurred prior to World War II was primarily the result of improved public health measures such as clean water and less crowded housing, and the impact of anti-infective drugs and vaccines was significant mainly after World War II.[21][22]
In 1928, Alexander Fleming discovered the antibacterial effects of penicillin, but its exploitation for the treatment of human disease awaited the development of methods for its large scale production and purification. These were developed by a U.S. and British government-led consortium of pharmaceutical companies during the world war.[23]
There was early progress toward the development of vaccines throughout this period, primarily in the form of academic and government-funded basic research directed toward the identification of the pathogens responsible for common communicable diseases. In 1885, Louis Pasteur and Pierre Paul Émile Roux created the first rabies vaccine. The first diphtheria vaccines were produced in 1914 from a mixture of diphtheria toxin and antitoxin (produced from the serum of an inoculated animal), but the safety of the inoculation was marginal and it was not widely used. The United States recorded 206,000 cases of diphtheria in 1921, resulting in 15,520 deaths. In 1923, parallel efforts by Gaston Ramon at the Pasteur Institute and Alexander Glenny at the Wellcome Research Laboratories (later part of GlaxoSmithKline) led to the discovery that a safer vaccine could be produced by treating diphtheria toxin with formaldehyde.[24] In 1944, Maurice Hilleman of Squibb Pharmaceuticals developed the first vaccine against Japanese Encephalitis.[25] Hilleman later moved to Merck, where he played a key role in the development of vaccines against measles, mumps, chickenpox, rubella, hepatitis A, hepatitis B, and meningitis.
Unsafe drugs and early industry regulation[edit]

Prior to the 20th century, drugs were generally produced by small scale manufacturers with little regulatory control over manufacturing or claims of safety and efficacy. To the extent that such laws did exist, enforcement was lax. In the United States, increased regulation of vaccines and other biological drugs was spurred by tetanus outbreaks and deaths caused by the distribution of contaminated smallpox vaccine and diphtheria antitoxin.[26] The Biologics Control Act of 1902 required that federal government grant premarket approval for every biological drug and for the process and facility producing such drugs. This was followed in 1906 by the Pure Food and Drugs Act, which forbade the interstate distribution of adulterated or misbranded foods and drugs. A drug was considered misbranded if it contained alcohol, morphine, opium, cocaine, or any of several other potentially dangerous or addictive drugs, and if its label failed to indicate the quantity or proportion of such drugs. The government's attempts to use the law to prosecute manufacturers for making unsupported claims of efficacy were undercut by a Supreme Court ruling restricting the federal government's enforcement powers to cases of incorrect specification of the drug's ingredients.[27]
In 1937 over 100 people died after ingesting "Elixir Sulfanilamide" manufactured by S.E. Massengill Company of Tennessee. The product was formulated in diethylene glycol, a highly toxic solvent that is now widely used as antifreeze.[28] Under the laws extant at that time, prosecution of the manufacturer was possible only under the technicality that the product had been called an "elixir", which literally implied a solution in ethanol. In response to this episode, the U.S. Congress passed the Federal Food, Drug, and Cosmetic Act of 1938, which for the first time required pre-market demonstration of safety before a drug could be sold, and explicitly prohibited false therapeutic claims.[29]
The post-war years, 1945–1970[edit]
Further advances in anti-infective research[edit]
The aftermath of World War II saw an explosion in the discovery of new classes of antibacterial drugs[30] including the cephalosporins (developed by Eli Lilly based on the seminal work of Giuseppe Brotzu and Edward Abraham),[31][32] streptomycin (discovered during a Merck-funded research program in Selman Waksman's laboratory[33]), the tetracyclines[34] (discovered at Lederle Laboratories, now a part of Pfizer), erythromycin (discovered at Eli Lilly and Co.)[35] and their extension to an increasingly wide range of bacterial pathogens. Streptomycin, discovered during a Merck-funded research program in Selman Waksman's laboratory at Rutgers in 1943, became the first effective treatment for tuberculosis. At the time of its discovery, sanitoriums for the isolation of tuberculosis-infected people were an ubiquitous feature of cities in developed countries, with 50% dying within 5 years of admission.[33][36]
A Federal Trade Commission report issued in 1958 attempted to quantify the effect of antibiotic development on American public health. The report found that over the period 1946–1955, there was a 42% drop in the incidence of diseases for which antibiotics were effective and only a 20% drop in those for which antibiotics were not effective. The report concluded that "it appears that the use of antibiotics, early diagnosis, and other factors have limited the epidemic spread and thus the number of these diseases which have occurred". The study further examined mortality rates for eight common diseases for which antibiotics offered effective therapy (syphilis, tuberculosis, dysentery, scarlet fever, whooping cough, meningococcal infections, and pneumonia), and found a 56% decline over the same period.[37] Notable among these was a 75% decline in deaths due to tuberculosis.[38]

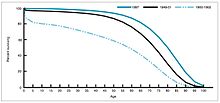
During the years 1940–1955, the rate of decline in the U.S. death rate accelerated from 2% per year to 8% per year, then returned to the historical rate of 2% per year. The dramatic decline in the immediate post-war years has been attributed to the rapid development of new treatments and vaccines for infectious disease that occurred during these years.[40][22]Vaccine development continued to accelerate, with the most notable achievement of the period being Jonas Salk's 1954 development of the polio vaccine under the funding of the non-profit National Foundation for Infantile Paralysis. The vaccine process was never patented but was instead given to pharmaceutical companies to manufacture as a low-cost generic. In 1960 Maurice Hilleman of Merck Sharp & Dohme identified the SV40 virus, which was later shown to cause tumors in many mammalian species. It was later determined that SV40 was present as a contaminant in polio vaccine lots that had been administered to 90% of the children in the United States.[41][42] The contamination appears to have originated both in the original cell stock and in monkey tissue used for production. In 2004 the National Cancer Institute announced that it had concluded that SV40 is not associated with cancer in people.[43]
Other notable new vaccines of the period include those for measles (1962, John Franklin Enders of Children's Medical Center Boston, later refined by Maurice Hilleman at Merck), Rubella (1969, Hilleman, Merck) and mumps (1967, Hilleman, Merck)[44] The United States incidences of rubella, congenital rubella syndrome, measles, and mumps all fell by >95% in the immediate aftermath of widespread vaccination.[45] The first 20 years of licensed measles vaccination in the U.S. prevented an estimated 52 million cases of the disease, 17,400 cases of mental retardation, and 5,200 deaths.[46]
Development and marketing of antihypertensive drugs[edit]
Hypertension is a risk factor for atherosclerosis,[47] heart failure,[48] coronary artery disease,[49][50] stroke,[51] renal disease,[52][53] and peripheral arterial disease,[54][55] and is the most important risk factor for cardiovascular morbidity and mortality, in industrialized countries.[56] Prior to 1940 approximately 23% of all deaths among persons over age 50 were attributed to hypertension. Severe cases of hypertension were treated by surgery.[57]
Early developments in the field of treating hypertension included quaternary ammonium ion sympathetic nervous system blocking agents, but these compounds were never widely used due to their severe side effects, because the long-term health consequences of high blood pressure had not yet been established, and because they had to be administered by injection.
In 1952 researchers at Ciba discovered the first orally available vasodilator, hydralazine.[58] A major shortcoming of hydralazine monotherapy was that it lost its effectiveness over time (tachyphylaxis). In the mid-1950s Karl H. Beyer, James M. Sprague, John E. Baer, and Frederick C. Novello of Merck and Co. discovered and developed chlorothiazide, which remains the most widely used antihypertensive drug today.[59] This development was associated with a substantial decline in the mortality rate among people with hypertension.[60] The inventors were recognized by a Public Health Lasker Award in 1975 for "the saving of untold thousands of lives and the alleviation of the suffering of millions of victims of hypertension".[61]
A 2009 Cochrane review concluded that thiazide antihypertensive drugs reduce the risk of death (RR 0.89), stroke (RR 0.63), coronary heart disease (RR 0.84), and cardiovascular events (RR 0.70) in people with high blood pressure.[62] In the ensuring years other classes of antihypertensive drug were developed and found wide acceptance in combination therapy, including loop diuretics (Lasix/furosemide, Hoechst Pharmaceuticals, 1963),[63] beta blockers (ICI Pharmaceuticals, 1964)[64] ACE inhibitors, and angiotensin receptor blockers. ACE inhibitors reduce the risk of new onset kidney disease [RR 0.71] and death [RR 0.84] in diabetic patients, irrespective of whether they have hypertension.[65]
Oral Contraceptives[edit]
Prior to the Second World war, birth control was prohibited in many countries, and in the United States even the discussion of contraceptive methods sometimes led to prosecution under Comstock laws. The history of the development of oral contraceptives is thus closely tied to the birth control movement and the efforts of activists Margaret Sanger, Mary Dennett, and Emma Goldman. Based on fundamental research performed by Gregory Pincus and synthetic methods for progesterone developed by Carl Djerassi at Syntex and by Frank Colton at G.D. Searle & Co., the first oral contraceptive, Enovid, was developed by G.D. Searle & Co. and approved by the FDA in 1960. The original formulation incorporated vastly excessive doses of hormones, and caused severe side effects. Nonetheless, by 1962, 1.2 million American women were on the pill, and by 1965 the number had increased to 6.5 million.[66][67][68][69] The availability of a convenient form of temporary contraceptive led to dramatic changes in social mores including expanding the range of lifestyle options available to women, reducing the reliance of women on men for contraceptive practice, encouraging the delay of marriage, and increasing pre-marital co-habitation.[70]
Thalidomide and the Kefauver-Harris Amendments[edit]

In the U.S., a push for revisions of the FD&C Act emerged from Congressional hearings led by Senator Estes Kefauver of Tennessee in 1959. The hearings covered a wide range of policy issues, including advertising abuses, questionable efficacy of drugs, and the need for greater regulation of the industry. While momentum for new legislation temporarily flagged under extended debate, a new tragedy emerged that underscored the need for more comprehensive regulation and provided the driving force for the passage of new laws.
On 12 September 1960, an American licensee, the William S. Merrell Company of Cincinnati, submitted a new drug application for Kevadon (thalidomide), a sedative that had been marketed in Europe since 1956. The FDA medical officer in charge of reviewing the compound, Frances Kelsey, believed that the data supporting the safety of thalidomide was incomplete. The firm continued to pressure Kelsey and the FDA to approve the application until November 1961, when the drug was pulled off the German market because of its association with grave congenital abnormalities. Several thousand newborns in Europe and elsewhere suffered the teratogenic effects of thalidomide. Without approval from the FDA, the firm distributed Kevadon to over 1,000 physicians there under the guise of investigational use. Over 20,000 Americans received thalidomide in this "study," including 624 pregnant patients, and about 17 known newborns suffered the effects of the drug.[citation needed]
The thalidomide tragedy resurrected Kefauver's bill to enhance drug regulation that had stalled in Congress, and the Kefauver-Harris Amendment became law on 10 October 1962. Manufacturers henceforth had to prove to FDA that their drugs were effective as well as safe before they could go on the US market. The FDA received authority to regulate advertising of prescription drugs and to establish good manufacturing practices. The law required that all drugs introduced between 1938 and 1962 had to be effective. An FDA - National Academy of Sciences collaborative study showed that nearly 40 percent of these products were not effective. A similarly comprehensive study of over-the-counter products began ten years later.[71]
1970–1990s[edit]
Statins[edit]
In 1971, Akira Endo, a Japanese biochemist working for the pharmaceutical company Sankyo, identified mevastatin (ML-236B), a molecule produced by the fungus Penicillium citrinum, as an inhibitor of HMG-CoA reductase, a critical enzyme used by the body to produce cholesterol. Animal trials showed very good inhibitory effect as in clinical trials, however a long-term study in dogs found toxic effects at higher doses and as a result mevastatin was believed to be too toxic for human use. Mevastatin was never marketed, because of its adverse effects of tumors, muscle deterioration, and sometimes death in laboratory dogs.
P. Roy Vagelos, chief scientist and later CEO of Merck & Co, was interested, and made several trips to Japan starting in 1975. By 1978, Merck had isolated lovastatin (mevinolin, MK803) from the fungus Aspergillus terreus, first marketed in 1987 as Mevacor.[72][73][74]
In April 1994, the results of a Merck-sponsored study, the Scandinavian Simvastatin Survival Study, were announced. Researchers tested simvastatin, later sold by Merck as Zocor, on 4,444 patients with high cholesterol and heart disease. After five years, the study concluded the patients saw a 35% reduction in their cholesterol, and their chances of dying of a heart attack were reduced by 42%.[75] In 1995, Zocor and Mevacor both made Merck over US$1 billion. Endo was awarded the 2006 Japan Prize, and the Lasker-DeBakey Clinical Medical Research Award in 2008. For his "pioneering research into a new class of molecules" for "lowering cholesterol,"[sentence fragment][76][77]
21st Century[edit]
Since several decades, biologics have been rising in importance in comparison with small molecules treatments. The biotech subsector, animal health and the Chinese pharmaceutical sector have also grown substantially. On the organisational side, big international pharma corporations have experienced a substantial decline of their value share. Also, the core generic sector (substitutions for off-patent brands) has been downvalued due to competition.[78]
Torreya estimated the pharmaceutical industry to have a market valuation of US$7.03 trillion by February 2021 from which US$6.1 trillion is the value of the publicly traded companies. Small Molecules modality had 58.2% of the valuation share down from 84.6% in 2003. Biologics was up at 30.5% from 14.5%. The valuation share of Chinese Pharma grew from 2003 to 2021 from 1% to 12% overtaking Switzerland who is now ranked number 3 with 7.7%. The United States had still by far the most valued pharmaceutical industry with 40% of global valuation.[79] 2023 was a year of layoffs for at least 10,000 people across 129 public biotech firms globally, albeit most small firms; this was a significant increase in reductions versus 2022 was in part due to worsening global financial conditions and a reduction in investment by "generalist investors".[80] Private firms also saw a significant reduction in venture capital investment in 2023, continuing a downward trend started in 2021, which also led to a reduction in initial public offerings being floated.[80]
Impact of Mergers and Acquisitions[edit]
A 2022 article articulated this notion succinctly by saying "In the business of drug development, deals can be just as important as scientific breakthroughs", typically referred to as pharmaceutical M&A (for mergers and acquisitions).[81] It highlighted that some of the most impactful of the remedies of the early 21st Century were only made possible through M&A activities, specifically noting Keytruda and Humira.[81]
Research and development[edit]
Drug discovery is the process by which potential drugs are discovered or designed. In the past, most drugs have been discovered either by isolating the active ingredient from traditional remedies or by serendipitous discovery. Modern biotechnology often focuses on understanding the metabolic pathways related to a disease state or pathogen, and manipulating these pathways using molecular biology or biochemistry. A great deal of early-stage drug discovery has traditionally been carried out by universities and research institutions.
Drug development refers to activities undertaken after a compound is identified as a potential drug in order to establish its suitability as a medication. Objectives of drug development are to determine appropriate formulation and dosing, as well as to establish safety. Research in these areas generally includes a combination of in vitro studies, in vivo studies, and clinical trials. The cost of late stage development has meant it is usually done by the larger pharmaceutical companies.[82] The pharmaceuticals and biotechnology industry spends more than 15% of its net sales for Research & Development which is in comparison with other industries by far the highest share.[83]
Often, large multinational corporations exhibit vertical integration, participating in a broad range of drug discovery and development, manufacturing and quality control, marketing, sales, and distribution. Smaller organizations, on the other hand, often focus on a specific aspect such as discovering drug candidates or developing formulations. Often, collaborative agreements between research organizations and large pharmaceutical companies are formed to explore the potential of new drug substances. More recently, multi-nationals are increasingly relying on contract research organizations to manage drug development.[84]
The cost of innovation[edit]
Drug discovery and development are very expensive; of all compounds investigated for use in humans only a small fraction are eventually approved in most nations by government-appointed medical institutions or boards, who have to approve new drugs before they can be marketed in those countries. In 2010 18 NMEs (New Molecular Entities) were approved and three biologics by the FDA, or 21 in total, which is down from 26 in 2009 and 24 in 2008. On the other hand, there were only 18 approvals in total in 2007 and 22 back in 2006. Since 2001, the Center for Drug Evaluation and Research has averaged 22.9 approvals a year.[85]This approval comes only after heavy investment in pre-clinical development and clinical trials, as well as a commitment to ongoing safety monitoring. Drugs which fail part-way through this process often incur large costs, while generating no revenue in return. If the cost of these failed drugs is taken into account, the cost of developing a successful new drug (new chemical entity, or NCE), has been estimated at US$1.3 billion[86] (not including marketing expenses). Professors Light and Lexchin reported in 2012, however, that the rate of approval for new drugs has been a relatively stable average rate of 15 to 25 for decades.[87]
Industry-wide research and investment reached a record $65.3 billion in 2009.[88] While the cost of research in the U.S. was about $34.2 billion between 1995 and 2010, revenues rose faster (revenues rose by $200.4 billion in that time).[87]
A study by the consulting firm Bain & Company reported that the cost for discovering, developing and launching (which factored in marketing and other business expenses) a new drug (along with the prospective drugs that fail) rose over a five-year period to nearly $1.7 billion in 2003.[89] According to Forbes, by 2010 development costs were between $4 billion to $11 billion per drug.[90]
Some of these estimates also take into account the opportunity cost of investing capital many years before revenues are realized (see Time-value of money). Because of the very long time needed for discovery, development, and approval of pharmaceuticals, these costs can accumulate to nearly half the total expense. A direct consequence within the pharmaceutical industry value chain is that major pharmaceutical multinationals tend to increasingly outsource risks related to fundamental research, which somewhat reshapes the industry ecosystem with biotechnology companies playing an increasingly important role, and overall strategies being redefined accordingly.[91] Some approved drugs, such as those based on re-formulation of an existing active ingredient (also referred to as Line-extensions) are much less expensive to develop.
Product approval[edit]
In the United States, new pharmaceutical products must be approved by the Food and Drug Administration (FDA) as being both safe and effective. This process generally involves submission of an Investigational New Drug filing with sufficient pre-clinical data to support proceeding with human trials. Following IND approval, three phases of progressively larger human clinical trials may be conducted. Phase I generally studies toxicity using healthy volunteers. Phase II can include pharmacokinetics and dosing in patients, and Phase III is a very large study of efficacy in the intended patient population. Following the successful completion of phase III testing, a New Drug Application is submitted to the FDA. The FDA reviews the data and if the product is seen as having a positive benefit-risk assessment, approval to market the product in the US is granted.[92]
A fourth phase of post-approval surveillance is also often required due to the fact that even the largest clinical trials cannot effectively predict the prevalence of rare side-effects. Postmarketing surveillance ensures that after marketing the safety of a drug is monitored closely. In certain instances, its indication may need to be limited to particular patient groups, and in others the substance is withdrawn from the market completely.
The FDA provides information about approved drugs at the Orange Book site.[93]
In the UK, the Medicines and Healthcare products Regulatory Agency approves and evaluates drugs for use. Normally an approval in the UK and other European countries comes later than one in the USA. Then it is the National Institute for Health and Care Excellence (NICE), for England and Wales, who decides if and how the National Health Service (NHS) will allow (in the sense of paying for) their use. The British National Formulary is the core guide for pharmacists and clinicians.
In many non-US western countries, a 'fourth hurdle' of cost effectiveness analysis has developed before new technologies can be provided. This focuses on the 'efficacy price tag' (in terms of, for example, the cost per QALY) of the technologies in question. In England and Wales NICE decides whether and in what circumstances drugs and technologies will be made available by the NHS, whilst similar arrangements exist with the Scottish Medicines Consortium in Scotland, and the Pharmaceutical Benefits Advisory Committee in Australia. A product must pass the threshold for cost-effectiveness if it is to be approved. Treatments must represent 'value for money' and a net benefit to society.
Orphan drugs[edit]
There are special rules for certain rare diseases ("orphan diseases") in several major drug regulatory territories. For example, diseases involving fewer than 200,000 patients in the United States, or larger populations in certain circumstances are subject to the Orphan Drug Act.[94] Because medical research and development of drugs to treat such diseases is financially disadvantageous, companies that do so are rewarded with tax reductions, fee waivers, and market exclusivity on that drug for a limited time (seven years), regardless of whether the drug is protected by patents.
Global sales[edit]
| Company | Pharma revenue ($ million) |
|---|---|
| Pfizer | 100,330 |
| Johnson & Johnson | 94,940 |
| Roche | 66,260 |
| Merck & Co | 59,280 |
| Abbvie | 58,050 |
| Novartis | 50,540 |
| Bristol Myers Squibb | 46,160 |
| Sanofi | 45,220 |
| AstraZeneca | 44,350 |
| GSK | 36,150 |
| Takeda | 30,000 |
| Eli Lilly and Company | 28,550 |
| Gilead Sciences | 27,280 |
| Bayer | 26,640 |
| Amgen | 26,320 |
| Boehringer Ingelheim | 25,280 |
| Novo Nordisk | 25,000 |
| Moderna | 19,260 |
| Merck KGaA | 19,160 |
| BioNTech | 18,200 |
В 2011 году глобальные расходы на рецептурные лекарства превысили 954 миллиарда долларов, хотя в Европе и Северной Америке рост несколько замедлился. На долю США приходится более трети мирового фармацевтического рынка с годовым объемом продаж в 340 миллиардов долларов, за ними следуют ЕС и Япония. [96] Развивающиеся рынки, такие как Китай, Россия, Южная Корея и Мексика, опередили этот рынок, увеличившись на огромные 81 процент. [97] [98]
Общий объем продаж десяти самых продаваемых препаратов 2013 года составил 75,6 млрд долларов, при этом противовоспалительный препарат Хумира стал самым продаваемым препаратом в мире с объемом продаж 10,7 млрд долларов. На втором и третьем месте по популярности оказались Enbrel и Remicade соответственно. [99] В тройку самых продаваемых лекарств в США в 2013 году вошли Abilify (6,3 миллиарда долларов), Nexium (6 миллиардов долларов) и Humira (5,4 миллиарда долларов). [100] Самый продаваемый препарат за всю историю, Липитор , в среднем приносил 13 миллиардов долларов в год, а общая прибыль за время своего существования составила 141 миллиард долларов до истечения срока действия патента Pfizer в ноябре 2011 года.
IMS Health публикует анализ тенденций, ожидаемых в фармацевтической промышленности в 2007 году, включая рост прибыли в большинстве секторов, несмотря на потерю некоторых патентов, а также появление на горизонте новых лекарств-блокбастеров. [101]
Патенты и дженерики [ править ]
В зависимости от ряда соображений компания может подать заявку и получить патент на препарат или процесс производства препарата, предоставляя эксклюзивные права, как правило, на срок около 20 лет. [102] Однако только после тщательного изучения и тестирования, которые в среднем занимают от 10 до 15 лет, государственные органы дадут компании разрешение на продажу препарата. [103] Патентная защита позволяет владельцу патента возмещать затраты на исследования и разработки за счет высокой прибыли от фирменного препарата. Когда срок действия патентной защиты препарата истекает, непатентованный препарат обычно разрабатывается и продается конкурирующей компанией. Разработка и утверждение дженериков обходятся дешевле, что позволяет продавать их по более низкой цене. Часто владелец фирменного препарата представляет генерическую версию до истечения срока действия патента, чтобы получить преимущество на рынке дженериков. [104] Таким образом, реструктуризация стала рутинной, вызванной истечением срока действия патентов на продукты, выпущенные в «золотую эпоху» отрасли в 1990-е годы, и неспособностью компаний разработать достаточное количество новых продуктов-блокбастеров, чтобы компенсировать потерянные доходы. [105]
Рецепты [ править ]
В США стоимость рецептов увеличивалась за период с 1995 по 2005 год на 3,4 миллиарда долларов ежегодно, то есть на 61 процент. Розничные продажи рецептурных лекарств подскочили на 250 процентов — с 72 до 250 миллиардов долларов, а средняя цена рецептов выросла более чем вдвое — с 30 до 68 долларов. [106]
Маркетинг [ править ]
Реклама распространена в медицинских журналах, а также в более популярных средствах массовой информации. В некоторых странах, особенно в США, им разрешено размещать рекламу напрямую среди широкой публики. Фармацевтические компании обычно нанимают продавцов (часто называемых «представителями лекарств» или, более старым термином, «специалистами») для прямых и личных продаж врачам и другим поставщикам медицинских услуг. В некоторых странах, особенно в США, фармацевтические компании также нанимают лоббистов для влияния на политиков. Маркетинг рецептурных лекарств в США регулируется федеральным Законом о маркетинге рецептурных лекарств от 1987 года . План фармацевтического маркетинга включает в себя планы расходов, каналы и идеи, которые будут способствовать продвижению фармацевтической ассоциации, ее подразделений и администраций вперед на текущей сцене.
Медицинским работникам [ править ]
В книге Bad Pharma также обсуждается влияние представителей фармацевтических компаний, как фармацевтические компании нанимают авторов-призраков для написания статей для ученых, которые затем публикуют, насколько на самом деле независимы академические журналы, как фармацевтические компании финансируют непрерывное образование врачей и как пациенты группы часто финансируются промышленностью. [107]
Прямая реклама для потребителей [ править ]
С 1980-х годов важное значение приобрели новые методы сбыта рецептурных лекарств среди потребителей. Реклама в средствах массовой информации, ориентированная непосредственно на потребителя, была легализована в «Руководстве FDA для промышленности по широковещательной рекламе, ориентированной на потребителя».
Споры [ править ]
наркотиков лоббирование и Маркетинг
Вокруг фармацевтического маркетинга и влияния растет противоречие. Были обвинения и выводы о влиянии на врачей и других медицинских работников через представителей фармацевтических компаний, включая постоянное предоставление маркетинговых «подарков» и предвзятой информации медицинским работникам; [108] широко распространенная реклама в журналах и на конференциях; финансирование независимых медицинских организаций и кампаний по укреплению здоровья; лоббирование врачей и политиков (больше, чем любая другая отрасль в США) [109] ); спонсорство медицинских школ или подготовки медсестер; спонсорство непрерывных образовательных мероприятий, влияющих на учебную программу; [110] и найм врачей в качестве оплачиваемых консультантов в медицинских консультативных советах.
Некоторые правозащитные группы, такие как No Free Lunch и AllTrials , раскритиковали влияние маркетинга лекарств на врачей, поскольку, по их мнению, это заставляет врачей назначать продаваемые лекарства даже тогда, когда другие могут быть дешевле или лучше для пациента. [111]
Были соответствующие обвинения в распространении болезней. [112] (чрезмерная медикализация) для расширения рынка лекарств. Первая конференция по этому вопросу состоялась в Австралии в 2006 году. [113] В 2009 году финансируемая правительством Национальная служба назначений запустила программу «Поиск доказательств – признание обмана», направленную на обучение врачей общей практики методам независимого анализа лекарств. [114]
Мета-анализ показал, что психиатрические исследования, спонсируемые фармацевтическими компаниями, в несколько раз чаще дают положительные результаты, а если в них участвует сотрудник фармацевтической компании, эффект еще больше. [115] [116] [117] Влияние распространилось и на подготовку врачей и медсестер в медицинских школах, с чем ведется борьба.
Утверждалось, что разработка Диагностического и статистического руководства по психическим расстройствам и расширение критериев представляют собой растущую медикализацию человеческой природы или « нагнетание болезней », вызванное влиянием фармацевтических компаний на психиатрию. [118] вероятность прямого конфликта интересов , отчасти потому, что примерно половина авторов, отбравших и определивших психические расстройства DSM-IV, имели или ранее имели финансовые отношения с фармацевтической промышленностью. Возросла [119]
В США, начиная с 2013 года, в соответствии с Отчетами о финансовой прозрачности врачей (часть Закона о солнечном свете) центры услуг Medicare и Medicaid должны собирать информацию от соответствующих производителей и групповых закупочных организаций, чтобы сообщать информацию об их финансовых отношениях с врачи и больницы. Данные публикуются на веб-сайте Центров услуг Medicare и Medicaid. Ожидается, что отношения между врачами и фармацевтической промышленностью станут полностью прозрачными. [120]
Согласно отчету OpenSecrets , в 2017 году в фармацевтическом бизнесе в том или ином качестве работали более 1100 лоббистов. В первом квартале 2017 года индустрия товаров для здоровья и фармацевтическая промышленность потратили 78 миллионов долларов на лоббирование членов Конгресса США. [121]
Цены на лекарства [ править ]
Ценообразование на фармацевтические препараты становится серьезной проблемой для систем здравоохранения. [122] В исследовании Западного центра политики здравоохранения , проведенном в ноябре 2020 года , говорится, что более 1,1 миллиона пожилых людей, в США, участвующих в программе Medicare как ожидается, умрут преждевременно в течение следующего десятилетия, потому что они не смогут позволить себе лекарства, отпускаемые по рецепту, и для этого потребуется дополнительно 17,7 миллиарда долларов. ежегодно тратится на медицинские расходы, которых можно избежать из-за осложнений со здоровьем. [123]
Нормативные вопросы [ править ]
Бен Голдейкр утверждал, что регулирующие органы, такие как Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) в Великобритании или Управление по контролю за продуктами и лекарствами (FDA) в США, продвигают интересы фармацевтических компаний, а не интересы фармацевтических компаний. общественности благодаря постоянному обмену сотрудниками между регулирующим органом и компаниями и развитию дружеских отношений между регулирующим органом и сотрудниками компании. [124] Он утверждает, что регулирующие органы не требуют, чтобы новые лекарства были лучше тех, что уже доступны, или даже чтобы они были особенно эффективными. [124]
Другие утверждают, что чрезмерное регулирование подавляет терапевтические инновации и что текущая стоимость клинических испытаний, необходимых регулирующим органам, препятствует полному использованию новых генетических и биологических знаний для лечения заболеваний человека. В отчете Президентского консультативного совета по науке и технологиям за 2012 год содержится несколько ключевых рекомендаций по снижению нормативного бремени при разработке новых лекарств, в том числе: 1) расширение использования FDA ускоренных процессов утверждения, 2) создание ускоренного пути утверждения лекарств, предназначенных для использования. в узко определенных группах населения и 3) проведение пилотных проектов, направленных на оценку осуществимости нового, адаптивного процесса утверждения лекарств. [125]
Фармацевтическое мошенничество [ править ]
Примеры и перспективы в этом разделе касаются главным образом Соединенных Штатов и не отражают мировую точку зрения на этот вопрос . ( Август 2015 г. ) |
Фармацевтическое мошенничество предполагает обман, который приносит финансовую выгоду фармацевтической компании. Это затрагивает частных лиц, а также государственных и частных страховщиков . Есть несколько разных схем [126] используется для мошенничества в системе здравоохранения , особенно в фармацевтической промышленности. К ним относятся: нарушения надлежащей производственной практики (GMP), неправомерный маркетинг, мошенничество с лучшими ценами, мошенничество с CME, отчетность о ценах Medicaid и промышленные сложные лекарства. [127] Из этой суммы 2,5 миллиарда долларов было возмещено по делам о ложных исках в 2010 финансовом году. Примеры случаев мошенничества включают урегулирование дела GlaxoSmithKline на 3 миллиарда долларов, урегулирование Pfizer на 2,3 миллиарда долларов и урегулирование Merck & Co. на 650 миллионов долларов. Ущерб от мошенничества может быть возмещен с помощью Закона о ложных исках , чаще всего в соответствии с положениями qui tam , которые вознаграждают человека за то, что он является « информатором » или родственником (закон) . [128]
Каждая крупная компания, продающая атипичные антипсихотики — Bristol-Myers Squibb , Eli Lilly and Company , Pfizer , AstraZeneca и Johnson & Johnson — либо урегулировала недавние правительственные дела в соответствии с Законом о ложных исках на сотни миллионов долларов, либо в настоящее время находится под следствием по делу о ложных исках. возможное мошенничество в сфере здравоохранения. После обвинений в незаконном маркетинге два поселения в 2009 году установили рекорды по самым крупным уголовным штрафам, когда-либо наложенным на корпорации. компании Eli Lilly Один из них касался антипсихотического препарата « Зипрекса» , а другой — «Бекстра» , противовоспалительного препарата, используемого при артрите. В деле Бекстры правительство также обвинило компанию Pfizer в незаконном сбыте другого антипсихотика, Геодона ; Pfizer урегулировала эту часть иска на сумму 301 миллион долларов, не признав никаких нарушений. [129]
2 июля 2012 года GlaxoSmithKline признала себя виновной по уголовным обвинениям и согласилась выплатить 3 миллиарда долларов по крупнейшему делу о мошенничестве в сфере здравоохранения в США и крупнейшему платежу фармацевтической компании. [130] Мировое соглашение связано с незаконным продвижением компанией рецептурных лекарств, несообщением данных о безопасности, [131] подкуп врачей и продвижение лекарств для использования, для которого они не были лицензированы. В число задействованных препаратов входили Паксил , Велбутрин , Адвайр , Ламиктал и Зофран , которые применялись не по назначению и не покрывались страховкой. Они, а также препараты «Имитрекс» , «Лотронекс» , «Фловент » и «Валтрекс» были задействованы в схеме откатов . [132] [133] [134]
Ниже приводится список четырех крупнейших соглашений с фармацевтическими компаниями, заключенных с 1991 по 2012 год, ранжированных по размеру общей суммы урегулирования. За последние два десятилетия судебные иски против фармацевтической промышленности сильно различались, включая мошенничество с программами Medicare и Medicaid , рекламу не по назначению и неадекватную производственную практику. [135] [136]
| Компания | Урегулирование | Нарушение(я) | Год | Продукт(ы) | Законы предположительно нарушены (если применимо) |
|---|---|---|---|---|---|
| ГлаксоСмитКляйн [137] | 3 миллиарда долларов | Продвижение вне этикетки/ нераскрытие данных о безопасности | 2012 | Авандия / Веллбутрин / Паксил | Закон о ложных исках / FDCA |
| Пфайзер [138] | 2,3 миллиарда долларов | Продвижение вне лейбла/ откаты | 2009 | Бекстра / Геодон / Зивокс / Лирика | Закон о ложных исках / FDCA |
| Эбботт Лаборатории [139] | 1,5 миллиарда долларов | Продвижение вне этикетки | 2012 | Депакот | Закон о ложных исках / FDCA |
| Эли Лилли [140] | 1,4 миллиарда долларов | Продвижение вне этикетки | 2009 | Зипрекса | Закон о ложных исках / FDCA |
Роли врача [ править ]
В мае 2015 года Медицинский журнал Новой Англии подчеркнул важность взаимодействия между фармацевтической промышленностью и врачами для разработки новых методов лечения и заявил, что моральное возмущение по поводу должностных преступлений отрасли неоправданно заставило многих переоценить проблемы, созданные финансовыми конфликтами интересов. В статье отмечается, что крупные организации здравоохранения, такие как Национальный центр развития трансляционных наук Национальных институтов здравоохранения, Совет президентских советников по науке и технологиям, Всемирный экономический форум, Фонд Гейтса, Wellcome Trust и Food and Technology Управление по лекарственным средствам поощряло более тесное взаимодействие между врачами и промышленностью, чтобы улучшить преимущества для пациентов. [141] [142]
Ответ на COVID-19 [ править ]
В ноябре 2020 года несколько фармацевтических компаний объявили об успешных испытаниях вакцины против COVID-19, эффективность которых составилаот 90 до 95% в предотвращении инфекции. Согласно заявлениям компаний и данным, проверенным внешними аналитиками, эти вакцины стоят от 3 до 37 долларов за дозу. [143] The Wall Street Journal опубликовал редакционную статью, призывающую отметить это достижение Нобелевской премией мира. [144]
«Врачи без границ» предупредили, что высокие цены и монополия на лекарства, тесты и вакцины продлят пандемию и будут стоить жизни. Они призвали правительства предотвратить спекуляцию, используя при необходимости принудительные лицензии , как это уже сделали Канада, Чили, Эквадор, Германия и Израиль. [145]
20 февраля 46 американских законодателей призвали правительство США не предоставлять монопольные права при выделении денег налогоплательщиков на разработку любых вакцин и методов лечения коронавируса, чтобы избежать предоставления эксклюзивного контроля над ценами и доступностью частным производителям. [146]
В Соединенных Штатах правительство подписало соглашения, в соответствии с которыми субсидировались исследования и разработки и/или строительство заводов по производству потенциальных препаратов для лечения COVID-19. Обычно соглашение предусматривало, что правительство получает право собственности на определенное количество доз препарата без дополнительной оплаты. Например, в рамках операции «Warp Speed» в США правительство субсидировало исследования, связанные с вакцинами и лекарствами против COVID-19, в компании Regeneron. [147] Johnson and Johnson, Moderna, AstraZeneca, Novavax, Pfizer и GSK. Типичные условия включали субсидии на исследования в размере от 400 до 2 миллиардов долларов, а также право собственности государства на первые 100 миллионов доз любой успешно разработанной вакцины против COVID-19. [148]
Американская фармацевтическая компания Gilead 23 марта 2020 года запросила и получила статус орфанного препарата для ремдесивира от Управления по контролю за продуктами и лекарствами США (FDA). Это положение призвано стимулировать разработку лекарств, от которых страдают менее 200 000 американцев, путем предоставления усиленных и расширенных юридических монопольных прав. производителю, а также освобождение от налогов и государственных пошлин. [149] [150] Ремдесивир является кандидатом на лечение COVID-19; на момент предоставления статуса менее 200 000 американцев болели COVID-19, но их число быстро росло по мере того, как пандемия COVID-19 достигла США, и вскоре пересечение порога считалось неизбежным. [149] [150] Ремдесивир был разработан компанией Gilead при финансовой поддержке правительства США на сумму более 79 миллионов долларов. [150] В мае 2020 года компания Gilead объявила, что бесплатно предоставит федеральному правительству первые 940 000 доз ремдесивира. [151] Столкнувшись с резкой реакцией общественности, компания Gilead 25 марта отказалась от статуса «орфанного препарата» для ремдесивира. [152] Компания Gilead сохраняет за собой 20-летние патенты на ремдесивир более чем в 70 странах. [145] В мае 2020 года компания также объявила, что ведет переговоры с несколькими компаниями, производящими дженерики, о предоставлении прав на производство ремдесивира для развивающихся стран, а также с Патентным пулом лекарственных средств о предоставлении более широкого доступа к дженерикам. [153]
Развивающийся мир [ править ]
Патенты [ править ]
Патенты подвергаются критике в развивающихся странах, поскольку они считаются [ ВОЗ? ] сократить доступ к существующим лекарствам. [154] Примирение патентов и всеобщего доступа к медицине потребует эффективной международной политики ценовой дискриминации . Более того, согласно ТРИПС соглашению Всемирной торговой организации , страны должны разрешить патентование фармацевтической продукции. В 2001 году ВТО приняла Дохийскую декларацию , которая указывает, что соглашение ТРИПС следует читать с учетом целей общественного здравоохранения, и допускает некоторые методы обхода фармацевтических монополий: посредством принудительного лицензирования или параллельного импорта , даже до истечения срока действия патента. [155]
В марте 2001 года 40 транснациональных фармацевтических компаний подали иск против Южной Африки из-за Закона о лекарственных средствах , который разрешал производство дженериков антиретровирусных препаратов (АРВ) для лечения ВИЧ, несмотря на то, что эти препараты находились в патенте. [156] ВИЧ был и остается эпидемией в Южной Африке, а АРВ-препараты в то время стоили от 10 000 до 15 000 долларов США на пациента в год. Это было не по карману большинству граждан Южной Африки, и поэтому правительство Южной Африки взяло на себя обязательство предоставлять АРВ-препараты по ценам, близким к тем, которые люди могли себе позволить. Для этого им придется игнорировать патенты на лекарства и производить дженерики внутри страны (по принудительной лицензии) или импортировать их из-за границы. После международного протеста в защиту прав общественного здравоохранения (включая сбор 250 000 подписей организацией «Врачи без границ» ) правительства нескольких развитых стран (включая Нидерланды, Германию, Францию, а затем и США) поддержали правительство Южной Африки, а Дело было прекращено в апреле того же года. [157]
В 2016 году GlaxoSmithKline (шестая по величине фармацевтическая компания в мире) объявила, что откажется от своих патентов в бедных странах, чтобы позволить независимым компаниям производить и продавать версии своих лекарств в этих регионах, тем самым расширяя к ним общественный доступ. [158] GlaxoSmithKline опубликовала список из 50 стран, в которых они больше не будут иметь патенты, что затронет один миллиард человек во всем мире.
Благотворительные программы [ править ]
В 2011 году четыре из 20 крупнейших корпоративных благотворительных пожертвований и восемь из 30 крупнейших корпоративных благотворительных пожертвований поступили от фармацевтических производителей. Основная часть корпоративных благотворительных пожертвований (69% по состоянию на 2012 год) поступает в виде неденежных благотворительных пожертвований, большая часть которых также представляет собой пожертвования фармацевтических компаний. [159]
Благотворительные программы, а также усилия фармацевтических компаний по открытию и разработке лекарств включают:
- « Подарок компании Merck », в рамках которого миллиарды лекарств от речной слепоты были пожертвованы Африке. [160]
- Pfizer Подарок в виде бесплатного/скидочного флуконазола и других лекарств от СПИДа в Южной Африке [161]
- Обязательство GSK бесплатно предоставлять ВОЗ таблетки альбендазола до ликвидации лимфатического филяриоза во всем мире.
- В 2006 году Novartis выделила 755 миллионов долларов США на инициативы корпоративного гражданства по всему миру, уделяя особое внимание улучшению доступа к лекарствам в развивающихся странах посредством своих проектов «Доступ к медицине», включая пожертвования лекарств пациентам, страдающим проказой , туберкулезом и малярией ; «Гливек» программы помощи пациентам ; и помощь для поддержки крупных гуманитарных организаций, нуждающихся в неотложной медицинской помощи. [162]
См. также [ править ]
- Список промышленных комплексов – Экономическая концепция.
- Теории заговора крупных фармацевтических компаний - Теории заговора о фармацевтической промышленности
- Клинические испытания – Этап клинических исследований в медицине.
- Разработка лекарств - процесс вывода на рынок нового фармацевтического препарата.
- Открытие лекарств – фармацевтическая процедура
- Легальная торговля наркотиками – производство и продажа фармацевтических препаратов.
- Список фармацевтических компаний
- Лицензионное производство - Производство по лицензии технологии, разработанной в других местах.
- Аутсорсинг – передача ранее внутренних задач внешней организации.
- Фармацевтический маркетинг - Реклама фармацевтических компаний.
- Фармация – Клиническое здравоохранение
- Управление льготами в аптеках - Управление программами по рецептурным лекарствам в США.
- Unitaid – Глобальная инициатива в области здравоохранения
- Оценка (финансы) § Оценка нематериальных активов
Ссылки [ править ]
- ^ Макгуайр, Джон Л.; Хаскарл, Хорст; Боде, Герд; Клингманн, Ингрид; Зан, Мануэль (2007). «Фармацевтика, общий обзор». Энциклопедия промышленной химии Ульмана . Уайли. дои : 10.1002/14356007.a19_273.pub2 . ISBN 978-3527306732 .
- ^ Бозенхардт, Эрих Х.; Бозенхардт, Герман Ф. (18 октября 2018 г.). «Вы слишком многого требуете от своего наполнителя?» . Фармацевтический Интернет (Гостевая рубрика). ВертМаркетс. Архивировано из оригинала 17 ноября 2020 года . Проверено 30 октября 2018 г.
Основная задача фармацевтической промышленности — производство продуктов для пациентов, позволяющих их вылечить, вакцинировать или облегчить симптомы, часто путем производства жидких инъекционных или твердых пероральных препаратов, а также других методов лечения.
- ^ Рынки, исследования и (31 марта 2021 г.). «Отчет о мировом фармацевтическом рынке за 2021 год: ожидается, что рынок вырастет с 1 228,45 миллиарда долларов в 2020 году до 1 250,24 миллиарда долларов в 2021 году - долгосрочный прогноз на 2025 и 2030 годы» . Информационный центр GlobeNewswire (пресс-релиз). Архивировано из оригинала 29 ноября 2021 года . Проверено 29 ноября 2021 г.
- ↑ Перейти обратно: Перейти обратно: а б «Появление фармацевтической науки и промышленности: 1870-1930 годы» . Новости хим . 83 (25). 20 июня 2005 г. Архивировано из оригинала 10 ноября 2018 г. Проверено 23 июля 2022 г.
- ^ Многонациональные корпорации, включая Merck , Hoffman-La Roche , Burroughs-Wellcome (ныне часть Glaxo Smith Kline ), Abbott Laboratories , Eli Lilly и Upjohn (ныне часть Pfizer ), начинали свою деятельность как местные аптеки в середине 1800-х годов.
- ^ Снидер, Уолтер (31 октября 2005 г.). «13 нейрогормонов». Открытие наркотиков: история . Джон Уайли и сыновья. стр. 155–156. ISBN 978-0-470-01552-0 . Проверено 23 июля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Расмуссен, Николас (2006). «Создание первого антидепрессанта: амфетамин в американской медицине, 1929–1950». J Hist Med Allied Sci . 61 (3): 288–323. дои : 10.1093/jhmas/jrj039 . ПМИД 16492800 . S2CID 24974454 .
- ^ Расмуссен Н. (июнь 2008 г.). «Первая амфетаминовая эпидемия в Америке, 1929–1971» . Am J Общественное здравоохранение . 98 (6): 974–985. дои : 10.2105/AJPH.2007.110593 . ПМЦ 2377281 . ПМИД 18445805 .
- ^ Ясири З., Шорвон С.Д. (декабрь 2012 г.). «Как фенобарбитал произвел революцию в терапии эпилепсии: история терапии фенобарбиталом эпилепсии за последние 100 лет». Эпилепсия . 53 (Приложение 8): 26–39. дои : 10.1111/epi.12026 . ПМИД 23205960 . S2CID 8934654 .
- ^ Лопес-Муньос Ф, Уча-Удабе Р, Аламо К (декабрь 2005 г.). «История барбитуратов спустя столетие после их клинического внедрения» . Лечение нейропсихиатра . 1 (4): 329–43. ПМК 2424120 . ПМИД 18568113 .
- ^ «Поправки 1965 года о борьбе со злоупотреблением наркотиками». НЭМ (Редакционная статья). 273 (22): 1222–1223. 25 ноября 1965 г. doi : 10.1056/NEJM196511252732213 .
Сотрудники Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, осознавая серьезность проблемы, подсчитали, что примерно половина из 9 000 000 000 капсул и таблеток барбитуратов и амфетаминов, ежегодно производимых в этой стране, перенаправляется для незаконного использования. Прибыль, полученная от незаконной продажи этих наркотиков, оказалась привлекательной для организованной преступности, поскольку амфетамин можно купить оптом по цене менее 1 доллара за 1000 капсул, но при продаже на нелегальном рынке он приносит от 30 до 50 долларов за 1000 капсул. а при продаже индивидуальному покупателю планшет может стоить от 10 до 25 центов.
- ^ «Седативные и снотворные средства — Барбитураты — I». НЭМ . 255 (24): 1150–1151. 1956. doi : 10.1056/NEJM195612132552409 . ПМИД 13378632 .
Барбитураты, введенные в медицину Э. Фишером и Й. фон Мерингом в 1903 г., безусловно, относятся к числу наиболее широко используемых и злоупотребляемых лекарств в медицине. Ежегодно производится около 400 тонн этих агентов; этого достаточно, чтобы каждую ночь в течение этого периода усыплять примерно 9 000 000 человек, если каждому давать по 0,1 грамма. доза
- ^ Розенфельд Л. (декабрь 2002 г.). «Инсулин: открытие и споры» . Клин Чем . 48 (12): 2270–88. дои : 10.1093/clinchem/48.12.2270 . ПМИД 12446492 .
- ^ «Основные причины смерти, 1900–1998 гг.» (PDF) . CDC.gov . Архивировано (PDF) из оригинала 13 декабря 2020 г. Проверено 23 июля 2022 г.
- ^ Андерсон, Роберт Н. (13 декабря 1999 г.). «Таблица продолжительности жизни в США, 1997 г.» (PDF) . Национальные отчеты по статистике естественного движения населения . 47 (28): 1–37. ПМИД 10635683 . Архивировано из оригинала (PDF) 25 октября 2020 года . Проверено 23 июля 2022 г.
- ^ Сепковиц, Кент А. (июль 2011 г.). «Сто лет Сальварсану». Н. англ. Дж. Мед. (Перспектива). 365 (4): 291–3. дои : 10.1056/NEJMp1105345 . ПМИД 21793743 .
- ^ Уильямс, KJ (1 августа 2009 г.). «Внедрение «химиотерапии» с использованием арсфенамина – первое волшебное средство» . JR Soc. Мед. 102 (8): 343–348. дои : 10.1258/jrsm.2009.09k036 . ISSN 0141-0768 . ПМК 2726818 . ПМИД 19679737 .
- ^ Аминов, Рустам И. (8 декабря 2010 г.). «Краткая история эры антибиотиков: извлеченные уроки и задачи на будущее» . Передний. Микробиол. 1 : 134. дои : 10.3389/fmicb.2010.00134 . ПМК 3109405 . ПМИД 21687759 .
- ^ Хагер, Томас (2006). Демон под микроскопом (1-е изд.). Нью-Йорк: Книги Гармонии. ISBN 978-1-4000-8213-1 .
- ^ «Все Нобелевские премии по физиологии и медицине» . Нобелевская премия . Проверено 22 июля 2022 г.
- ^ Катлер, Дэвид М .; Меара, Эллен (октябрь 2001 г.). Изменения в возрастном распределении смертности в ХХ веке (PDF) (Отчет). Национальное бюро экономических исследований. дои : 10.3386/w8556 . Проверено 23 июля 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Кляйн, Герберт (2012). История населения Соединенных Штатов . Издательство Кембриджского университета. п. 167.
- ^ Параскандола, Джон (1980). История антибиотиков: симпозиум . Американский институт истории фармацевтики № 5. ISBN 978-0-931292-08-8 .
- ^ «Дифтерия — Хронология — История вакцин» . Архивировано из оригинала 14 мая 2016 года . Проверено 24 февраля 2022 г.
- ^ II, Томас Х. Мо (13 апреля 2005 г.). «Морис Р. Хиллеман, 85 лет; ученый разработал множество вакцин, которые спасли миллионы жизней - Los Angeles Times» . Лос-Анджелес Таймс . Архивировано из оригинала 7 ноября 2014 года.
- ^ «Важные даты в истории закона о пищевых продуктах и лекарствах США» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 6 марта 2013 года . Проверено 16 декабря 2019 г.
- ^ «FDAReview.org, проект Независимого института» . Архивировано из оригинала 2 декабря 2015 года . Проверено 24 февраля 2022 г.
- ^ «Сульфаниламидная катастрофа» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 25 ноября 2020 года . Проверено 16 декабря 2019 г.
- ^ «История FDA. Часть II» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 1 января 2018 года . Проверено 16 декабря 2019 г.
- ^ Заффири Л., Гарднер Дж., Толедо-Перейра Л.Х. (апрель 2012 г.). «История антибиотиков. От сальварсана до цефалоспоринов». Джей Инвест Сург . 25 (2): 67–77. дои : 10.3109/08941939.2012.664099 . ПМИД 22439833 . S2CID 30538825 .
- ^ Гамильтон-Миллер Дж. М. (март 2008 г.). «Разработка полусинтетических пенициллинов и цефалоспоринов». Межд. Дж. Антимикроб. Агенты . 31 (3): 189–92. дои : 10.1016/j.ijantimicag.2007.11.010 . ПМИД 18248798 .
- ^ Авраам Э.П. (1987). «Цефалоспорины 1945-1986». Наркотики . 34 Приложение 2 (Приложение 2): 1–14. дои : 10.2165/00003495-198700342-00003 . ПМИД 3319494 . S2CID 12014890 .
- ↑ Перейти обратно: Перейти обратно: а б Кингстон W (июль 2004 г.). «Стрептомицин, Шац против Ваксмана и баланс заслуг открытия». J Hist Med Allied Sci . 59 (3): 441–62. дои : 10.1093/jhmas/jrh091 . ПМИД 15270337 . S2CID 27465970 .
- ^ Нельсон М.Л., Леви С.Б. (декабрь 2011 г.). «История тетрациклинов». Энн. Н-Й акад. Наука . 1241 (1): 17–32. Бибкод : 2011NYASA1241...17N . дои : 10.1111/j.1749-6632.2011.06354.x . ПМИД 22191524 . S2CID 34647314 .
- ^ «ЭРИТРОМИЦИН» . Бр Мед Дж . 2 (4793): 1085–6. Ноябрь 1952 г. doi : 10.1136/bmj.2.4793.1085 . ПМК 2022076 . ПМИД 12987755 .
- ^ Андерсон, Розалин (2012). Химия антибактериальных средств, механизм действия, механизмы резистентности и клиническое применение . Оксфорд: ВиБлэквелл. ISBN 9780470972458 .
- ^ Отчет Федеральной торговой комиссии о производстве антибиотиков, июнь 1958 г. (Вашингтон, округ Колумбия, государственная типография, 1958 г.), страницы 98-120.
- ^ Отчет Федеральной торговой комиссии о производстве антибиотиков, июнь 1958 г. (Вашингтон, округ Колумбия, правительственная типография, 1958 г.), стр. 277
- ^ Андерсон, Роберт Н. (13 декабря 1999 г.). «Таблица продолжительности жизни в США, 1997 г.» (PDF) . Национальные отчеты по статистике естественного движения населения: предоставлены Центрами по контролю и профилактике заболеваний, Национальным центром статистики здравоохранения, Национальной системой статистики естественного движения населения . 47 (28): 1–37. ПМИД 10635683 . Архивировано (PDF) из оригинала 25 октября 2020 г. Проверено 8 сентября 2017 г.
- ^ Катлер, Дэвид; Меара, Эллен (октябрь 2001 г.). «Изменения в возрастном распределении смертности в ХХ веке» (PDF) . Рабочий документ NBER № 8556 . дои : 10.3386/w8556 . Архивировано (PDF) из оригинала 30 июля 2020 года . Проверено 24 февраля 2022 г.
- ^ СВИТ Б.Х., ХИЛЛЕМАН М.Р. (ноябрь 1960 г.). «Вакуолизирующий вирус, СВ 40». Учеб. Соц. Эксп. Биол. Мед . 105 (2): 420–7. дои : 10.3181/00379727-105-26128 . ПМИД 13774265 . S2CID 38744505 .
- ^ Шах К., Натансон Н. (январь 1976 г.). «Воздействие SV40 на человека: обзор и комментарии». Являюсь. Дж. Эпидемиол . 103 (1): 1–12. doi : 10.1093/oxfordjournals.aje.a112197 . ПМИД 174424 .
- ^ «Исследования: нет доказательств того, что SV40 связан с раком - Национальный институт рака» . Архивировано из оригинала 28 октября 2014 года.
- ^ «История вакцин — проект истории вакцин Колледжа врачей Филадельфии» . Архивировано из оригинала 19 февраля 2022 года . Проверено 24 февраля 2022 г.
- ^ «Профилактика кори, краснухи, синдрома врожденной краснухи и эпидемического паротита, 2013» . Архивировано из оригинала 10 ноября 2014 года . Проверено 8 сентября 2017 г.
- ^ Блох А.Б., Оренштейн В.А., Стетлер Х.К. и др. (1985). «Влияние вакцинации против кори на здоровье в Соединенных Штатах». Педиатрия . 76 (4): 524–32. дои : 10.1542/педс.76.4.524 . ПМИД 3931045 . S2CID 6512947 .
- ^ Инсулл В. (январь 2009 г.). «Патология атеросклероза: развитие бляшек и реакция бляшек на лечение». Американский медицинский журнал . 122 (1 дополнение): S3 – S14. дои : 10.1016/j.amjmed.2008.10.013 . ПМИД 19110086 .
- ^ Гаддам К.К., Верма А., Томпсон М., Амин Р., Вентура Х. (май 2009 г.). «Гипертония и сердечная недостаточность в различных формах» . Медицинские клиники Северной Америки . 93 (3): 665–80. дои : 10.1016/j.mcna.2009.02.005 . ПМИД 19427498 . Проверено 20 июня 2009 г.
- ^ Агабити-Розей Э (сентябрь 2008 г.). «От макро- к микроциркуляции: преимущества при гипертонии и диабете». Журнал гипертонии . 26 (Приложение 3): С15–21. дои : 10.1097/01.hjh.0000334602.71005.52 . ПМИД 19363848 .
- ^ Мерфи Б.П., Стэнтон Т., Данн Ф.Г. (май 2009 г.). «Гипертония и ишемия миокарда» . Медицинские клиники Северной Америки . 93 (3): 681–95. дои : 10.1016/j.mcna.2009.02.003 . ПМИД 19427499 . Проверено 20 июня 2009 г.
- ^ Белый ВБ (май 2009 г.). «Определение проблемы лечения больного гипертонической болезнью и артритическими болями». Американский медицинский журнал . 122 (5 Приложений): С3–9. doi : 10.1016/j.amjmed.2009.03.002 . ПМИД 19393824 .
- ^ Труонг Л.Д., Шен С.С., Парк М.Х., Кришнан Б. (февраль 2009 г.). «Диагностика неопухолевых поражений в образцах нефрэктомии» . Архивы патологии и лабораторной медицины . 133 (2): 189–200. дои : 10.5858/133.2.189 . ПМИД 19195963 . Проверено 20 июня 2009 г.
- ^ Трейси Р.Э., Уайт С. (февраль 2002 г.). «Метод количественной оценки узловой гиперплазии надпочечников при аутопсии: некоторые применения метода для выявления гипертонии и атеросклероза». Анналы диагностической патологии . 6 (1): 20–9. дои : 10.1053/adpa.2002.30606 . ПМИД 11842376 .
- ^ Аронов В.С. (август 2008 г.). «Гипертония и пожилой диабетик» . Клиники гериатрической медицины . 24 (3): 489–501, vi–vii. дои : 10.1016/j.cger.2008.03.001 . ПМИД 18672184 . Проверено 20 июня 2009 г.
- ^ Гарднер А.В., Афак А. (2008). «Лечение заболеваний периферических артерий нижних конечностей» . Журнал сердечно-легочной реабилитации и профилактики . 28 (6): 349–57. дои : 10.1097/HCR.0b013e31818c3b96 . ПМЦ 2743684 . ПМИД 19008688 .
- ^ Ново С, Лунетта М, Эвола С, Ново Г (январь 2009 г.). «Роль БРА в терапии артериальной гипертонии и профилактике сердечно-сосудистых событий» . Текущие цели по борьбе с наркотиками . 10 (1): 20–5. дои : 10.2174/138945009787122897 . ПМИД 19149532 . Архивировано из оригинала 12 января 2013 года . Проверено 20 июня 2009 г.
- ^ Крейг В.М. (1939). «Хирургическое лечение гипертонии» . Бр Мед Дж . 2 (4120): 1215–9. дои : 10.1136/bmj.2.4120.1215 . ПМК 2178707 . ПМИД 20782854 .
- ^ Снидер, Уолтер (2005). Открытие наркотиков. История . Нью-Йорк: Уайли. п. 371.
- ^ Бейер К.Х. (1993). «Хлоротиазид. Как тиазиды развивались в качестве антигипертензивной терапии» . Гипертония . 22 (3): 388–91. дои : 10.1161/01.hyp.22.3.388 . ПМИД 8349332 .
- ^ БОРХАНИ НЕТ, ХЕХТЕР Х.Х. (1964). «Недавние изменения в смертности от сердечно-сосудистых заболеваний в Калифорнии: эпидемиологическая оценка» . здравоохранения Представитель общественного 79 (2): 147–60. дои : 10.2307/4592077 . JSTOR 4592077 . ЧВК 1915335 . ПМИД 14119789 .
- ^ «Фонд Ласкера – Награды» . Архивировано из оригинала 23 декабря 2015 года . Проверено 24 февраля 2022 г.
- ^ Райт, Джеймс М.; Мусини, Виджая М.; Гилл, Рупам (18 апреля 2018 г.). «Препараты первой линии при гипертонической болезни» . Кокрановская база данных систематических обзоров . 2018 (4): CD001841. дои : 10.1002/14651858.CD001841.pub3 . ISSN 1469-493X . ПМК 6513559 . ПМИД 29667175 .
- ^ Стейсон В.Б., Кэннон П.Дж., Хайнеманн Х.О., Лара Дж.Х. (ноябрь 1966 г.). «Фуросемид. Клиническая оценка его диуретического действия» . Тираж . 34 (5): 910–20. дои : 10.1161/01.cir.34.5.910 . ПМИД 5332332 . S2CID 886870 .
- ^ Блэк Дж.В., Кроутер А.Ф., Шанкс Р.Г., Смит Л.Х., Дорнхорст AC (1964). «Новый антагонист адренергических бетарецепторов». Ланцет . 283 (7342): 1080–1081. дои : 10.1016/S0140-6736(64)91275-9 . ПМИД 14132613 .
- ^ Льв Дж., Перкович В., Фут К.В., Крейг М.Э., Крейг Дж.К., Стрипполи Г.Ф. (2012). «Антигипертензивные средства для профилактики диабетической болезни почек». Cochrane Database Syst Rev. 12 : CD004136. дои : 10.1002/14651858.CD004136.pub3 . ПМИД 23235603 .
- ^ «Краткая история противозачаточных таблеток - График приема таблеток | Нужно знать | PBS» . ПБС . 7 мая 2010 г. Архивировано из оригинала 19 января 2018 г. . Проверено 8 сентября 2017 г.
- ^ Журнал, Смитсоновский институт. «Почему оральные контрацептивы известны просто как «таблетки» » . Смитсоновский журнал . Смитсонианмаг.com. Архивировано из оригинала 28 апреля 2021 года . Проверено 24 февраля 2022 г.
- ^ «BBC News | ЗДОРОВЬЕ | Краткая история таблетки» . Архивировано из оригинала 6 июля 2021 года . Проверено 24 февраля 2022 г.
- ^ «Одобрение FDA первого орального контрацептива Эновид» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 23 июля 2017 года . Проверено 16 декабря 2019 г.
- ^ Кафе, Ребекка (4 декабря 2011 г.). «BBC News - Как противозачаточные таблетки изменили Британию» . Новости Би-би-си . Архивировано из оригинала 16 июня 2019 года . Проверено 21 июня 2018 г.
- ^ «Брошюра: История регулирования оборота наркотиков в США» . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала 23 июля 2017 года . Проверено 16 декабря 2019 г.
- ^ Тоберт, Джонатан А. (июль 2003 г.). «Ловастатин и не только: история ингибиторов ГМГ-КоА-редуктазы». Nature Reviews Открытие лекарств . 2 (7): 517–526. дои : 10.1038/nrd1112 . ISSN 1474-1776 . ПМИД 12815379 . S2CID 3344720 .
- ^ Эндо А (1 ноября 1992 г.). «Открытие и разработка ингибиторов ГМГ-КоА-редуктазы» . Журнал исследований липидов . 33 (11): 1569–82. дои : 10.1016/S0022-2275(20)41379-3 . ПМИД 1464741 .
- ^ Эндо, Акира (2004). «Происхождение статинов». Серия международных конгрессов . 1262 : 3–8. дои : 10.1016/j.ics.2003.12.099 .
- ^ Скандинавское симвастатин-выживание (ноябрь 1994 г.). «Рандомизированное исследование снижения уровня холестерина у 4444 пациентов с ишемической болезнью сердца: скандинавское исследование выживаемости с симвастатином (4S)». Ланцет . 344 (8934): 1383–9. дои : 10.1016/S0140-6736(94)90566-5 . ПМИД 7968073 . S2CID 5965882 .
- ^ «Национальный зал славы изобретателей награждает призывников 2012 года» . PRNewswire. Архивировано из оригинала 12 мая 2014 года . Проверено 11 мая 2014 г.
- ^ «Как один ученый, заинтригованный плесенью, нашел первый статин» . Уолл Стрит Джорнал . Архивировано из оригинала 24 февраля 2022 года . Проверено 11 мая 2014 г.
- ^ «Отчет о ведущей мировой фармацевтической компании — The Pharma 1000» (PDF) . Торрея . Проверено 19 августа 2022 г.
- ^ «Отчет о ведущих мировых фармацевтических компаниях» (PDF) . Фарма 1000 . Ноябрь 2021 года . Проверено 29 декабря 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Альварадо, Далила; Пальяруло, Нед (8 января 2024 г.). «Год увольнений в биотехнологиях заставляет промышленность искать искру» . Биофарма Дайв . Проверено 10 января 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б Белл, Джейкоб (20 декабря 2022 г.). «Сделки по слияниям и поглощениям в сфере биотехнологий набирают обороты. Вот последняя сделка» . БиофармаДайв . Архивировано из оригинала 24 декабря 2022 года . Проверено 23 декабря 2022 г.
- ^ «Ежегодный отчет о воздействии» . Центр Тафтса по изучению разработки лекарств . Архивировано из оригинала 3 февраля 2022 года . Проверено 24 февраля 2022 г.
- ^ «Фармацевтическая промышленность в цифрах: ключевые данные 2021» (PDF) . Европейская федерация фармацевтической промышленности и ассоциаций . Проверено 30 апреля 2022 г.
- ^ Outsource-Pharma.com (25 мая 2011 г.). «Компания Pfizer совместно с Parexel и Icon участвует в последних стратегических сделках в секторе CRO» . Аутсорсинг-Pharma.com . Архивировано из оригинала 11 октября 2013 года . Проверено 24 февраля 2022 г.
- ^ «Сколько новых лекарств одобрило FDA в прошлом году?» . pharmalot.com. Архивировано из оригинала 8 мая 2011 года . Проверено 23 апреля 2011 г.
- ^ "Исследовать" . Архивировано из оригинала 20 июля 2011 года . Проверено 24 ноября 2006 г.
- ↑ Перейти обратно: Перейти обратно: а б Перри, Сьюзен (8 августа 2012 г.). «Дональд Лайт и Джоэл Лекчин в BMJ 2012;345:e4348, цитируется в: Заявление Big Pharma об «инновационном кризисе» — это миф, говорят авторы BMJ» . МиннПост . Архивировано из оригинала 11 августа 2012 года . Проверено 8 августа 2012 г.
- ^ «О ФРМА – ФРМА» . Архивировано из оригинала 4 января 2013 года . Проверено 23 апреля 2011 г.
- ^ «Модель фармацевтического блокбастера обанкротилась?» . bain.com . Архивировано из оригинала 24 марта 2016 года . Проверено 19 мая 2016 г.
- ^ Харпер, Мэтью (10 февраля 2012 г.). «Поистине ошеломляющая стоимость изобретения новых лекарств» . Форбс . Архивировано из оригинала 9 декабря 2020 года . Проверено 8 сентября 2017 г.
- ^ IMS Health (18 июня 2015 г.). «Достаточно ли защищены европейские биотехнологические компании?» . Портал конкурентной разведки . Архивировано из оригинала 30 июня 2015 года . Проверено 27 июня 2015 г.
- ^ Либерти Л., Макослейн Дж. Н., Уокер С. (2011). «Стандартизация оценки пользы и риска новых лекарств: практическое применение принципов для фармацевтических работников здравоохранения» . Фарм Мед . 25 (3): 139–46. дои : 10.1007/BF03256855 . S2CID 45729390 . Архивировано из оригинала 6 февраля 2012 года . Проверено 18 октября 2011 г.
- ^ «Электронная оранжевая книга» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 7 апреля 2020 года . Проверено 31 мая 2007 г.
- ^ «Закон о лекарствах-сиротах (с поправками)» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 7 апреля 2020 года . Проверено 24 сентября 2007 г.
- ^ «20 крупнейших фармацевтических компаний по выручке в 2022 году» .
- ^ «Стандарт домена www.vfa.de» (PDF) . Архивировано из оригинала (PDF) 11 августа 2016 года . Проверено 24 марта 2008 г.
- ^ Херпер, Мэтью и Канг, Питер (22 марта 2006 г.). «Десять самых продаваемых лекарств в мире» . Форбс . Архивировано из оригинала 5 мая 2006 года . Проверено 31 мая 2007 г.
- ^ «Создание взаимосвязанных решений для повышения эффективности здравоохранения» . ИМС Здоровье . Архивировано из оригинала (PDF) 10 мая 2020 года . Проверено 23 февраля 2022 г.
- ^ Коллеве, Юлия (27 марта 2014 г.). «10 самых продаваемых в мире рецептурных лекарств заработали в прошлом году 75 миллиардов долларов» . Хранитель . Архивировано из оригинала 7 апреля 2020 года . Проверено 12 декабря 2016 г.
- ^ «100 лучших лекарств 2013 года по продажам — Фармацевтическая статистика США» . Архивировано из оригинала 31 марта 2014 года . Проверено 23 января 2018 г.
- ^ «IMS Health прогнозирует рост мирового фармацевтического рынка в 2007 году на 5–6 процентов» . ИМС Здоровье. 24 октября 2006 г. Архивировано из оригинала 3 мая 2011 г. . Проверено 19 июня 2007 г.
- ^ Часто задаваемые вопросы (FAQ). Архивировано 25 февраля 2013 г. на Wayback Machine.
- ^ «Новые разрешения на лекарства в 2006 г.» (PDF) . Март 2007 г. Архивировано из оригинала (PDF) 28 февраля 2008 г. Проверено 23 февраля 2008 г.
- ^ «Оценка разрешенных дженериков в США» (PDF) . Компания «ИМС Консалтинг». Июнь 2006 г. Архивировано из оригинала (PDF) 28 февраля 2008 г. . Проверено 23 февраля 2008 г.
- ^ «Sanofi увольняет 1700 сотрудников в США» . Открытие и разработка лекарств . Архивировано из оригинала 11 сентября 2011 года . Проверено 24 февраля 2022 г.
- ^ «Здоровье и питание 2007 г. — перепись» (PDF) . Бюро переписи населения США. Архивировано (PDF) из оригинала 31 июля 2020 года . Проверено 19 мая 2016 г.
- ^ Голдакр, Бен (2014). Плохая фармацевтика: как фармацевтические компании вводят врачей в заблуждение и причиняют вред пациентам (Первое американское издание в мягкой обложке). Макмиллан. ISBN 9780865478060 .
- ^ Кауфман, Марк (6 мая 2005 г.). «Генеральный директор Merck уходит в отставку, поскольку расследование по делу о наркотиках продолжается» . Вашингтон Пост . Архивировано из оригинала 9 ноября 2020 года . Проверено 23 мая 2007 г.
- ^ «Непревзойденное нарколобби: как фармацевтическая промышленность добивается своего в Вашингтоне» . publicintegrity.org. 7 июля 2005 г. Архивировано из оригинала 9 июня 2007 г. Проверено 23 мая 2007 г.
- ^ Мойнихан, Р. (29 мая 2003 г.). «Спонсорство образования фармацевтическими компаниями можно заменить за небольшую часть его стоимости» . БМЖ . 326 (7400): 1163. doi : 10.1136/bmj.326.7400.1163 . ПМЦ 1126044 . ПМИД 12775595 .
- ^ «Доктор Ноу Бесплатный обед» . Мать Джонс . Архивировано из оригинала 16 ноября 2020 года . Проверено 19 мая 2016 г.
- ^ Мойнихан, Рэй; Кассельс, Алан (2005). Продажа болезней: как фармацевтические компании превращают нас всех в пациентов . Воронье гнездо, Новый Южный Уэльс: Аллен и Анвин. ISBN 978-1-74114-579-3 .
- ^ «Сборник статей о распространении болезней» . Публичная научная библиотека. Архивировано из оригинала 7 июня 2007 года . Проверено 23 мая 2007 г.
- ^ «Исследования фармацевтического рынка, тенденции и аналитические отчеты» . литературный.com. Архивировано из оригинала 19 января 2016 года . Проверено 17 января 2016 г.
- ^ Бучковский, С.С.; Джувессон, П.Дж. (апрель 2004 г.). «Отраслевое спонсорство и авторство клинических исследований более 20 лет». Энн Фармакотер . 38 (4): 579–85. дои : 10.1345/aph.1D267 . ПМИД 14982982 . S2CID 43544256 .
- ^ Перлис Р.Х., Перлис К.С., Ву Ю, Хван С., Джозеф М., Ниренберг А.А. (октябрь 2005 г.). «Промышленное спонсорство и финансовый конфликт интересов при освещении клинических испытаний в психиатрии». Am J Психиатрия . 162 (10): 1957–60. дои : 10.1176/appi.ajp.162.10.1957 . ПМИД 16199844 .
- ^ Тунгараза, Т; Пул, Р. (июль 2007 г.). «Влияние авторства и спонсорства фармацевтических компаний на результаты испытаний лекарств» . Br J Психиатрия . 191 (1): 82–3. дои : 10.1192/bjp.bp.106.024547 . ПМИД 17602130 .
- ^ Хили, Д. (2006). «Последняя мания: продажа биполярного расстройства» . ПЛОС Мед . 3 (4): е185. doi : 10.1371/journal.pmed.0030185 . ПМЦ 1434505 . ПМИД 16597178 .
- ^ Косгроув, Лиза; Крымский, Шелдон; Виджаярагаван, Маниша; Шнайдер, Лиза (2006). «Финансовые связи между членами комиссии DSM-IV и фармацевтической промышленностью». Психотерапия и психосоматика . 75 (3): 154–160. дои : 10.1159/000091772 . ПМИД 16636630 . S2CID 11909535 .
- ^ «Открытые платежи» . Февраль 2019. Архивировано из оригинала 22 февраля 2022 года . Проверено 24 февраля 2022 г.
- ^ Липтон, Эрик; Томас, Кэти (29 мая 2017 г.). «Боевой клич нарколоббистов по поводу цен: обвиняйте других» . Нью-Йорк Таймс . Архивировано из оригинала 20 ноября 2020 года . Проверено 30 мая 2017 г.
- ^ Морган, Стивен Г.; Батула, Ханна С.; Луна, Суери (2020). «Ценообразование на фармацевтические препараты становится серьезной проблемой для систем здравоохранения» . БМЖ . 368 :l4627. дои : 10.1136/bmj.l4627 . ПМИД 31932289 . S2CID 210192662 . Архивировано из оригинала 27 ноября 2020 года . Проверено 14 ноября 2020 г.
- ^ «Высокие цены на лекарства и затраты пациентов: миллионы жизней и миллиарды потерянных долларов» . www.cidsa.org . Западный совет здравоохранения по информированному анализу расходов на лекарства. 18 ноября 2020 г. Проверено 20 февраля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б Голдакр, Бен (2014). Плохая фармацевтика: как фармацевтические компании вводят врачей в заблуждение и причиняют вред пациентам (Первое американское издание в мягкой обложке). Макмиллан. стр. 123–124. ISBN 9780865478060 .
- ^ «Архивная копия» (PDF) . Управление научно-технической политики . Архивировано (PDF) из оригинала 21 января 2017 года . Проверено 1 марта 2021 г. - из Национального архива .
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ «Финансовые преступления в публичном отчете за 2006 год» . ФБР. 2006. Архивировано из оригинала 29 мая 2016 года . Проверено 28 июля 2016 г.
- ^ «Мошенничество ФБР в сфере здравоохранения» . ФБР. Архивировано из оригинала 2 июля 2016 года . Проверено 28 июля 2016 г.
- ^ «Министерство юстиции» . Министерство юстиции. 19 марта 2015 года. Архивировано из оригинала 9 ноября 2014 года . Проверено 22 ноября 2020 г.
- ^ Уилсон, Дафф (2 октября 2010 г.). «Побочные эффекты могут включать судебные иски» . Нью-Йорк Таймс . Архивировано из оригинала 23 июня 2017 года . Проверено 25 февраля 2017 г. .
- ^ «ГлаксоСмитКлайн» . Новости Би-би-си . 4 июля 2012 г. Архивировано из оригинала 17 ноября 2020 г. . Проверено 21 июня 2018 г.
- ^ «GlaxoSmithKline соглашается выплатить 3 миллиарда долларов США в качестве компенсации за наркотики» . Блумберг . 2 июля 2012 года. Архивировано из оригинала 14 мая 2014 года . Проверено 11 марта 2017 г.
- ^ Могул, Фред (2 июля 2012 г.). «Нью-Йорк получит миллионы в поселении ГлаксоСмитКляйн» . ВНЙК . Архивировано из оригинала 19 апреля 2013 года . Проверено 2 июля 2012 года .
- ^ «BBC News – GlaxoSmithKline заплатит 3 миллиарда долларов за скандал с мошенничеством с наркотиками в США» . Би-би-си онлайн . 2 июля 2012 г. Архивировано из оригинала 17 ноября 2020 г. . Проверено 2 июля 2012 года .
- ^ Томас, Кэти и Шмидт, Майкл С. (2 июля 2012 г.). «Glaxo соглашается выплатить 3 миллиарда долларов в качестве компенсации за мошенничество» . Нью-Йорк Таймс . Архивировано из оригинала 2 марта 2017 года . Проверено 3 июля 2012 г.
- ^ «Резкое увеличение уголовных и гражданских наказаний в отношении фармацевтической промышленности: 1991-2010 гг.» . гражданин.орг . Архивировано из оригинала 16 мая 2016 года . Проверено 19 мая 2016 г.
- ^ Томас, Кэти; Шмидт, Майкл С. (2 июля 2012 г.). «GlaxoSmithKline соглашается выплатить 3 миллиарда долларов в качестве компенсации за мошенничество» . Нью-Йорк Таймс . Архивировано из оригинала 12 ноября 2020 года . Проверено 25 февраля 2017 г. .
- ^ «GlaxoSmithKline признает себя виновной и заплатит 3 миллиарда долларов для устранения обвинений в мошенничестве и непредоставлении данных о безопасности» . 2 июля 2012 года. Архивировано из оригинала 9 сентября 2014 года . Проверено 22 ноября 2020 г.
- ^ «ДЕПАРТАМЕНТ ЮСТИЦИИ ОБЪЯВЛЯЕТ КРУПНЕЙШЕЕ МОШЕННИЧЕСТВО В СФЕРЕ ЗДРАВООХРАНЕНИЯ» (PDF) . Министерство юстиции США. Архивировано (PDF) из оригинала 2 декабря 2020 г. Проверено 19 мая 2016 г.
- ^ «Abbott Labs заплатит 1,5 миллиарда долларов для завершения уголовных и гражданских расследований, связанных с продвижением препарата Депакот не по назначению» . 7 мая 2012 года. Архивировано из оригинала 21 августа 2014 года . Проверено 22 ноября 2020 г.
- ^ «№ 09-038: Эли Лилли и компания соглашаются выплатить 1,415 миллиарда долларов для разрешения обвинений в продвижении зипрекса не по назначению (15 января 2009 г.)» . Архивировано из оригинала 13 марта 2016 года . Проверено 22 ноября 2020 г.
- ^ Дразен, Джеффри М. (2015). «Возвращение к коммерческому и академическому интерфейсу» . Медицинский журнал Новой Англии . 372 (19): 1853–1854. дои : 10.1056/NEJMe1503623 . ПМИД 25946285 .
- ^ Розенбаум, Лиза (2015). «Восстановление связи — новая интерпретация отношений между промышленностью и врачом» . Медицинский журнал Новой Англии . 372 (19): 1860–1864. дои : 10.1056/NEJMms1502493 . ПМИД 25946288 .
- ^ «Лидеры вакцин против Covid: сколько они стоят, кто их купил и как они хранятся» . CNBC . 17 ноября 2020 года. Архивировано из оригинала 1 декабря 2020 года . Проверено 2 декабря 2020 г.
- ^ Хеннингер, Дэниел (2 декабря 2020 г.). «Мнение | Фармацевтика заслуживает Нобелевской премии мира за вакцины против Covid» . Уолл Стрит Джорнал . Архивировано из оригинала 3 февраля 2021 года . Проверено 4 декабря 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б «Никакой спекуляции на лекарствах и вакцинах от COVID-19, — говорит MSF» . Международная организация «Врачи без границ» (MSF) . Архивировано из оригинала 26 ноября 2021 года . Проверено 22 апреля 2020 г.
- ^ Маццукато, Мариана; Моменгалибоф, Аззи (18 марта 2020 г.). «Фармацевтические компании сделают убийства на коронавирусе» . Нью-Йорк Таймс . Архивировано из оригинала 23 ноября 2020 года . Проверено 22 апреля 2020 г.
- ^ «HHS и DOD сотрудничают с Regeneron в рамках крупномасштабного демонстрационного проекта по производству экспериментального терапевтического лечения COVID-19» . 6 июля 2020 года. Архивировано из оригинала 18 декабря 2020 года . Проверено 2 декабря 2020 г.
- ^ "COVID-19 прививки" . 12 декабря 2020 года. Архивировано из оригинала 19 декабря 2020 года . Проверено 2 декабря 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б Лупкин, Сидней (24 марта 2020 г.). «FDA предоставляет льготы по экспериментальным лекарствам от коронавируса для лечения редких заболеваний» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Архивировано из оригинала 14 декабря 2020 года . Проверено 24 марта 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с Конли, Джулия (24 марта 2020 г.). « Это масштабный скандал»: FDA Трампа предоставило фармацевтической компании эксклюзивную претензию на многообещающее лекарство от коронавируса» . Общие мечты . Архивировано из оригинала 8 декабря 2020 года . Проверено 22 апреля 2020 г.
- ^ Будман, Эрик (18 мая 2020 г.). «Компания Gilead увеличивает объем пожертвований препарата ремдесивир от Covid-19 для больниц США» . statnews.com . Архивировано из оригинала 20 декабря 2020 года . Проверено 19 июля 2020 г.
- ^ Лоусон, Алекс (25 марта 2020 г.). «Не позволяйте крупным фармацевтическим компаниям зарабатывать себе на жизнь, наживаясь на лечении COVID-19» . Общие мечты . Архивировано из оригинала 9 ноября 2020 года . Проверено 22 апреля 2020 г.
- ^ «Заявление компании Gilead Sciences о расширении глобальных поставок исследовательского противовирусного препарата Ремдесивир | Gilead» . Архивировано из оригинала 11 декабря 2020 года . Проверено 16 июля 2020 г.
- ^ См., например: 'т Хоэн, Эллен. «ТРИПС, фармацевтические патенты и доступ к основным лекарствам: долгий путь от Сиэтла до Дохи». Чикагский журнал международного права , 27(43), 2002 г.; Мусунгу, Сисуле Ф. и Сесилия О. «Использование гибких возможностей ТРИПС развивающимися странами: могут ли они обеспечить доступ к лекарствам?» Комиссия по правам интеллектуальной собственности, инновациям и общественному здравоохранению, Всемирная организация здравоохранения, 2005 г.
- ^ «Декларация о соглашении ТРИПС и общественном здравоохранении» . Всемирная торговая организация. Архивировано из оригинала 20 июня 2016 года . Проверено 19 мая 2016 г.
- ^ Ассоциация фармацевтических производителей против Президента Южной Африки (PMA) , 2002 г. (2) SA 674 (CC) (Южная Африка).
- ^ Хелфер, Лоуренс Р .; Остин, Грэм В. (7 марта 2011 г.). Права человека и интеллектуальная собственность: картирование глобального взаимодействия . Издательство Кембриджского университета. стр. 145–148. ISBN 978-1-139-49691-9 . Архивировано из оригинала 16 ноября 2020 года . Проверено 28 июля 2016 г.
- ^ «GlaxoSmithKline «откажется от патентов в бедных странах ради улучшения доступа к лекарствам» » . Новости Би-би-си . Архивировано из оригинала 9 ноября 2020 года . Проверено 19 мая 2016 г.
- ^ «Удачный год для корпоративных пожертвований раскрывает мотивы получения прибыли» . corpwatch.org . Архивировано из оригинала 11 ноября 2017 года . Проверено 24 февраля 2022 г.
- ^ «Мерк» . Архивировано из оригинала 26 августа 2006 года . Проверено 30 августа 2006 г.
- ^ «Pfizer пожертвует флуконазол Южной Африке» . Архивировано из оригинала 24 октября 2010 года . Проверено 30 августа 2006 г.
- ^ «Корпоративная ответственность: Новартис» . Novartis.com . Архивировано из оригинала 1 сентября 2017 года . Проверено 19 мая 2016 г.
Внешние ссылки [ править ]
 Цитаты, связанные с фармацевтической промышленностью , в Wikiquote
Цитаты, связанные с фармацевтической промышленностью , в Wikiquote - «Мировое использование лекарственных средств в 2020 году» . IMS Институт медицинской информатики . Ноябрь 2015.
- «Фармацевтическая промышленность и глобальное здравоохранение – факты и цифры, 2017 г.» (PDF) . Международная федерация фармацевтических производителей и ассоциаций . Февраль 2017.
- «Лицензионные соглашения в фармацевтической промышленности» .
- «Фармацевтическая промышленность в цифрах – ключевые данные 2018» (PDF) . Европейская федерация фармацевтической промышленности и ассоциаций .