Алосетрон
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Лотронекс |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а601230 |
| Маршруты администрация | Оральный ( таблетки ) |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 50–60% |
| Связывание с белками | 82% |
| Метаболизм | Печень (включая CYP2C9 , CYP3A4 и CYP1A2 ) |
| Период полувыведения | 1,5–1,7 часа |
| Экскреция | Почечный 73%, фекальный 24% |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
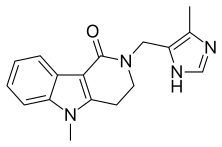
| Формула | С 17 Н 18 Н 4 О |
| Молярная масса | 294.358 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Алосетрон под торговой маркой Lotronex , продаваемый, среди прочего, 5-НТ3 , , представляет собой антагонист используемый для лечения тяжелого синдрома раздраженного кишечника (СРК) с преобладанием диареи (СРК) только у женщин.
Он был запатентован в 1987 году и одобрен для медицинского использования в 2002 году. [ 2 ] В настоящее время он продается компанией Prometheus Laboratories Inc. ( Сан-Диего ). Алосетрон был снят с рынка в 2000 году из-за возникновения серьезных опасных для жизни со стороны желудочно-кишечного тракта побочных эффектов , но был вновь представлен на рынке в 2002 году с ограничениями по доступности и использованию.
Медицинское использование
[ редактировать ]Алосетрон показан только женщинам с тяжелым синдромом раздраженного кишечника с преобладанием диареи (СРК-Д), у которых есть:
- хронические симптомы СРК (обычно длящиеся 6 месяцев или дольше),
- были исключены анатомические или биохимические отклонения желудочно-кишечного тракта, и
- не ответил адекватно на традиционную терапию.
Тяжелая форма СРК-Д включает диарею и 1 или более из следующих симптомов:
- частые и сильные боли/дискомфорт в животе,
- частые позывы к дефекации или недержание кала,
- инвалидность или ограничение повседневной деятельности из-за СРК. [ 3 ]
Эффективность
[ редактировать ]Исследование фазы III, подлежащее одобрению, было опубликовано в 2000 году как финансируемое промышленностью рандомизированное плацебо-контролируемое исследование (РСТ). Авторы исследования обнаружили, что прием 1 мг алосетрона перорально два раза в день в течение 12 недель был связан с улучшением на 12% (ДИ 4,7–19,2) облегчения боли и дискомфорта в животе, связанных с пациентами с преобладанием диареи. [ 4 ] В настоящее время в США разрешено назначение алосетрона в дозах 0,5 и 1 мг. [ 5 ]
В обзоре медицинского специалиста FDA от 4 ноября 1999 г. отмечалось: «Пациенты, которые, по мнению исследователей, соответствовали подтипу с преобладанием диареи, имели на исходном уровне... показатели консистенции стула, которые не были ни жидкими, ни водянистыми». [ 6 ] Консультативный комитет FDA по желудочно-кишечным препаратам назвал эффективность препарата «скромной», подчеркнув, что плацебо принесло облегчение по основному показателю результата у 40–50% женщин. [ 5 ]
Противопоказания
[ редактировать ]В брошюре с информацией о рецептах Лотронекса говорится, что алосетрон не следует назначать пациентам с запорами. Другими противопоказаниями являются: хронические или тяжелые запоры в анамнезе или последствия запоров; кишечная непроходимость, стриктура , токсический мегаколон , перфорация и/или спайки желудочно-кишечного тракта, ишемический колит , нарушение кишечного кровообращения, тромбофлебит или состояние гиперкоагуляции; болезнь Крона или язвенный колит ; дивертикулит ; тяжелая печеночная недостаточность. Одновременное применение флувоксамина также противопоказано. [ 3 ]
Побочные эффекты
[ редактировать ]Алосетрон был отменен в 2000 году после того, как алосетрон вызвал серьезные опасные для жизни побочные эффекты со стороны желудочно-кишечного тракта. Кумулятивная частота ишемического колита составила 2 на 1000, тогда как серьезные осложнения, возникающие вследствие запора (непроходимость, перфорация, закупорка , токсический мегаколон , вторичная ишемия толстой кишки , смерть ) - 1 на 1000. [ 3 ] Обзор 1999 года, проведенный медицинским сотрудником FDA Джоном Сеньором, показал, что 27% пациентов страдали запорами. [ 7 ] В исследовании III фазы сообщалось, что запор возникал у 30% и 3% пациентов в группах алосетрона и плацебо соответственно. Это было названо наиболее важной причиной выбывания пациентов из исследования. [ 4 ]
Механизм действия
[ редактировать ]Алосетрон оказывает антагонистическое действие на 5-НТ3 - рецепторы кишечной нервной системы желудочно-кишечного тракта. Хотя он является антагонистом 5-HT3 , как ондансетрон , он не классифицируется и не одобрен как противорвотное средство. Поскольку стимуляция 5-НТ3 - рецепторов положительно коррелирует с моторикой желудочно-кишечного тракта, антагонизм алосетрона к 5-НТ3 замедляет движение фекалий через толстую кишку, увеличивая степень всасывания воды и уменьшая влажность и объем оставшейся жидкости. отходы. [ 3 ]
История
[ редактировать ]Алосетрон был первоначально одобрен Управлением по контролю за продуктами и лекарствами США (FDA) 9 февраля 2000 г. [ 8 ] после семимесячного обзора. [ 9 ] На момент первоначального одобрения рецензенты Управления по контролю за продуктами и лекарствами США (FDA) обнаружили, что алосетрон улучшил симптомы у 10–20% пациентов. [ 10 ]
Поставки в аптеки начались в марте 2000 года. 17 июля медицинский работник подал в FDA отчет о смерти 50-летней женщины, перенесшей мезентериальную ишемию . В отчете алосетрон назван «главным подозреваемым» в смерти. [ 7 ]
Компания GlaxoWellcome добровольно отозвала алосетрон с рынка 28 ноября 2000 г. из-за возникновения серьезных опасных для жизни со стороны желудочно-кишечного тракта , включая 5 смертей и дополнительные операции на кишечнике. побочных эффектов [ 9 ] FDA сообщило, что у него есть сообщения о 49 случаях ишемического колита и 21 случае «тяжелого запора», а также о том, что десять из 70 пациентов перенесли операции, а еще 34 были обследованы в больницах и выписаны без хирургического вмешательства. К 17 ноября 2000 г. фармацевты выписали 474 115 рецептов на алосетрон. [ 9 ] Продолжали поступать сообщения о тяжелых нежелательных явлениях: в общей сложности было зарегистрировано 84 случая ишемического колита, 113 случаев тяжелого запора, 143 случая госпитализации и 7 случаев смерти. [ 11 ]
Группы защиты интересов пациентов, в первую очередь Группа действий Лотронекса и Международный фонд функциональных желудочно-кишечных расстройств (IFFGD), лоббировали возвращение препарата. Группа исследований общественного здоровья граждан, еще одна группа по защите интересов пациентов, выступила против повторного введения. [ 12 ] [ 5 ]
7 июня 2002 г. FDA объявило об одобрении дополнительной заявки на новое лекарственное средство (sNDA), которая разрешает ограниченный маркетинг Лотронекса (алосетрона гидрохлорида) для лечения только женщин с тяжелым синдромом раздраженного кишечника с преобладанием диареи (СРК). [ 3 ] [ 13 ] [ 14 ] Строгие правила выписывания рецептов, первоначально введенные в 2002 году, были немного смягчены в 2016 году, что позволило, помимо других преимуществ, выписывать электронные рецепты.
Неизвестно, был ли алосетрон подан на регистрацию в ЕС .
GSK продала Lotronex калифорнийской корпорации Prometheus в конце 2007 года. [ 15 ]
С 2015 года дженерики алосетрона доступны в США и продаются рядом различных компаний, включая Actavis Pharma Company, Prometheus Laboratories и Sebela Pharmaceuticals Inc.
Критика FDA
[ редактировать ]В 2001 году редактор известного медицинского журнала The Lancet Ричард Хортон раскритиковал обращение FDA с алосетроном в необычайно резкой форме. [ 16 ] Хортон утверждал, что лечение несмертельного заболевания не оправдывает использование препарата с потенциально смертельными побочными эффектами и что FDA следовало отозвать одобрение алосетрона раньше, когда пострегистрационный надзор показал, что многие пациенты страдали запорами, требующими хирургического вмешательства. и ишемический колит. Он утверждал, что должностные лица FDA были ненадлежащим образом заинтересованы в сохранении и восстановлении разрешения на алосетрон из-за того, что Центр оценки и исследования лекарств FDA финансируется за счет сборов с пользователей, выплачиваемых фармацевтическими производителями, и что восстановление алосетрона обсуждалось конфиденциально. встречи с представителями GlaxoSmithKline .
В статье, опубликованной в Британском медицинском журнале (BMJ), отмечалось: «Разрешив продажу алосетрона, препарата, который по своим собственным условиям представляет серьезную и значительную проблему для общественного здравоохранения, FDA провалило свою миссию». [ 17 ] Другие утверждали, что процесс утверждения Lotronex был примером захвата регулирующих органов . [ 5 ]
Ссылки
[ редактировать ]- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»)» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ Фишер Дж., Ганеллин С.Р. (2006). Открытие аналоговых лекарств . Джон Уайли и сыновья. п. 448. ИСБН 9783527607495 .
- ^ Jump up to: а б с д и «Таблетки Лотронекса (алосетрона гидрохлорида). Полная информация по назначению» (PDF) . Prometheus Laboratories Inc., 9410 Carroll Park Drive, Сан-Диего, Калифорния 92121. Архивировано из оригинала (PDF) 22 февраля 2016 года . Проверено 14 февраля 2016 г.
- ^ Jump up to: а б Камиллери М., Норткатт А.Р., Конг С., Дьюкс Дж.Е., МакСорли Д., Мангель А.В. (март 2000 г.). «Эффективность и безопасность алосетрона у женщин с синдромом раздраженного кишечника: рандомизированное плацебо-контролируемое исследование». Ланцет . 355 (9209): 1035–40. дои : 10.1016/S0140-6736(00)02033-X . ПМИД 10744088 . S2CID 31290668 .
- ^ Jump up to: а б с д Мойнихан Р. (сентябрь 2002 г.). «Алосетрон: пример захвата регулирующих органов или победа прав пациентов?» . БМЖ . 325 (7364): 592–5. дои : 10.1136/bmj.325.7364.592 . ПМК 1124108 . ПМИД 12228140 .
- ^ Барбегенн Э., Лурье П., Вулф С.М. (декабрь 2000 г.). «Алосетрон при синдроме раздраженного кишечника» . Ланцет . 356 (9246): 2009–10. дои : 10.1016/S0140-6736(05)72978-0 . ПМИД 11130544 . S2CID 30340322 .
- ^ Jump up to: а б Уиллман Д. (2 ноября 2000 г.). «FDA свело к минимуму проблему безопасности Lotronex» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 г.
- ^ Управление по контролю за продуктами и лекарствами США. «Подробности о лекарствах» . Проверено 11 декабря 2012 г.
- ^ Jump up to: а б с Уиллман Д. (29 ноября 2000 г.). «Препарат Лотронекс преодолел опасения по поводу безопасности» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 г.
- ^ Уиллман Д. (20 декабря 2000 г.). «Офицер предвидел смертельные последствия» . Лос-Анджелес Таймс . Проверено 11 декабря 2012 г.
- ^ Центр оценки и исследований лекарств (23 апреля 2002 г.). «Консультативный комитет по желудочно-кишечным препаратам и Подкомитет по безопасности лекарств и управлению рисками Консультативного комитета по фармацевтической науке» (PDF) . Управление по контролю за продуктами и лекарствами США . Проверено 11 декабря 2012 г.
- ^ Грейди Д. (23 апреля 2002 г.). «Апелляции побуждают Агентство США рассмотреть вопрос о разрешении продажи лекарств от диареи, связанных со смертностью» . Нью-Йорк Таймс . Проверено 11 декабря 2012 г.
- ^ Поллак А (9 марта 2006 г.). «Комиссия FDA рекомендует препарат от рассеянного склероза, несмотря на смертельный риск» . Нью-Йорк Таймс . Проверено 13 марта 2008 г.
- ^ Грейди Д. (8 июня 2002 г.). «США позволяют наркотикам, связанным со смертностью, вернуться на рынок» . Нью-Йорк Таймс . Проверено 11 декабря 2012 г.
- ^ «Прометей приобретает Лотронекс® у GlaxoSmithKline» . Пресс-релиз . Prometheus Laboratories Inc., 7 ноября 2007 г. Архивировано из оригинала 14 июля 2012 г. Проверено 27 августа 2008 г.
- ^ Хортон Р. (май 2001 г.). «Lotronex и FDA: фатальная эрозия честности». Ланцет . 357 (9268): 1544–5. дои : 10.1016/S0140-6736(00)04776-0 . ПМИД 11377636 . S2CID 10886502 .
- ^ Льевр М. (сентябрь 2002 г.). «Алосетрон при синдроме раздраженного кишечника» . БМЖ . 325 (7364): 555–6. дои : 10.1136/bmj.325.7364.555 . ПМК 1124090 . ПМИД 12228116 .