Аминорекс
 | |
 | |
| Клинические данные | |
|---|---|
| код АТС |
|
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.164.420 |
| Химические и физические данные | |
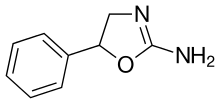
| Формула | С 9 Н 10 Н 2 О |
| Молярная масса | 162.192 g·mol −1 |
| 3D model ( JSmol ) | |
| Хиральность | Рацемическая смесь |
| (проверять) | |
Аминорекс ( меноцил , апикель , аминоксафен , аминоксафен , McN-742 ) является потерю веса ( аноректическим ) , стимулирующим препаратом . Он был снят с продажи после того, как было обнаружено, что он вызывает легочную гипертензию . [2] В США это незаконный препарат из Списка I , что означает высокий потенциал злоупотребления, неприемлемое медицинское применение и плохой профиль безопасности.
Аминорекс, относящийся к классу 2-амино-5-арилоксазолинов, был разработан McNeil Laboratories в 1962 году. [3] Он тесно связан с 4-метиламинорексом . Было показано, что аминорекс оказывает стимулирующее локомоторное действие, занимая промежуточное положение между декстроамфетамином и метамфетамином . Эффекты аминорекса объясняются высвобождением катехоламинов . [4] Его можно производить в виде метаболита лекарства от глистов левамизола , который иногда используется в качестве разжижающего вещества незаконно производимого кокаина . [5] [6]
Фармакология
[ редактировать ]Было обнаружено, что аминорекс действует как ингибитор обратного захвата переносчиков дофамина и норадреналина, обладая свойствами высвобождающего агента на переносчике серотонина. [7]
История
[ редактировать ]Он был открыт в 1962 году Эдвардом Джоном Херлбертом . [8] и в 1963 году было быстро обнаружено его аноректическое действие на крыс . Он был представлен в качестве рецептурного средства для подавления аппетита в Германии , Швейцарии и Австрии в 1965 году, но был отменен в 1972 году после того, как было обнаружено, что он вызывает легочную гипертензию примерно у 0,2% пациентов и был связан с рядом смертей. [4] [9]
Синтез
[ редактировать ]Впервые о синтезе было сообщено в исследовании взаимосвязи структура-активность 2-амино-5-арил-2-оксазолинов, где было обнаружено, что аминорекс примерно в 2,5 раза более эффективен, чем сульфат D -амфетамина, в индукции анорексии у крыс, а также был Сообщается, что он оказывает стимулирующее действие на ЦНС.
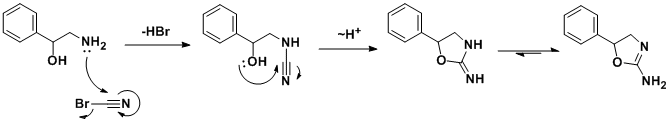
Рацемический синтез включает реакцию присоединения/циклизации 2-амино - 1-фенилэтанола с бромидом циана . [10] Подобный синтез также был опубликован. [11] В поисках более дешевого синтетического маршрута немецкая команда разработала альтернативный маршрут. [12] что за счет использования хирального оксида стирола позволяет получать энантиочистый продукт.
См. также
[ редактировать ]- 4-Метиламинорекс
- Кломинорекс
- Циклазодон
- Фенозолон
- Флюминорекс
- Пемолина
- Тозалинон
- Список аналогов аминорекса
Ссылки
[ редактировать ]- ^ Анвиса (31 марта 2023 г.). «НДК № 784 – Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» [Постановление Коллегии № 784 – Списки наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» (на бразильском португальском языке). Официальный вестник Союза (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 03 августа 2023 г. Проверено 16 августа 2023 г.
- ^ Гейн С.П., Рубин Л.Дж., Кметцо Дж.Дж., Палевский Х.И., Трейл Т.А. (ноябрь 2000 г.). «Рекреационное применение аминорекса и легочная гипертензия» . Грудь . 118 (5): 1496–1497. дои : 10.1378/сундук.118.5.1496 . ПМИД 11083709 . Архивировано из оригинала 12 января 2013 г.
- ^ США 3161650 , Ирландия PG, «2-амино-5-арилоксазолиновые продукты», выданный 15 декабря 1964 г., передан компании Janssen Pharmaceuticals Inc.
- ^ Jump up to: а б Фишман А.П. (январь 1991 г.). «От аминорекса до фена/фена: предсказанная эпидемия» . Тираж . 99 (1): 156–161. дои : 10.1161/01.CIR.99.1.156 . ПМИД 9884392 .
- ^ Хо ЭН, Люнг Д.К., Люнг Г.Н., Ван Т.С., Вонг А.С., Вонг Ч.Х. и др. (апрель 2009 г.). «Аминорекс и рексамино как метаболиты левамизола у лошадей». Аналитика Химика Акта . 638 (1): 58–68. Бибкод : 2009AcAC..638...58H . дои : 10.1016/j.aca.2009.02.033 . ПМИД 19298880 .
- ^ Бертол Э, Мари Ф, Милия МГ, Полити Л, Фурланетто С, Карч СБ (июль 2011 г.). «Определение аминорекса в образцах мочи человека методом ГХ-МС после применения левамизола». Журнал фармацевтического и биомедицинского анализа . 55 (5): 1186–1189. дои : 10.1016/j.jpba.2011.03.039 . ПМИД 21531521 .
- ^ Хофмайер Т., Луф А., Седдик А., Стокнер Т., Холи М., Фрейссмут М. и др. (июль 2014 г.). «Аминорекс, метаболит левамизола, примеси кокаина, оказывает амфетаминоподобное действие на переносчики моноаминов» . Нейрохимия Интернэшнл . 73 (100): 32–41. дои : 10.1016/j.neuint.2013.11.010 . ПМК 4077236 . ПМИД 24296074 .
- ^ Патент США 3115494 , Albert MG, Ирландия PG, «2-амино-5,6-дигидро-4ii-1,3-оксазины и способ их получения», выдан 2 декабря 1963 г., передан компании Janssen Pharmaceuticals Inc.
- ^ Вейгл Д.С. (июнь 2003 г.). «Фармакологическая терапия ожирения: прошлое, настоящее и будущее» . Журнал клинической эндокринологии и метаболизма . 88 (6): 2462–2469. дои : 10.1210/jc.2003-030151 . ПМИД 12788841 .
- ^ Пус Г.И., Карсон-младший, Розенау Дж.Д., Рошковски А.П., Келли Н.М., Макговин Дж. (май 1963 г.). «2-амино-5-арил-2-оксазолины. Новые мощные аноректические средства». Журнал медицинской химии . 6 (3): 266–272. дои : 10.1021/jm00339a011 . ПМИД 14185981 .
- ^ Уэда С., Тераучи Х., Яно А., Идо М., Мацумото М., Кавасаки М. (январь 2004 г.). «Производные 4,5-дизамещенного-1,3-оксазолидин-2-имина: новый класс биодоступных перорально ингибиторов синтазы оксида азота». Письма по биоорганической и медицинской химии . 14 (2): 313–316. дои : 10.1016/j.bmcl.2003.11.010 . ПМИД 14698148 .
- ^ DE 2101424 , «Препарат 2-амино-5-фенил-2-оксазолина», присвоен Институту органической химии Польской академии наук, Варшау.