5-HT 2C Агонист рецептора
5-HT 2C Агонисты рецепторов представляют собой класс препаратов, которые активируют 5-HT 2C рецепторы . Их исследовали для лечения ряда заболеваний, включая ожирение , психические расстройства , сексуальную дисфункцию и недержание мочи . [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ]
Рецепторы 5-HT 2C являются одним из трех подтипов, которые принадлежат к подсемейству рецепторов серотонина 5-HT 2 наряду с 5-HT 2A и 5-HT 2B рецепторами . Разработка агонистов 5-HT 2C была серьезным препятствием из-за серьезных побочных эффектов из-за отсутствия селективности в отношении рецепторов 5-HT 2A и 5-HT 2B . Активация рецепторов 5-HT 2A может вызывать галлюцинации, а активация рецепторов 5-HT 2B связана с недостаточностью сердечного клапана и, возможно, с легочной гипертензией. [ 6 ] [ 7 ]
Открытие
[ редактировать ]В конце 1960-х годов неселективные антагонисты рецепторов серотонина продемонстрировали связь между рецепторами серотонина и потреблением пищи. Позже исследования на животных показали, что агонисты рецепторов серотонина могут выступать в качестве медиаторов насыщения. [ 8 ] Серотонин играет решающую роль в краткосрочной регуляции потребления пищи и способствует потере веса, связанной с гиперфагией . [ 9 ] Исследования с использованием фармакологических и генетических инструментов показали, что подтип рецептора 5-HT 2C является одним из основных медиаторов, посредством которых серотонин оказывает аноректическое действие на грызунов. Впоследствии эти рецепторы стали многообещающей фармакотерапевтической мишенью для дальнейших исследований в области лечения ожирения. [ 10 ] Разработка 5-HT 2C рецептора мышей с нокаутом в середине 1990-х годов стала выдающимся достижением в идентификации и разработке серотонинергических препаратов для снижения веса. Эти нокаутные мыши были гиперфагами , что приводило к ожирению, частичной резистентности к лептину , повышенному отложению жира, резистентности к инсулину и нарушению толерантности к глюкозе. В результате этих симптомов исследователи определили функциональную роль рецепторов в серотонинергической регуляции потребления пищи и массы тела. [ 7 ] [ 11 ] Позже рецепторы 5-HT2C были предложены в качестве терапевтической мишени для лечения множественных заболеваний центральной нервной системы (ЦНС), включая: психические расстройства, ожирение, сексуальную дисфункцию и недержание мочи. [ 9 ]
История
[ редактировать ]Агонист рецептора 5-HT2c фенфлурамин (рыночные названия Пондимин, Пондеракс и Адифакс) был открыт в 1972 году в результате исследований, проведенных с целью выявления аноректических соединений, лишенных эффектов психостимуляторов и симпатомиметиков (таких как амфетамины). До открытия фенфлурамина амфетамины были основной формой доступных аноректических препаратов, однако побочные эффекты затрудняли их использование. Аноректический эффект фенфлурамина достигается за счет повышения уровня серотонина, придающего ощущение сытости, что приводит к меньшему потреблению пищи. Фенфлурамин продавался в виде рацемической смеси двух энантиомеров , дексфенфлурамина и левофенфлурамина . [ 12 ] [ 13 ]
В 1994 году продажи комбинированного препарата Фен-фен ( фенфлурамин и фентермин ) резко возросли, поскольку эта комбинация дала существенный и очевидный синергический эффект в снижении веса. Впоследствии сообщения о тяжелых побочных эффектах, связанных с аномалиями сердечного клапана, и повышенном риске легочной гипертензии привели к решению убрать продукты, содержащие фенфлурамин, с рынка США, а затем и с других рынков по всему миру. [ 14 ] [ 15 ] [ 16 ]
Дексфенфлурамин ингибирует обратный захват серотонина , стимулируя высвобождение серотонина. В 1996 году дексфенфлурамин стал первым препаратом для длительного лечения ожирения, одобренным в США; Побочные эффекты, наблюдавшиеся во время клинических испытаний, включали сухость во рту, диарею и сонливость. В середине 1990-х годов FDA США одобрило дексфенфлурамин в качестве препарата для снижения веса. После нескольких сообщений о побочных эффектах на сердечно-сосудистую систему FDA запретило дексфенфлурамин в 1997 году. [ 12 ] [ 17 ] [ 18 ]
Похоже, что рецепторы 5-HT2B , экспрессируемые в сердечных клапанах, ответственны за вальвулопатии, о которых сообщалось при использовании фенфлурамина и дексфенфлурамина. [ 19 ]
Агонист серотониновых рецепторов mCPP обладает значительным сродством к 5-HT2C - рецепторам. Пациенты с mCPP испытывают множественные побочные эффекты из-за неселективности в отношении рецепторов 5-HT 2A и 5-HT 2B . Отсутствие гипофагического (снижения потребления пищи) эффекта mCPP у мышей с нокаутом рецептора 5-HT 2C позволяет предположить, что этот эффект опосредован активацией рецептора 5-HT 2C . Повторное введение mCPP людям может привести к снижению потребления пищи и потере веса. mCPP используется в качестве исследовательского инструмента-прототипа для открытия лекарств селективных агонистов рецептора 5-HT 2C . [ 20 ] [ 21 ] [ 22 ]
Механизм действия
[ редактировать ]Этот раздел может быть слишком техническим для понимания большинства читателей . ( январь 2016 г. ) |

Рецепторы 5-HT2C представляют собой рецепторы, связанные с G-белком , которые связаны с фосфолипазой C (PLC) через Gαq , фосфолипазу A2 (PLA2) и, возможно, Gα13. PLC метаболизирует фосфатидилинозитол-4,5-бисфосфат в инозитол-1,4,5-трифосфат (IP3). IP3 регулирует клеточный Ca 2+ поток путем связывания с рецепторами IP3, вызывая высвобождение Ca2+. Кроме того, активация PLA2 также приводит к задействованию пути RhoA/PLD посредством RhoA , фермента, который регулирует широкий спектр клеточных функций посредством целевого белка PLD ( фосфолипазы D ). Рецепторы 5-HT2C могут также стимулировать путь киназы, регулируемой внеклеточным сигналом (ERK), который активируется нейротрофинами и другими нейроактивными химическими веществами. Производство этих химических веществ влияет на дифференцировку нейронов, выживаемость, регенерацию , а также структурную и функциональную пластичность . Ранние исследования пути ERK показали, что стабилизаторы настроения для лечения маниакально-депрессивного заболевания стимулируют этот путь. Это привело к пониманию того, что стимуляция 5-HT2C - рецепторов может регулировать маниакально-депрессивные состояния аналогично стабилизаторам настроения. [ 23 ] [ 24 ] [ 25 ] [ 3 ]
Рецепторы 5-HT2C расположены только в ЦНС, где их можно найти в нескольких местах. Самая высокая плотность экспрессии рецепторов наблюдается в сосудистом сплетении . Другие области мозга включают ядро одиночного тракта , дорсомедиальный гипоталамус , паравентрикулярное ядро гипоталамуса и миндалевидное тело , все из которых связаны с регуляцией потребления пищи. Такая картина распределения может объяснить влияние, которое они оказывают на интегральную функцию контроля многих физиологических и поведенческих реакций, таких как питание, тревога, регулирование температуры, передвижение , сексуальное поведение и возникновение судорог. [ 26 ] [ 27 ]
Связывание
[ редактировать ]Рецепторы 5-HT 2C и связывание лиганда
[ редактировать ]
5-HT2 представляют Рецепторы собой рецепторы, связанные с G-белком , которые могут регулировать клеточную передачу сигналов в отсутствие лиганда . Это можно объяснить с помощью модели двух состояний (рис. 2), где рецептор находится в равновесии между двумя состояниями: активным (R*) и неактивным (R). Базальная эффекторная активность частично определяется абсолютным уровнем (R*), который будет увеличиваться с увеличением плотности рецепторов. Лиганды, которые преимущественно связываются и стабилизируют состояние R, называются обратными агонистами и снижают эффекторную активность. Агонисты преимущественно связываются с состоянием R* и стабилизируют его, тем самым увеличивая эффекторную активность. Нейтральные антагонисты проявляют одинаковое сродство к обеим конформациям и не нарушают равновесия между двумя состояниями, однако они занимают рецептор и могут блокировать действие как агонистов, так и обратных агонистов. [ 28 ] [ 29 ]
Рецепторы 5-HT 2C и 5-HT 2A имеют сходную гомологию аминокислотных последовательностей , с ~50% общей идентичностью последовательностей и ~80% внутри TM-доменов, что приводит к сходному фармакологическому профилю для двух рецепторов. Оба рецептора соединяют одни и те же пути передачи клеточного сигнала, PLC и PLA2, которые приводят к накоплению инозитолфосфата и кальция. 2+ внутри постсинаптической клетки . [ 28 ]
Рецепторы 5-HT 2C являются единственными рецепторами, связанными с G-белком, которые, как известно, подвергаются посттранскрипционному процессу редактирования РНК. Ген рецептора 5-HT2C находится на Х-хромосоме Xq24. Этот генный продукт подвергается процессу редактирования РНК, приводящему к снижению аффинности связывания агониста, однако связывание антагониста остается неизменным. Этот процесс редактирования РНК генерирует 14 уникальных изоформ рецептора 5-HT2C, которые различаются тремя аминокислотами во второй внутриклеточной петле. [ 28 ] [ 30 ]
Связывание серотонина с 5-HT 2C
[ редактировать ]Серотонин является эндогенным неселективным агонистом рецептора 5-НТ 2С с константой связывания K i = 16,0 нМ. Когда серотонин связывается с рецепторами, наиболее важные контакты происходят в спиралях ТМ 3, 5 и 6 (рис. 3), тогда как остальные четыре спирали ТМ не взаимодействуют напрямую с соединением серотонина. При связывании серотонина протонированный первичный аминный центр образует солевой мостик с остатком D134 в ТМ 3, а также образует водородную связь с остатком S138 в ТМ 3. Ароматическое индольное кольцо образует сильное ван-дер-ваальсово взаимодействие с остатками. F223 в TM 5 и F328 в TM 6. Кольцо плотно прилегает к рецепторному карману, расположенному между двумя фенилаланинами . Амин индольной группы образует водородную связь с остатком S219 в ТМ 5, а гидроксидный заместитель индола образует водородные связи как с остатком S131 в ТМ 3, так и с I332 в ТМ 6. Между индолом и I332 в ТМ 6. [ 31 ]

Фармакофор
[ редактировать ]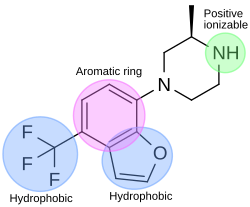
В процессе разработки лекарственного средства 5-HT 2C агониста фармакофорный модуль использовался для обнаружения новых лигандов рецептора 5-HT 2C . Фармакофор имеет четыре особенности; одно ароматическое кольцо, два гидрофобных элемента и один положительный ионизирующий элемент. На рисунке 4 показан пример соединения , которое идеально соответствует фармакофору-агонисту. Атом азота пиперазина соответствует положительному ионизирующему признаку, бензофурановая часть соответствует ароматическому кольцу и одному гидрофобному кольцу, а трифторметановая часть соответствует другому гидрофобному свойству фармакофора. [ 32 ]
Отношения структура-деятельность
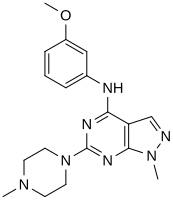
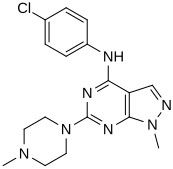
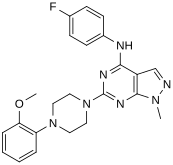
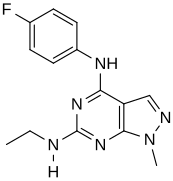
[ редактировать ]При виртуальном скрининге новых агонистов взаимосвязь структура-активность определялась на основе наиболее мощных идентифицированных соединений («хитов»). [ нужны разъяснения ] Эти удары содержали пиразоло[3,4-d]пиримидиновое ядро (показано на рисунке 5), которое важно для эффективности в отношении рецепторов 5- HT2C . Соединения с максимальной эффективностью имели два заместителя, связанных с основной структурой. Первый заместитель представляет собой пиперазиновое кольцо, содержащее небольшую гидрофобную группу; второй заместитель представляет собой фенильную часть, содержащую галоген- и/или кислородсодержащую боковую цепь (электроотрицательные группы), см. производные 1 и 2 на рисунке 5. Добавление ароматических групп к пиперазиновому кольцу снижает активность (производное 4 на рисунке 5). а отсутствие пиперазинового кольца или замена другими алифатическими или циклическими группами также снижает эффективность (производные 5 и 6 на фигуре 5). [ 32 ]

Ряд производных 3-бензазепина, таких как лорказерин (рис. 6), были оценены на предмет их активности и селективности в отношении 5-HT2C - рецепторов. Лоркасерин является очень сильным агонистом, но его эффективность зависит от присутствия хлорзаместителя в положении 8. [ 7 ] [ 33 ] [ 34 ]
Соединения, содержащие арилпиперазин, такие как mCPP (рис. 7), проявляют хорошую активность в отношении 5-HT 2C- рецепторов, но не обладают достаточной селективностью в отношении 5-HT 2C- рецепторов по сравнению с двумя другими подтипами рецепторов. Многие производные были исследованы в попытке повысить селективность. Производные, лишенные ядра арилпиперазина, такие как аналоги хлора 4-арил-1,2,3,6-тетрагидропиридина, более благоприятны по активности и селективности по сравнению с двумя другими рецепторами (рис. 7). [ 35 ]
Функциональная избирательность
[ редактировать ]В 2016 году было опубликовано открытие новых ориентированных на G-белок . 5-HT2C , агонистов рецептора [ 36 ]
Разработка лекарств
[ редактировать ]Ожирение
[ редактировать ]Ожирение является глобальной эпидемической проблемой здравоохранения, и ему уделяется значительное внимание как серьезной общественной опасности. Ожирение – это хроническое патологическое и дорогостоящее заболевание, связанное с аномальным или чрезмерным накоплением жира в организме. [ 37 ]
Исследования показывают, что активация рецептора 5-HT 2C будет регулировать аппетит и потребление пищи, скорее всего, путем содействия насыщению посредством подавления аппетита за счет активации 5-HT 2C . селективные агенты с высоким сродством к этому рецептору по сравнению с 5-НТ2В и 5-НТ22А . Следовательно, для лечения ожирения разрабатываются [ 38 ] [ 6 ]
Пумосетраг был примером, поданным Mitsubishi Chemical Corporation .
Лоркасерин
[ редактировать ]Лорказерин — единственный препарат, прошедший III фазу клинических испытаний и получивший одобрение Управления по контролю за продуктами и лекарствами США (FDA). Однако позже, в феврале 2020 года, он был снят с продажи из-за более высокого риска злокачественного новообразования в рандомизированном исследовании лорказерина. [ 39 ] Ранее одобренные агенты впоследствии были удалены с рынка США. [ 6 ]
Лорказерин является полным агонистом рецепторов 5-HT 2C и 5-HT 2B и частичным агонистом рецепторов 5-HT 2A (75% максимального ответа, вызываемого серотонином). [ 7 ] Лоркасерин является мощным и селективным агонистом 5-НТ 2С с быстрой абсорбцией при пероральном приеме, что приводит к дозозависимому снижению потребления пищи и массы тела. Лоркасерин влияет на массу тела, создавая отрицательный энергетический баланс за счет снижения потребления пищи (потребления энергии) без изменений в расходе энергии и окислении субстрата . [ 11 ] Лоркасерин обладает высоким сродством к рецепторам 5-HT 2C , с 18-кратной селективностью по отношению к рецепторам 5-HT 2A и в 104 раза по отношению к рецепторам 5-HT 2B . [ 7 ] Прогнозируемая концентрация в крови для стимуляции рецепторов 2A и 2B примерно в 1400 раз для 2B и в 250 раз для 2A, что превышает концентрацию в крови, необходимую для стимуляции рецепторов 2C. Эта функциональная селективность имеет решающее значение для предотвращения потенциальных побочных эффектов и предполагает, что теоретический риск сердечной вальвулопатии очень низок. Клинические испытания подтвердили эту теорию, поскольку они не выявили каких-либо побочных эффектов на сердечные клапаны или давление в легочной артерии, как предыдущие лекарства от ожирения. Лоркасерин в целом хорошо переносится, но наиболее частыми побочными эффектами являются головная боль, тошнота и головокружение. [ 7 ] [ 11 ]
Психические расстройства
[ редактировать ]Серотонин играет важную роль во многих физиологических состояниях. Антагонисты 5-HT2 - рецепторов известны давно, но в последнее время агонисты 5-HT2 - рецепторов становятся многообещающими агентами при разработке новых антипсихотических препаратов . Исторически сложилось так, что большинство фармакологических исследований антипсихотических препаратов концентрировались на подтипе рецепторов 5- HT2A . Однако недавние исследования показывают, что агонистическая активность рецепторов 5-НТ 2А может вызывать галлюцинации. Сравнение СИОЗС и агонистов рецептора 5-HT2C показало , что агонисты уменьшали время неподвижности и увеличивали время плавания в FST ( тест принудительного плавания ) у крыс аналогично СИОЗС. В 1990-е годы рецепторам 5-HT 2C уделялось больше внимания, поскольку многие исследования показали, что селективные агонисты рецепторов 5-HT 2C могут более подходить для лечения психотических состояний. [ 40 ] [ 41 ]
Можно ожидать, что агонист 5-HT2C уменьшит положительные симптомы шизофрении за счет уменьшения высвобождения дофамина в мезолимбическом пути дофамина . Вабикасерин (SCA-136) — агонист 5-HT 2C , который в предварительных испытаниях показал себя перспективным для лечения шизофрении. [ 42 ]
Вабикасерин и арипипразол
[ редактировать ]Вабиказерин обладает высоким сродством к рецепторам 5-HT 2C и низким сродством к рецепторам 5-HT 2B и 5-HT 2A . Вабиказерин является полным агонистом с примерно в 4 раза большей селективностью в отношении 5-HT 2C по сравнению с родственными рецепторами с точки зрения аффинности связывания. Вабикаксерин является полным агонистом стимуляции рецептора 5- HT2C ; это было обнаружено, когда класс диазепинов , слитых с тетрагидрохинолином , исследовался в качестве возможных мощных агонистов 5-HT 2C рецепторов. [ 43 ]
По состоянию на 2012 год вабикасерин проходит клинические испытания для лечения шизофрении. Длительное введение вабиказерина значительно уменьшало количество спонтанно активных мезокортиколимбических дофаминовых нейронов, не затрагивая нигростриарные дофаминовые нейроны, что согласуется с эффектами атипичных антипсихотических препаратов. Результаты клинических исследований вабиказерина могут показать, могут ли 5-HT2C - рецепторы быть возможными мишенями для лечения шизофрении. [ 44 ]
Арипипразол также является мягким частичным агонистом рецептора 5HT2C .
Сексуальная дисфункция
[ редактировать ]активация подтипа рецептора 5-HT 2C опосредует многочисленные эффекты, такие как эрекция полового члена. Сообщалось, что [ 45 ] [ 46 ] Результаты многочисленных исследований показывают, что несколько 5-HT 2C агонистов рецептора , включая mCPP и YM348, вызывают эрекцию полового члена у крыс. [ 47 ] но mCPP, похоже, имитирует как вазодилатацию , так и вазоконстрикцию . Вазодилататорное действие опосредовано 5-НТ 1D- рецепторами, тогда как вазоконстрикторный эффект включает активацию 5-НТ 2 -рецепторов. [ 48 ] YM-348 является высокоселективным агонистом 5-HT 2C , и результаты показывают, что YM348 может индуцировать эрекцию полового члена и гиполокомоцию (индуцированную при высоких дозах) у крыс, как и другие 5-HT 2C агонисты рецептора. Эти эффекты были полностью ингибированы селективным антагонистом рецептора 5-HT2C , SB -242,084 . Таким образом, результаты показывают, что YM348 является мощным и активным при пероральном приеме агонистом рецептора 5- HT2C . [ 49 ] [ 50 ]
Недержание мочи
[ редактировать ]Серотонин играет ключевую роль в механизмах мочеиспускания и воздержания. Многие сильнодействующие соединения с высокой селективностью в отношении 5-HT2C - рецепторов были синтезированы и являются многообещающими кандидатами для дальнейшей разработки для лечения стрессового недержания мочи (СНМ). [ 50 ]
Текущий статус
[ редактировать ]Многие экзогенные агенты были разработаны после открытия рецепторов 5-HT 2C . небольшое количество агонистов с достаточной селективностью в отношении рецепторов 5-HT 2C К настоящему времени в клинических испытаниях изучено по сравнению с другими подтипами. Ряд других доклинической агонистов рецептора 5-HT2C все еще находится в стадии разработки , включая Ro60-0175 , WAY-163,909 и обратный агонист SB-243,213 . Имеющиеся данные подтверждают терапевтический потенциал модуляции рецептора 5-HT2C при лечении различных патологических состояний, включая шизофрению, ожирение, недержание мочи и сексуальную дисфункцию. [ 42 ]
| Составное имя | Химическое название | Способ действия | Компания | Фаза разработки | Индикация | Ссылка |
|---|---|---|---|---|---|---|
| PRX-00933 | Н/Д | агонист 5-HT2C | Проксимаджер | Этап III (2011 г.) | Ожирение и диабет | [ 51 ] |
| Вабикасерин | (9aR,12aS)-4,5,6,7,9,9a,10,11,12,12a-декагидроциклопента[c][1,4]диазепино[6,7,1-ij]хинолин | агонист 5-HT2C | Пфайзер | Этап I (28 февраля 2012 г.) | Шизофрения | [ 52 ] |
| Лоркасерин | 1R)-8-хлор-2,3,4,5-тетрагидро-1-метил-1H-3-бензазепин | агонист 5-HT2C | Арена Фармасьютикалс | Одобрено FDA (27 июня 2012 г.) | Ожирение | [ 53 ] |
См. также
[ редактировать ]- 5-HT-рецептор
- 5-НТ2-рецептор
- 5-HT2C-рецептор
- Агонист рецепторов серотонина
- Антагонист серотонина
- Серотонин
- Лоркасерин
- Вабикасерин
Ссылки
[ редактировать ]- ^ Вакер, Д.А.; Миллер, К.Дж. (2008). «Агонисты рецептора серотонина 5-HT2C: доклиническое и клиническое прогрессирование при множественных заболеваниях». Текущее мнение об открытии и разработке лекарств . 11 (4): 438–45. ПМИД 18600561 .
- ^ Крайан, Джон Ф.; Лаки, Ирвин (2000). «Поведенческие эффекты, подобные антидепрессантам, опосредованные рецепторами 5-гидрокситриптамина 2C » . Журнал фармакологии и экспериментальной терапии . 295 (3): 1120–6. ПМИД 11082448 .
- ^ Перейти обратно: а б Цуй, Марко М.; Йорк, Джон Д. (2010). «Роль инозитолфосфатов и инозитолпирофосфатов в развитии, клеточной передаче сигналов и ядерных процессах» . Достижения в регуляции ферментов . 50 (1): 324–37. дои : 10.1016/j.advenzreg.2009.12.002 . ПМЦ 3269838 . ПМИД 20006638 .
- ^ Леопольдо, Марчелло; Лачивита, Энца; Де Джорджио, Паола; Берарди, Франческо; Перроне, Роберто (2011). «Медицинская химия лигандов рецептора 5-HT2C». Рецепторы 5-HT2C в патофизиологии заболеваний ЦНС . Тотова, Нью-Джерси: Humana Press. стр. 29–50. дои : 10.1007/978-1-60761-941-3_3 . ISBN 978-1-60761-940-6 .
- ^ Ян, Ян; Ан, Шу; Лю, Ин; Го, Сяо-Си; Гао, Линхуань; Вэй, Цзи-Фу; Сюй, Тянь-Жуй (2016). «Новые агонисты и антагонисты серотонинового рецептора 2 (5-HT2R): обзор патентов (2004–2014)». Экспертное заключение о терапевтических патентах . 26 (1): 89–106. дои : 10.1517/13543776.2016.1113257 . ISSN 1744-7674 . ПМИД 26609882 . S2CID 10831801 .
- ^ Перейти обратно: а б с Ван, Ю; Бай, Ю (2010). «Использование лоркасерина в лечении ожирения: критическая оценка» . Дизайн, разработка и терапия лекарств . 5 : 1–7. дои : 10.2147/Dddt.S11945 . ПМЦ 3023275 . ПМИД 21267355 .
- ^ Перейти обратно: а б с д и ж Томсен, В.Дж.; Гроттик, AJ; Мензаги, Ф.; Рейес-Салдана, Х.; Эпития, С.; Юскин Д.; Уилан, К.; Мартин, М.; Морган, М.; Чен, В.; Аль-Шамма, Х.; Смит, Б.; Чалмерс, Д.; Бехан, Д. (2008). «Лоркасерин, новый селективный агонист 5-гидрокситриптамина 2C человека: фармакологическая характеристика in vitro и in vivo». Журнал фармакологии и экспериментальной терапии . 325 (2): 577–587. дои : 10.1124/jpet.107.133348 . ПМИД 18252809 . S2CID 20924745 .
- ^ Бикердайк, Майк Дж.; Викерс, Стивен П.; Дуриш, Колин Т. (1999). «Модуляция рецептора 5-HT2C и лечение ожирения». Диабет, ожирение и обмен веществ . 1 (4): 207–14. дои : 10.1046/j.1463-1326.1999.00037.x . ПМИД 11228755 . S2CID 27485889 .
- ^ Перейти обратно: а б Лю, КК-Ц.; Лефкер, бакалавр; Домброски, Массачусетс; Чан, П.; Корнелиус, П.; Паттерсон, штат Калифорния; Цзэн, Ю.; Сантуччи, С.; Томлинсон, Э.; Гиббонс, CP; Марала, Р.; Браун, Дж.А.; Конг, JX; Ли, Э.; Вернер, В.; Венцель, З.; Гирагосян, К.; Чен, Х.; Коффи, С.Б. (2010). «Активные перорально и проницаемые для мозга амиды пролина как высокоселективные агонисты 5HT2c для лечения ожирения». Письма по биоорганической и медицинской химии . 20 (7): 2365–9. дои : 10.1016/j.bmcl.2010.01.107 . ПМИД 20202843 .
- ^ Гарфилд, AS; Хейслер, Л.К. (2008). «Фармакологическое воздействие на серотонинергическую систему при лечении ожирения» . Журнал физиологии . 587 (Часть 1): 49–60. дои : 10.1113/jphysicalol.2008.164152 . ПМК 2670022 . ПМИД 19029184 .
- ^ Перейти обратно: а б с Мартин, Корби К.; Редман, Линн М .; Чжан, Цзинькунь; Санчес, Матильда; Андерсон, Кристен М.; Смит, Стивен Р.; Равуссин, Эрик (2010). «Лорказерин, агонист рецептора 5-HT2C, снижает массу тела за счет снижения потребления энергии, не влияя при этом на расход энергии» . Журнал клинической эндокринологии и метаболизма . 96 (3): 837–45. дои : 10.1210/jc.2010-1848 . ПМК 3047218 . ПМИД 21190985 .
- ^ Перейти обратно: а б Деверо, Ричард Б. (1998). «Подавители аппетита и пороки сердца». Медицинский журнал Новой Англии . 339 (11): 765–6. дои : 10.1056/NEJM199809103391109 . ПМИД 9731094 .
- ^ Томас, Ш.; Батт, AY; Коррис, Пенсильвания; Иган, Джей-Джей; Хигенботтам, ТВ; Мэдден, BP; Уоллер, ПК (1995). «Супрессоры аппетита и первичная легочная гипертензия в Соединенном Королевстве» . Британский кардиологический журнал . 74 (6): 660–3. дои : 10.1136/hrt.74.6.660 . ПМК 484125 . ПМИД 8541174 .
- ^ Смит, Брайан М; Томсен, Уильям Дж; Гроттик, Эндрю Дж (2006). «Потенциальное использование селективных агонистов 5-HT 2C в лечении ожирения». Экспертное заключение об исследуемых препаратах . 15 (3): 257–66. дои : 10.1517/13543784.15.3.257 . ПМИД 16503763 . S2CID 22100586 .
- ^ Стейтен, Массачусетс (2007). «Проблемы открытия и разработки новых средств для лечения ожирения». Клиническая фармакология и терапия . 81 (5): 753–5. дои : 10.1038/sj.clpt.6100161 . ПМИД 17377527 . S2CID 2830353 .
- ^ Гринуэй, Фрэнк Л.; Брей, Джордж А. (2010). «Комбинированные препараты для лечения ожирения». Текущие отчеты о диабете . 10 (2): 108–15. дои : 10.1007/s11892-010-0096-4 . ПМИД 20425569 . S2CID 27455236 .
- ^ Торнвлит, AC; Пийл, Х; Хопман, Э; Эльте-Де Вевер, Б.М.; Мейндерс, А.Е. (1996). «Потеря веса, вызванная серотонинергическими препаратами, у пациентов с ожирением, жаждущих углеводов». Международный журнал ожирения и связанных с ним метаболических нарушений . 20 (10): 917–20. ПМИД 8910095 .
- ^ Вайсман, Нил Дж.; Панса, Хулио А.; Тай, Джон Ф.; Гвинн, Джон Т. (2001). «Естественная история клапанной регургитации через 1 год после прекращения терапии дексфенфлурамином: рандомизированное двойное слепое плацебо-контролируемое исследование» . Анналы внутренней медицины . 134 (4): 267–73. дои : 10.7326/0003-4819-134-4-200102200-00009 . ПМИД 11182836 . S2CID 45849415 .
- ^ Фицджеральд, LW; Берн, TC; Браун, бакалавр наук; Паттерсон, JP; Корджей, Миннесота; Валентайн, Пенсильвания; Сан, Дж. Х.; Линк, младший; Аббасзаде, И.; Холлис, Дж. М.; Ларджент, БЛ; Хартиг, PR; Холлис, Г.Ф.; Менье, ПК; Робишо, AJ; Робертсон, Д.В. (2000). «Возможная роль клапанных рецепторов серотонина 5-HT (2B) в кардиопатии, связанной с фенфлурамином». Молекулярная фармакология . 57 (1): 75–81. ПМИД 10617681 .
- ^ Текотт, Лоуренс Х.; Сан, Линда М.; Акана, Сьюзен Ф.; Стрэк, Элисон М.; Ловенштейн, Дэниел Х.; Даллман, Мэри Ф.; Юлиус, Дэвид (1995). «Расстройство пищевого поведения и эпилепсия у мышей с недостатком 5-HT. 2С рецепторы серотонина». Nature . 374 (6522): 542–6. : 1995Natur.374..542T . doi : 10.1038 /374542a0 . PMID 7700379. S2CID Bibcode 4368727 .
- ^ Хойер, Дэниел (1988). «Функциональные корреляты сайтов узнавания серотонина 5-HT 1 ». Журнал рецепторов и передачи сигналов . 8 (1–4): 59–81. дои : 10.3109/10799898809048978 . ПМИД 3290473 .
- ^ Сарджент, Пенсильвания; Шарпли, Алабама; Уильямс, К.; Гудолл, Э.М.; Коуэн, Пи Джей (1997). «Активация рецептора 5-HT 2C снижает аппетит и массу тела у людей с ожирением». Психофармакология . 133 (3): 309–12. дои : 10.1007/s002130050407 . ПМИД 9361339 . S2CID 7125577 .
- ^ Лабаск, Мэрилин; Меффре, Джули; Каррат, Гаэль; Бекамель, Карин; Бокарт, Жоэль; Марин, Филипп (2010). «Конститутивная активность рецепторов серотонина 2C при независимой от G-белка передаче сигналов: модуляция путем редактирования РНК и антидепрессантов». Молекулярная фармакология . 78 (5): 818–26. дои : 10.1124/моль.110.066035 . ПМИД 20699324 . S2CID 33007 .
- ^ Ван Окелен, Дирк; Люйтен, Уолтер ХМЛ; Лейсен, Хосе Э (2003). «Рецепторы 5-HT2A и 5-HT2C и их атипичные регуляционные свойства». Науки о жизни . 72 (22): 2429–49. дои : 10.1016/S0024-3205(03)00141-3 . ПМИД 12650852 .
- ^ Су, Вэньцзюань; Шарден, Пьер; Ямадзаки, Масакадзу; Канахо, Ясунори; Ду, Гуанвэй (2006). «RhoA-опосредованная передача сигналов фосфолипазы D1 не требуется для образования стрессовых волокон и фокальных спаек». Сотовая сигнализация . 18 (4): 469–78. doi : 10.1016/j.cellsig.2005.05.027 . ПМИД 15993039 .
- ^ Хиггинс, Гай А; Флетчер, Пол Дж (2003). «Серотонин и награда за лекарства: внимание к рецепторам 5-HT 2C ». Европейский журнал фармакологии . 480 (1–3): 151–62. дои : 10.1016/j.ejphar.2003.08.102 . ПМИД 14623358 .
- ^ Кеннетт, Джорджия; Клифтон, П.Г. (2010). «Новые подходы к фармакологическому лечению ожирения: могут ли они преодолеть барьер эффективности?». Фармакология Биохимия и поведение . 97 (1): 63–83. дои : 10.1016/j.pbb.2010.07.020 . ПМИД 20688100 . S2CID 25596946 .
- ^ Перейти обратно: а б с Берг, Келли А.; Харви, Джон А.; Спампинато, Умберто; Кларк, Уильям П. (2005). «Физиологическая значимость конститутивной активности рецепторов 5-HT 2A и 5-HT 2C ». Тенденции в фармакологических науках . 26 (12): 625–30. дои : 10.1016/j.tips.2005.10.008 . ПМИД 16269190 .
- ^ Берг, Келли А.; Стаут, Брайан Д.; Кроппер, Джоди Д.; Мааяни, Саул; Кларк, Уильям П. (1999). «Новое действие обратных агонистов на 5-HT 2C рецепторные системы » . Молекулярная фармакология . 55 (5): 863–72. ПМИД 10220565 .
- ^ Рейнольдс, Гэвин П.; Темплман, Люси А.; Чжан, Чжи Цзюнь (2005). «Роль полиморфизма рецептора 5-HT2C в фармакогенетике лечения антипсихотиками». Прогресс нейропсихофармакологии и биологической психиатрии . 29 (6): 1021–8. дои : 10.1016/j.pnpbp.2005.03.019 . ПМИД 15953671 . S2CID 30964513 .
- ^ Брей, Дженель К.; Годдард, Уильям А. (2008). «Структура человеческого рецептора серотонина 2c, связанного с G-белком, связанного с агонистами и антагонистами». Журнал молекулярной графики и моделирования . 27 (1): 66–81. дои : 10.1016/j.jmgm.2008.02.006 . ПМИД 18499489 .
- ^ Перейти обратно: а б Ахмед, Асиф; Чу, Хьюна; Чо, Ён Со; Пак, Ву-Гю; Паэ, Ае Ним (2009). «Идентификация новых лигандов рецептора серотонина 2C путем последовательного виртуального скрининга». Биоорганическая и медицинская химия . 17 (13): 4559–68. дои : 10.1016/j.bmc.2009.05.003 . ПМИД 19464901 .
- ^ Смит, Б.М.; Смит, Дж. М.; Цай, Дж. Х.; Шульц, Дж. А.; Гилсон, Калифорния; Эстрада, ЮАР; Чен, Р.Р.; Парк, DM; Прието, Э.Б.; Галлардо, CS; Сенгупта, Д.; Томсен, В.Дж.; Салдана, HR; Уилан, КТ; Мензаги, Ф.; Уэбб, Р.Р.; Били, НРА (2005). «Открытие и SAR новых бензазепинов как мощных и селективных агонистов рецептора 5-HT2C для лечения ожирения». Письма по биоорганической и медицинской химии . 15 (5): 1467–1470. дои : 10.1016/j.bmcl.2004.12.080 . ПМИД 15713408 .
- ^ Ахмад, С.; Нгу, К.; Миллер, К.Дж.; Ву, Г.; Хунг, КП; Мальмстрем, С.; Чжан, Г.; о'Таньи, Э.; Кейм, WJ; Каллен, MJ; Рорбах, КВ; Томас, М.; Унг, Т.; Цюй, К.; Ган, Дж.; Нарайанан, Р.; Пеллимаунтер, Массачусетс; Робл, JA (2010). «Трициклические дигидрохиназолиноны как новые 5-НТ2С-селективные и эффективные пероральные средства против ожирения». Письма по биоорганической и медицинской химии . 20 (3): 1128–33. дои : 10.1016/j.bmcl.2009.12.014 . ПМИД 20022752 .
- ^ Конвей, Ричард Дж.; Валант, Селин; Христопулос, Артур; Робертсон, Алан Д.; Капуано, Бен; Кросби, Ян Т. (2012). «Синтез и САР-исследование 4-арилпиперидинов и 4-арил-1,2,3,6-тетрагидропиридинов как агонистов 5-HT 2C ». Письма по биоорганической и медицинской химии . 22 (7): 2560–4. дои : 10.1016/j.bmcl.2012.01.122 . ПМИД 22381048 .
- ^ Ченг Дж., МакКорви Дж.Д., Жигер П.М., Чжу Х., Кенакин Т., Рот Б.Л. , Козиковски А.П. (2016). «Разработка и открытие функционально селективных агонистов рецепторов серотонина 2C (5-HT2C)» . Дж. Мед. Хим . 59 (21): 9866–9880. doi : 10.1021/acs.jmedchem.6b01194 . ПМИД 27726356 .
- ^ Брей, Джордж А.; Тарталья, Луи А. (2000). «Медикаментозные стратегии в лечении ожирения». Природа . 404 (6778): 672–7. дои : 10.1038/35007544 . ПМИД 10766254 . S2CID 4415341 .
- ^ Кимура, Ясухару; Хатанакаа, Кен-ичи; Наитуа, Юки; Мэноб, Кёичи; Симадаб, Ицуро; Коакуцуа, Акико; Ванибучия, Фумиказу; Ямагутия, Токио (2004). «Фармакологический профиль YM348, нового, мощного и активного агониста рецептора 5-HT 2C при пероральном приеме ». Европейский журнал фармакологии . 483 (1): 37–43. дои : 10.1016/j.ejphar.2003.10.004 . ПМИД 14709324 .
- ^ Шарреттс, Джон; Галеску, Овидиу; Гоматам, Шанти; Андрака-Каррера, Эухенио; Хапп, Кристиан; Янофф, Лиза (10 сентября 2020 г.). «Риск рака, связанный с лорказерином — обзор исследования CAMELLIA-TIMI 61, проведенный FDA». Медицинский журнал Новой Англии . 383 (11): 1000–1002. дои : 10.1056/NEJMp2003873 . ПМИД 32905671 . S2CID 221625777 .
- ^ Крайан, Джон Ф.; Лаки, Ирвин (2000). «Поведенческие эффекты, подобные антидепрессантам, опосредованные рецепторами 5-гидрокситриптамина 2C » . Журнал фармакологии и экспериментальной терапии . 295 (3): 1120–6. ПМИД 11082448 .
- ^ Розенцвейг-Липсон, С.; Сабб, А.; Стек, Г.; Митчелл, П.; Лаки, И.; Мальберг, Дж. Э.; Грауэр, С.; Бреннан, Дж.; Крайан, Дж. Ф.; Сукофф Риццо, SJ; Данлоп, Дж.; Барретт, Дж. Э.; Маркиз, КЛ (2007). «Антидепрессантоподобные эффекты нового селективного агониста рецептора 5-HT2C WAY-163909 у грызунов». Психофармакология . 192 (2): 159–170. дои : 10.1007/S00213-007-0710-6 . ПМИД 17297636 . S2CID 22518050 .
- ^ Перейти обратно: а б Дженсен, Нанна Х.; Кремерс, Томас И.; Сотти, Флоренция (2010). «Терапевтический потенциал лигандов рецептора 5-HT 2C » . Научный мировой журнал . 10 : 1870–85. дои : 10.1100/tsw.2010.180 . ПМК 5763985 . ПМИД 20852829 .
- ^ Данлоп, Дж.; Уоттс, Юго-Запад; Барретт, Дж. Э.; Купэ, Дж.; Харрисон, Б.; Мазандарани, Х.; Навощик, С.; Пангалос, Миннесота; Рамамурти, С.; Шехтер, Л.; Смит, Д.; Стек, Г.; Чжан, Дж.; Чжан, Г.; Розенцвейг-Липсон, С. (2011). «Характеристика вабиказерина (SCA-136), селективного агониста рецептора 5-гидрокситриптамина 2C» (PDF) . Журнал фармакологии и экспериментальной терапии . 337 (3): 673–680. дои : 10.1124/Jpet.111.179572 . ПМИД 21402690 . S2CID 26937933 . Архивировано из оригинала (PDF) 03 марта 2019 г.
- ^ Тонг, З.; Чандрасекаран, А.; Демайо, В.; Джордан, Р.; Ли, Х.; Мур, Р.; Пула, Н.; Бургхарт, П.; Халтин, Т.; Скатина, Дж. (2009). «Видовые различия в образовании карбамоилглюкуронида вабиказерина». Метаболизм и распределение лекарств . 38 (4): 581–90. дои : 10.1124/dmd.109.028639 . ПМИД 20032194 . S2CID 793693 .
- ^ Багди, Дьердь; Свед, Алан Ф.; Мерфи, Деннис Л.; Семереди, Каталин (1992). «Фармакологическая характеристика подтипов рецепторов серотонина, участвующих в реакции активности вазопрессина и ренина плазмы на агонисты серотонина». Европейский журнал фармакологии . 210 (3): 285–9. дои : 10.1016/0014-2999(92)90417-3 . ПМИД 1535317 .
- ^ Кан, Рене С.; Вецлер, Скотт (1991). «М-хлорфенилпиперазин как зонд функции серотонина». Биологическая психиатрия . 30 (11): 1139–66. дои : 10.1016/0006-3223(91)90184-N . ПМИД 1663792 . S2CID 13007057 .
- ^ Кимура, Ясухару; Найто, Юки; Ванибучи, Фумиказу; Ямагучи, Токио (2008). «Активация рецептора 5-HT 2C является распространенным механизмом проэректильного воздействия апоморфина, окситоцина и меланотана-II на крыс». Европейский журнал фармакологии . 589 (1–3): 157–62. doi : 10.1016/J.Ejphar.2008.05.022 . ПМИД 18582863 .
- ^ Хойер, Дэниел; Кларк, Дэвид Э.; Фозард, Джон Р.; Хартиг, Пол Р.; Мартин, Грэм Р.; Майлечаран, Юэн Дж.; Саксена, Прамод Р.; Хамфри, Патрик, Пенсильвания (1994). «Классификация рецепторов 5-гидрокситриптамина (серотонина) Международного союза фармакологии» . Фармакологические обзоры . 46 (2): 157–203. ПМИД 7938165 .
- ^ Кимура, Ясухару; Найто, Юки; Ванибучи, Фумиказу; Ямагучи, Токио (2006). «Характеристика повышения внутрикавернозного давления, вызванного Ym348, новым агонистом рецептора 5-HT 2C , у анестезированных крыс». Журнал урологии . 175 (5): 1953–7. дои : 10.1016/S0022-5347(05)00920-1 . ПМИД 16600805 .
- ^ Перейти обратно: а б Эндрюс, доктор медицины; Рыба, PV; Блэгг, Дж.; Брэбэм, Теннесси; Бреннан, ЧП; Бриджленд, А.; Браун, AD; Бунгей, Пи Джей; Конлон, КМ; Эдмундс, Нью-Джерси; Аф Форселлес, К.; Гиббонс, CP; Грин, член парламента; Хантон, Г.; Холбрук, М.; Джессиман, А.С.; Макинтош, К.; МакМюррей, Дж.; Николс, CL; Рут, Дж.А.; Сторер, Род-Айленд; Саттон, MR; Уорд, Р.В.; Уэстбрук, Д.; Уитлок, Джорджия (2011). «Пиримидо\4,5-d]азепины как мощные и селективные агонисты рецептора 5-HT2C: разработка, синтез и оценка PF-3246799 для лечения недержания мочи». Письма по биоорганической и медицинской химии . 21 (9): 2715–2720. дои : 10.1016/J.Bmcl.2010.11.120 . ПМИД 21195614 .
- ^ Проксимаген групп плк. «Годовой отчет и финансовая отчетность за 2011 год: Работаем вместе» (PDF) . Проксимаген. Архивировано из оригинала (PDF) 16 сентября 2012 года . Проверено 26 сентября 2012 г.
- ^ Пфайзер. «Пайплайн Pfizer» (PDF) . Пфайзер . Проверено 26 сентября 2012 г.
- ^ FDA. «БЕЛВИК» . Управление по контролю за продуктами и лекарствами . Проверено 26 сентября 2012 г.
![Пиразоло[3,4-d]пиримидиновое ядро](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8d/5-HT2C-hit-general.svg/157px-5-HT2C-hit-general.svg.png)