Никотиновый агонист
Никотиновый агонист — это препарат, имитирующий действие ацетилхолина (АХ) на никотиновые ацетилхолиновые рецепторы (нАХР). НаХР назван в честь его сродства к никотину.
Примеры включают никотин (по определению), ацетилхолин ( эндогенный агонист нАХР), холин , эпибатидин , лобелин , варениклин и цитизин . [1]
История
[ редактировать ]
Никотин известен на протяжении веков своим опьяняющим действием. Впервые он был выделен в 1828 году из растения табака немецкими химиками Поссельтом и Рейманном. [2]
Положительное влияние никотина на память животных было обнаружено исследованиями in vivo в середине 1980-х годов. Эти исследования открыли новую эру в изучении никотиновых ацетилхолиновых рецепторов (нАХР) и их стимуляции, но до тех пор основное внимание уделялось никотиновой зависимости. [3] [4] Разработка агонистов нАХР началась в начале 1990-х годов после открытия положительного эффекта никотина. Некоторые исследования показали возможный вариант терапии в доклинических исследованиях. ABT-418 был одним из первых в серии агонистов нАХР и был разработан Abbott Labs . [4] ABT-418 продемонстрировал значительное увеличение эффективности отложенного сопоставления с образцом (DMTS) у половозрелых обезьян-макак разных видов и пола. [5] ABT-418 также исследовался как возможное средство лечения болезней Альцгеймера, Паркинсона и синдрома дефицита внимания и гиперактивности: эти эксперименты показали положительные результаты. [4]
Одним из первых активных соединений нАХР, помимо никотина, который поступил на рынок в качестве лекарства, был галантамин , растительный алкалоид , который действует как слабый ингибитор холинэстеразы (IC50 = 5 мкМ), а также как аллостерический сенсибилизатор для нАХР (EC50 = 50 нМ). . [6]
Никотиновые рецепторы ацетилхолина и их сигнальная система
[ редактировать ]
Система сигнализации
[ редактировать ]человека В нервной системе никотиновые холинергические сигналы распространяются по всей системе, где нейромедиатор ацетилхолин (АХ) играет ключевую роль в активации лиганд-управляемых ионных каналов . [7] Холинергическая система представляет собой жизненно важный нервный путь, в котором холинергические нейроны синтезируют, хранят и высвобождают нейромедиатор АХ. Основными рецепторами, преобразующими сообщения ACh, являются холинергические мускариновые рецепторы ацетилхолина , нейрональные и мышечные nAChR. Если оглянуться назад на историю эволюции, ACh считается старейшей молекулой-передатчиком, которая появилась раньше нервной клетки. В нервной системе холинергическая стимуляция, опосредованная nAChR, контролирует такие пути, как высвобождение трансмиттеров и чувствительность клеток, которые могут влиять на физиологическую активность, включая сон, тревогу, обработку боли и когнитивные функции. [8]
Никотиновые рецепторы ацетилхолина
[ редактировать ]нАХР представляют собой холинергические рецепторы, обнаруженные в центральной нервной системе (ЦНС), периферической нервной системе (ПНС) и скелетных мышцах. Эти рецепторы представляют собой лиганд-зависимые ионные каналы с сайтами связывания ацетилхолина и других молекул. Когда АХ или другие агонисты связываются с рецепторами, они стабилизируют открытое состояние ионного канала, обеспечивая приток катионов, таких как ионы калия, кальция и натрия. nAChR состоят из различных субъединиц, которые определяют четвертичную структуру рецептора: эти субъединицы представляют собой α-субъединицы (α1-α10), β-субъединицы (β1-β4), одну субъединицу δ, одну субъединицу γ и одну субъединицу ε. нАХР могут быть гетеромерными или гомомерными . Гетеромерные рецепторы, обнаруженные в центральной нервной системе, состоят из двух субъединиц α и трех субъединиц β с сайтом связывания на границе раздела α и соседней субъединицы. Эти рецепторы содержат два сайта связывания на каждый рецептор и имеют различное сродство к химическим веществам в зависимости от состава субъединиц. Оба сайта связывания работают вместе, и поэтому оба сайта должны быть заняты агонистом нАХР, чтобы могла произойти активация канала. [9] Было показано, что нАХР, содержащие субъединицы α2-α6 и β2-β4, обладают более высоким сродством к ACh, чем другие рецепторы. Гомомерные рецепторы содержат 5 идентичных субъединиц, имеют 5 сайтов связывания, расположенных на границе раздела двух соседних субъединиц. В 2000 году у человека были идентифицированы два гомомерных рецептора: рецепторы α7 и α8. [8] [10] [11] [12]
Связывающий сайт
[ редактировать ]На гетеромерных нАХР есть два сайта связывания; для стабилизации открытой формы нАХР оба сайта связывания должны быть заняты агонистом, таким как никотин или АХ. [11]
Сайт связывания АХ нАХР состоит из шести петель, называемых A – F. Петли A, B и C сайта связывания являются частью α-субъединицы и являются основными компонентами сайта связывания. Субъединица, смежная с субъединицей α (γ, δ, ε или β), содержит петли D, E и F. [11]
Механизм действия
[ редактировать ]
Агонисты рецептора α4β2
[ редактировать ]нАХР α4β2 содержат две субъединицы α4 и три субъединицы β2, поэтому они имеют два сайта связывания для ACh и других агонистов . нАХР α4β2 составляют примерно 90% нАХР в мозге человека, и при хроническом воздействии никотина или других агонистов никотина это приводит к увеличению плотности рецепторов α4β2, что противоположно тому, что обычно происходит, когда другие рецепторы хронически подвергаются воздействию своих агонистов. Рецептор α4β2 широко изучался в отношении болезни Альцгеймера, а также никотиновой зависимости, и в 2009 году на рынке появилось несколько препаратов, специально нацеленных на α4β2-нАХР. [13] [14]
Агонисты α7-рецепторов
[ редактировать ]Рецепторы α7 представляют собой гомомерные нейрональные рецепторы ацетилхолина, состоящие из пяти субъединиц α7 и имеющие пять сайтов связывания ACh. Сообщалось, что аномалия экспрессии рецепторов α7 влияет на прогрессирование таких заболеваний, как болезнь Альцгеймера и шизофрения . Считается, что α7 не обладают таким большим сродством к никотину, как гетеромерный рецептор, но вместо этого они продемонстрировали большее сродство к альфа-бунгаротоксину , который является антагонистом никотина, обнаруженным в яде некоторых змей. Поэтому считается, что нацеливание на рецепторы α7 полезно при лечении болезни Альцгеймера и шизофрении. [9] [15]
Агонисты рецепторов мышечного типа
[ редактировать ]нАХР обнаруживаются в нервно-мышечных соединениях скелетных мышц. Были обнаружены два разных рецептора, один из которых преимущественно был обнаружен у взрослых и содержит две субъединицы α1, одну β1, одну ε и одну δ, другой был обнаружен у плода и содержит субъединицу γ вместо субъединицы ε. НАХР принимают участие в деполяризации мышечной концевой пластинки за счет увеличения катионной проницаемости, что приводит к сокращению скелетных мышц. [16] нАХР, обнаруженные в системе скелетных мышц, имеют два сайта связывания АХ, один из которых находится на границе между субъединицами α1 и δ, а другой — на границе между субъединицами α1 и γ или ε. Среди антагонистов nAChR, разработанных специально для нервно-мышечной системы, есть нервно-паралитические газы и другие яды, предназначенные для быстрого уничтожения людей или других животных и насекомых. [12]
Связывание
[ редактировать ]АХ связывается с нАХР из-за разницы зарядов между молекулой и поверхностью рецептора. При связывании с нАХР АХ попадает в карман связывания, образованный петлями А, В и С, принадлежащими α-субъединице и соседней субъединице. Когда АХ встраивается в связывающий карман, петли нАХР перемещаются, что приводит к координации молекулы АХ в кармане, усиливая химические связи между молекулой и рецептором. После перемещения петель, принадлежащих α-субъединице, молекула АХ иногда может образовать связь, например, солевой мостик, с соседней субъединицей, еще больше усиливая связи между рецептором и АХ. [17]
Дизайн лекарств
[ редактировать ]Лекарственные средства, влияющие на нАХР, могут быть агонистами, частичными агонистами или антагонистами . [1] Однако агонисты, например никотин, могут действовать как деполяризующие агенты при контакте с нАХР в течение некоторого времени (секунды или минуты, в зависимости от концентрации и подтипа нАХР). Хроническое воздействие агониста также может привести к длительной функциональной дезактивации из-за быстрой и стойкой десенсибилизации. Частичные агонисты нАХР изучались, поскольку они, по-видимому, помогают бросить курить. Считается, что частичные агонисты связываются с nAChR и стимулируют высвобождение дофамина в меньших количествах, чем агонисты, и, следовательно, компенсируют отсутствие никотина. [18]
Отсутствие специфичности некоторых никотиновых агонистов хорошо известно и является потенциальной проблемой при их использовании для лечения заболеваний, требующих воздействия на определенный подтип нАХР. К числу этих неспецифических агонистов относятся, например, АХ, никотин и эпибатидин, которые нацелены на более чем один подтип нАХР. [19] [20]
Фармакофор
[ редактировать ]
Разработка фармакофора- агониста nAChR началась в 1970 году, когда было предположено, что связывание агонистов с рецептором зависит от положительно заряженного атома азота и водородной связи, образующейся из карбонильного атома кислорода в ацетилхолине или атома азота в (S)-. никотин. С тех пор было показано, что катионный центр, атомы, электроотрицательные и способные образовывать водородные связи вместе с центром пиридинового кольца в (S)-никотине, являются благоприятными. Стереохимия является частью фармакофора, что ясно видно на примере (S)- и (R)-никотина, где (S) -энантиомер в 10-100 раз более эффективен. Азабициклическое кольцо эпибатидина является еще одним примером благоприятного стерического взаимодействия с рецепторами. Было высказано предположение, что определенное межазотное расстояние N + -N важен для сродства к агонистам, но по поводу его влияния возникли споры. Более новая теория состоит в том, что расстояние в 7-8 Å между точками, которые дополняют протонированный атом азота и акцептор водородной связи, увеличивает эффективность. Низкая электронная плотность вблизи протонированного азота и более высокая электронная плотность вблизи пиридинового кольца благоприятствуют протонированным никотиновым лигандам , содержащим пиридиновое кольцо. В последующие годы исследователи проявили больший интерес к рецепторам подтипов α7 и α4β2 при разработке лекарств для лечения никотиновой зависимости и когнитивных нарушений, таких как болезнь Альцгеймера. [21]
Отношения структура-деятельность
[ редактировать ]Взаимосвязь структура-активность: мышечные агонисты нАХР
[ редактировать ]Были использованы различные модели, в которых проверялось сродство агонистов nAChR к подтипу рецептора, чтобы помочь идентифицировать молекулы, группы и стерическую конформацию, которые имеют жизненно важное значение для большего сродства. С использованием модели мышечного рецептора nAChR подтипа (α1) 2 β1δγ были получены следующие результаты:
- анатоксин > эпибатидин > ацетилхолин > ДМПП >> цитизин > пирантел > никотин > кониин > тубокураре > лобелин ,
где анатоксин имел самую высокую эффективность активности, а тубокура - самую низкую. Ацетилхолин, с другой стороны, вызывал гораздо более длительное время открытия рецептора, хотя анатоксин более эффективен. Результаты показывают, что производные анатоксина могут быть полезны для понимания взаимосвязей структура-активность (SAR) для мышечных nAChR. [22]
Сукцинилхолин хлорид , препарат, который уже доступен на рынке, представляет собой сложный эфир бихолина и миорелаксант короткого действия. Эфиры бихолина представляют собой соединения, которые могут действовать как конкурентные агонисты на нАХР мышечного типа и использовались в исследованиях SAR. На модели Torpedo (α1) 2 β1δγ nAChR было продемонстрировано, что эффективность агонистов эфира бихолина зависит от длины цепи, поскольку эффективность увеличивается с увеличением длины цепей. Эффективность, по-видимому, не зависит от длины цепи, поскольку наибольшая эффективность наблюдается у эфиров бихолина с четырьмя-семью CH.
2 единицы и ниже для обоих меньшего количества CH
2 единицы и более. [23]
Взаимосвязь структура-активность: агонисты α4β2 нАХР
[ редактировать ]
Сочетание структурных элементов АХ и никотина, а также снижение конформационной гибкости за счет использования циклопропанового кольца привели к открытию мощных и селективных лигандов α4β2 нАХР. Модуляцию трех структурных элементов, линкера, замещения в аминогруппе и пиридиновом кольце можно использовать для определения влияния на эффективность и селективность лигандов. Факторами, снижающими связывание, являются стерические препятствия для аминогруппы и линкеры, представляющие собой насыщенные/ненасыщенные углеродные цепи. Предпочтительны короткоцепочечные эфирные линкеры. Благотворное влияние на связывание наблюдается при замещении в пиридиновом кольце как моно-, так и дисзамещения галогенами среди других групп. Замена аминогруппы тремя различными амидами увеличивала аффинность связывания там, где метиламид имел самое высокое связывание. Меньшее связывание в других замещенных амидах объяснялось стерическими затруднениями или отсутствием метильной группы, что приводило к потере гидрофобного взаимодействия. Стереохимия пиридинового азота и/или пиридинового кольца и его стереоэлектронные эффекты оказывают незначительное благотворное влияние на связывание с α4β2-нАХР. Таким образом, было показано, что наибольшую активность имеет пиридиловый эфирный лиганд с бромзамещением в пиридине и метиламидом в аминогруппе. [24]
Взаимосвязь структура-активность: агонисты α7 нАХР
[ редактировать ]

Поиск селективных и мощных агонистов α7-нАХР привел к появлению ряда соединений, которые имеют хороший потенциал в качестве кандидатов на лекарственные средства. Один из таких поисков выявил SEN12333 /WAY-317538 среди других соединений, которые имеют желаемые фармакокинетические профили и селективны в отношении α7-нАХР по сравнению с α1, α3 и α4β2-нАХР. Предложены структурно-активные зависимости этих соединений. [15] Оптимальный фармакофор агониста α7 нАХР состоит из трех частей. Существует основная группа, соединенная с углеродной цепью, связанной с ароматической группой амидным мостиком. Амидный мостик можно инвертировать, не влияя на эффективность агониста. Биарильная группа проявляет большую эффективность , чем моноарильная группа, поскольку ароматическая группа и замещение в положении 2 более поздней арильной группы еще больше увеличивают эффективность. Эффективность выше у агонистов с H + донор/акцептор поздней арильной группы биарильной группы. Большое количество акцепторов водородных связей может снизить проницаемость гематоэнцефалического барьера (ГЭБ) из-за полярной площади поверхности, и это необходимо учитывать при разработке агонистов, нацеленных на α7-нАХР. [15]
Различные циклические аминогруппы могут действовать как основная часть, и эффективность остается относительно неизменной, например, арилпиперазин , пиперидин и морфолин . Ациклический третичный амин допускается в качестве основного фрагмента, но более крупные стерические группы переносятся хуже. [15]
Известно, что многие производные хинуклидина, такие как хинуклидинамид, являются агонистами α7-нАХР. Исследования SAR для хинуклидинамида выявили факторы, влияющие на эффективность и сродство этих агонистов. Пара-замещение в хинуклидиновом кольце и конфигурации 3-(R) в стереохимии является предпочтительным. Повышенная активность наблюдается при присоединении 5-членного кольца к ароматическому фрагменту. Дальнейшее усиление наблюдается, когда конденсированное кольцо способно обеспечить электронный резонанс амид-карбонила, тогда как активность снижается, когда конденсированное кольцо содержит атом-донор водородной связи. Предполагается, что жесткость хинуклидина и ортогональная ориентация азотистого мостика по отношению к амидной карбонильной группе важны для оптимального связывания. Стабильность некоторых из наиболее мощных производных хинуклидинамида на крысиных моделях in vitro была низкой, однако при добавлении метильной группы в положение 2 хинуклидинового кольца стабильность значительно возросла. [25]
Разработка лекарств
[ редактировать ]Разработка агонистов никотиновых рецепторов ацетилхолина началась в начале 1990-х годов после открытия положительного влияния никотина на память животных. [3] [4] С тех пор разработка агонистов никотиновых рецепторов ацетилхолина прошла долгий путь. Агонисты никотиновых рецепторов ацетилхолина привлекают все большее внимание как кандидаты в лекарственные средства для лечения множественных заболеваний центральной нервной системы, таких как болезнь Альцгеймера , шизофрения , синдром дефицита внимания с гиперактивностью (СДВГ) и никотиновая зависимость . [26] [27] Никотиновые рецепторы ацетилхолина — это рецепторы, обнаруженные в центральной нервной системе , периферической нервной системе и скелетных мышцах. Они представляют собой лиганд-управляемые ионные каналы с сайтами связывания ацетилхолина , а также других агонистов . Когда агонисты связываются с рецептором , это стабилизирует открытое состояние ионного канала, обеспечивая приток катионов . [9]
В 2009 году на рынке было как минимум пять препаратов, влияющих на никотиновые рецепторы ацетилхолина.
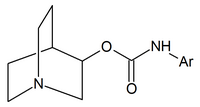 |  | 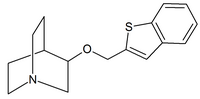 |
| Хинуклидин карбаматы | Хинуклидинамиды | Хинуклидиновые эфиры |
Продукты никотинового агониста
[ редактировать ]| Активный ингредиент | Название продукта | Химическое название | Фармацевтическая форма | Фармакодинамические свойства | Терапевтическое использование | Структура |
|---|---|---|---|---|---|---|
| Варениклина тартрат | Чампикс, Чантикс | 7,8,9,10-тетрагидро-6,10-метано-6H-пиразино[2,3-h][3]бензазепин [27] | Таблетка, покрытая пленочной оболочкой | Частичный агонист никотиновых рецепторов ацетилхолина, подтип α 4 β 2 [28] | Лечение табачной зависимости [28] |  |
| Галантамина гидробромид | Реминил, Нивалин, Разадин и Разадин ER | 4а,5,9,10,11,12-гексагидро-3-метокси-11-метил-6Н-бензофуро[3а,3,2-эф][2]-бензазепин-6-ол [29] | Капсула с пролонгированным высвобождением, таблетка, покрытая пленочной оболочкой, раствор для перорального применения. | Ингибитор холинэстеразы и неконкурентный агонист никотиновых холиновых рецепторов. [4] | Лечение деменции, вызванной болезнью Альцгеймера [30] | 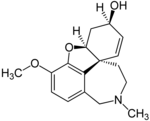 |
| Никотин | Никоретте , Никитинелл, Никвитин, Ботинки NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3-[(2S)-1-метилпирролидин-2-ил]пиридин | Трансдермальный пластырь, жевательная резинка, ингалятор, назальный спрей, пастилки, микротаблетки. В природе содержится в табаке. | Агонист никотиновых рецепторов, [31] оба типа ганглия и α 4 β 2 [32] | Лечение табачной зависимости [33] | 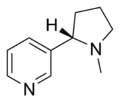 |
| Карбахол | Миостат | 2-[(аминокарбонил)окси]-N,N,N-триметилэтанамин | Внутриглазной раствор | Холинергический агонист [34] | Лечение глаукомы | 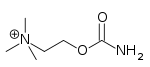 |
| Суксаметония хлорид (сукцинилхолина хлорид) | Анектин, квелицина суксаметония хлорид | 2,2'-[(1,4-диоксобутан-1,4-диил)бис(окси)]бис(N,N,N-триметилэтанамин) | Внутривенная или внутримышечная инъекция | Деполяризующий нервно-мышечный блокатор [35] | Миорелаксант короткого действия [36] | |
| Эпибатидин | Нет в списке | 2-(6-хлорпиридин-3-ил)-7-азабицикло[2.2.1]гептан | Нет в списке | Агонист никотиновых рецепторов ацетилхолина [37] | Не используется в качестве лекарственного средства |  |
Другие никотиновые агонисты, хотя обычно и с ограниченным клиническим применением, включают:
- лобелин , агонист никотиновых рецепторов ганглиозного типа , а также влияет на окончания сенсорных нервов. [32]
- эпибатидин , агонист ганглионарного типа , α4β2 и α7. рецепторов [32]
- декаметоний вызывает блок деполяризации рецепторов мышечного типа , подобно суксаметонию. [32]
Никотиновая и мускариновая активность
[ редактировать ]| Сравнение холинергических агонистов [38] | ||||
|---|---|---|---|---|
| Вещество | Специфичность рецептора | Гидролиз ацетилхолинэстераза | Комментарии | |
| Мускариновый | Никотиновый | |||
| Холин | +++ | +++ | ++ | Основное питательное вещество |
| Ацетилхолин | +++ | +++ | +++ | Эндогенный лиганд |
| Карбахол | ++ | +++ | - | Используется при лечении глаукомы. |
| Метахолин | +++ | + | ++ | |
| Бетанехол | +++ | - | - | Используется в мочевом пузыре и желудочно-кишечная гипотония. |
| Мускарин | +++ | - | - | Природный алкалоид, содержащийся в некоторых грибах. Причина отравления грибами |
| Никотин | - | +++ | - | Природный алкалоид, содержащийся в растении табака . |
| Пилокарпин | ++ | - | - | Используется при глаукоме |
| Оксотреморин | ++ | - | - | |
Текущий статус
[ редактировать ]В настоящее время исследования агонистов никотиновых рецепторов и разработка лекарств направлены на лечение множества заболеваний и расстройств ЦНС. [39]
У Таргацепта есть три препарата-кандидата, которые проходят клинические испытания ; AZD3480 (TC-1734) для лечения СДВГ, который в настоящее время проходит фазу II клинических испытаний, AZD1446 (TC-6683) для лечения болезни Альцгеймера в сотрудничестве с AstraZeneca и TC-5619 для лечения когнитивных дисфункций при шизофрении.
Компания Memory Pharmacy совместно со своим партнером Roche имеет один кандидат на лекарство, MEM 3454 (RG3487), частичный агонист никотинового рецептора α7 , для лечения болезни Альцгеймера. [40] [41]
Abbott Laboratories в партнерстве с NeuroSearch проводит клинические испытания двух потенциальных лекарств: ABT-894 , селективного агониста никотиновых рецепторов α4β2 для лечения СДВГ, и ABT-560 , нейронального модулятора никотиновых рецепторов, который был выбран Abbott в 2006 году в качестве нового кандидата на разработку. при когнитивных дисфункциях. [42]
У EnVivo Pharmacy есть один препарат-кандидат, проходящий клинические испытания, EVP-6124, селективный агонист никотиновых рецепторов α7 для лечения болезни Альцгеймера и шизофрении, а также одно соединение для последующего наблюдения, EVP-4473, которое успешно завершило доклиническую разработку . [43]
См. также
[ редактировать ]- Мускариновый рецептор ацетилхолина
- Мускариновый агонист
- Мускариновый антагонист
- Никотиновый рецептор ацетилхолина
- Никотиновый антагонист
- Парасимпатомиметический препарат
Ссылки
[ редактировать ]- ^ Jump up to: а б Матера, Карло; Папотто, Клаудио; Далланоче, Клелия; Де Амичи, Марко (август 2023 г.). «Достижения в области малых молекул, селективных лигандов для гетеромерных никотиновых рецепторов ацетилхолина» . Фармакологические исследования . 194 : 106813. doi : 10.1016/j.phrs.2023.106813 . hdl : 2434/978688 .
- ^ Хеннингфилд, Джек Э; Зеллер, Митч (2006), «Вклад исследований никотиновой психофармакологии в Соединенные Штаты и глобальное регулирование табака: взгляд назад и взгляд вперед», Psychopharmacology , 184 (3–4): 286–291, doi : 10.1007/s00213-006- 0308-4 , ПМИД 16463054 , С2КИД 38290573
- ^ Jump up to: а б Арутюнян, Ваграм; Барнс, Эдвард; Дэвис, К.Л. (1985), «Холинергическая модуляция памяти у крыс», Psychopharmacology , 87 (3): 266–271, doi : 10.1007/BF00432705 , PMID 3001803 , S2CID 20040918
- ^ Jump up to: а б с д и Буккафуско, Дж. Дж. (2004), «Подтипы нейрональных никотиновых рецепторов: определение терапевтических целей» (PDF) , Molecular Interventions , 4 (5): 285–295, doi : 10.1124/mi.4.5.8 , PMID 15471911
- ^ Буккафуско, Джей Джей; Джексон, штат Вашингтон; Терри-младший, AV; Марш, Канзас; Декер, Миссури; Арнерик, С.П. (1995), «Улучшение выполнения обезьянами задачи отсроченного сопоставления с образцом после ABT-418: новый активатор холинергических каналов для улучшения памяти», Psychopharmacology , 120 (3): 256–266, doi : 10.1007/BF02311172 , PMID 8524972 , S2CID 23215696
- ^ Людвиг, Дж.; Хёффле-Маас, А. (2010), «Локализация с помощью сайт-направленного мутагенеза сайта связывания галантамина на внеклеточном домене α 7 никотинового ацетилхолинового рецептора», Journal of Receptors and Signal Transduction , 30 (6): 469–483, doi : 10.3109/10799893.2010.505239 , PMID 21062106 , S2CID 9160835
- ^ Лю, Чжаопин; Чжан, Дж; Берг, Дарвин К. (2007), «Роль эндогенной никотиновой передачи сигналов в управлении развитием нейронов», Biochemical Pharmacology , 74 (8): 1112–1119, doi : 10.1016/j.bcp.2007.05.022 , PMC 2116993 , PMID 17603025
- ^ Jump up to: а б Готти, К.; Клементи, Ф. (2004), «Нейрональные никотиновые рецепторы: от структуры к патологии», Progress in Neurobiology , 74 (6): 363–396, doi : 10.1016/j.pneurobio.2004.09.006 , PMID 15649582 , S2CID 24093369
- ^ Jump up to: а б с Патерсон, Дэвид; Нордберг, Агнета (2000), «Нейрональные никотиновые рецепторы в человеческом мозге», Progress in Neurobiology , 61 (1): 75–111, doi : 10.1016/s0301-0082(99)00045-3 , PMID 10759066 , S2CID 27207955
- ^ Сала, Ф.; Нистри, А.; Криадо, М. (2008), «Никотиновые ацетилхолиновые рецепторы хромаффинных клеток надпочечников» , Acta Physiologica , 192 (2): 203–212, doi : 10.1111/j.1748-1716.2007.01804.x , PMID 18005395 , S2CID 29310750 [ мертвая ссылка ]
- ^ Jump up to: а б с Итье, Валери; Бертран, Дэниел (2001), «Нейрональные никотиновые рецепторы: от структуры белка к функции», FEBS Letters , 504 (3): 118–125, doi : 10.1016/S0014-5793(01)02702-8 , PMID 11532443
- ^ Jump up to: а б Линдстрем, Дж. М. (2003), «Никотиновые ацетилхолиновые рецепторы мышц и нервов» , Annals of the New York Academy of Sciences , 998 : 41–52, doi : 10.1196/annals.1254.007 , PMID 14592862 , S2CID 84583356 [ мертвая ссылка ]
- ^ Михайлеску, Стефан; Друкер-Колин, Рене (2000), «Никотин, никотиновые рецепторы мозга и нервно-психические расстройства», Archives of Medical Research , 31 (2): 131–144, doi : 10.1016/S0188-4409(99)00087-9 , PMID 10880717
- ^ Ариас, Хьюго Р. (1997), «Топология сайтов связывания лиганда на никотиновом рецепторе ацетилхолина», Brain Research Reviews , 25 (2): 133–191, doi : 10.1016/S0165-0173(97)00020-9 , PMID 9403137 , S2CID 26453010
- ^ Jump up to: а б с д Хайдар, Саймон Н.; Гирон, Кьяра; Беттинетти, Лаура; Ботман, Хендрик; Комери, Томас А.; Данлоп, Джон; Ла Роза, Сальваторе; Микко, Иоланда; Полластрини, Мартина; Куинн, Джоанна; Ронкарати, Ренца; Скали, Карла; Валакки, Микела; Варрон, Морис; Заналетти, Риккардо (2009), «SAR и биологическая оценка SEN12333/WAY-317538: новый агонист никотинового ацетилхолинового рецептора альфа-7», Bioorganic & Medicinal Chemistry , 17 (14): 5247–5258, doi : 10.1016/j.bmc. 2009.05.040 , PMID 19515567
- ^ Брантон, Лоуренс Л.; Лазо, Джон С.; Паркер, Кейт Л., ред. (2006), «Фармакологические основы терапии» Гудмана и Гилмана (11-е изд.), McGRAW HILL, ISBN 978-0-07-142280-2
- ^ Анвин, Найджел (2004), «Уточненная структура никотинового ацетилхолинового рецептора с разрешением 4 °», Journal of Molecular Biology , 346 (4): 967–989, doi : 10.1016/j.jmb.2004.12.031 , PMID 15701510
- ^ Касселс, Брюс К.; Бермудес, Изабель; Дахас, Федерико; Абин-Каррикири, Ж. Андрес; Воннакотт, Сьюзен (2005), «От дизайна лигандов к терапевтической эффективности: проблема исследования никотиновых рецепторов», Drug Discovery Today , 10 (23–24): 1657–1665, doi : 10.1016/S1359-6446(05)03665- 2 , hdl : 10533/176659 , PMID 16376826
- ^ Матера, Карло; Папотто, Клаудио; Далланоче, Клелия; Де Амичи, Марко (август 2023 г.). «Достижения в области малых молекул, селективных лигандов для гетеромерных никотиновых рецепторов ацетилхолина» . Фармакологические исследования . 194 : 106813. doi : 10.1016/j.phrs.2023.106813 . hdl : 2434/978688 .
- ^ Готти, К.; Форнасари, Д.; Клементи, Ф. (1997), «Нейрональные никотиновые рецепторы человека», Progress in Neurobiology , 53 (2): 199–237, doi : 10.1016/S0301-0082(97)00034-8 , PMID 9364611 , S2CID 10421687
- ^ Тондера, Янне Э.; Олесена, Пребен Х.; Хансена, Джон Бондо; Бегтрупб, Микаэль; Петтерссона, Ингрид (2001), «Улучшенный никотиновый фармакофор и стереоселективная модель CoMFA для никотиновых агонистов, действующих на центральные никотиновые рецепторы ацетилхолина, меченные [3H]-N-метилкарбамилхолином», Журнал компьютерного молекулярного дизайна , 15 (3). ): 247–258, Bibcode : 2001JCAMD..15..247T , doi : 10.1023/A:1008140021426 , PMID 11289078 , S2CID 80361
- ^ Купер, Джулия С.; Гутброд, Оливер; Витземанн, Фейт; Метфессель, Кристоф (1996), «Фармакология никотинового рецептора ацетилхолина из мышц плода крысы, экспрессируемого в ооцитах Xenopus», European Journal of Pharmacology , 309 (3): 287–298, doi : 10.1016/0014-2999(96)00294- 4 , ПМИД 8874153
- ^ Картер, Крис Р.Дж.; Цао, Лижень; Каваи, Хидеки; Смит, Питер А.; Драйден, Уильям Ф.; Рафтери, Майкл А.; Данн, Сьюзан М.Дж. (2007), «Зависимость взаимодействия бисчетвертичных лигандов с торпедоникотиновым ацетилхолиновым рецептором от длины цепи», Biochemical Pharmacology , 73 (3): 417–426, doi : 10.1016/j.bcp.2006.10.011 , PMID 17118342
- ^ Чартон, Ив; Гийонно, Клод; Локхарт, Брайан; Лестагеб, Пьер; Гольдштейн, Соло (2008), «Получение и профиль сродства новых никотиновых лигандов», Bioorganic & Medicinal Chemistry Letters , 18 (6): 2188–2193, doi : 10.1016/j.bmcl.2007.12.075 , PMID 18262785
- ^ Уокер, Дэниел П.; Вишка, Донн Г.; Пиотровски, Дэвид В.; Цзя, Шаоцзюань; Рейтц, Стивен С.; Йейтс, Карен М.; Майерс, Джейсон К.; Ветман Татьяна Н.; Марголис, Брэндон Дж.; Якобсен, Э. Джон; Акер, Брэд А.; Гроппи, Винсент Э.; Вулф, Марк Л.; Торнбург, Брюс А.; Тинхолт, Паула М.; Кортес-Бургос, Луз А.; Уолтерс, Родни Р.; Хестер, Мэтью Р.; Сист, Эрик П.; Долак, Лестер А.; Хан, Фюсен; Олсон, Барбара А.; Фицджеральд, Лаура; Стейтон, Брайан А.; Рауб, Томас Дж.; Хайос, Михай; Хоффманн, Уильям Э.; Ли, Кай С.; Хигдон, Николь Р.; и др. (2006), «Дизайн, синтез, взаимосвязь структура-активность и in vivo активность азабициклических ариламидов в качестве агонистов никотиновых ацетилхолиновых рецепторов a7», Bioorganic & Medicinal Chemistry , 14 (24): 8219–8248, doi : 10.1016/j. bmc.2006.09.019 , PMID 17011782
- ^ http://www.envivopharma.com - Программа агонистов никотиновых альфа7-ацетилхолиновых рецепторов. Архивировано 7 января 2010 г. в Wayback Machine.
- ^ Jump up to: а б Роллема, Х.; Чемберс, ЛК; Коу, Дж.В.; Глова, Дж.; Херст, РС; Лебель, Луизиана; Лу, Ю.; Мансбах, РС; Мэзер, Р.Дж.; Роветти, CC; Сэндс, СБ; Шеффер, Э.; Шульц, Д.В.; Тэнгли III, Флорида; Уильямс, К.Э. (2007), «Фармакологический профиль частичного агониста никотиновых ацетилхолиновых рецепторов α 4 β 2 варениклина, эффективного средства для прекращения курения», Neuropharmacology , 52 (3): 985–994, doi : 10.1016/j.neuropharm.2006.10 .016 , PMID 17157884 , S2CID 53267460
- ^ Jump up to: а б «ЧАМПИКС 0,5 мг таблетки, покрытые пленочной оболочкой; ЧАМПИКС 1 мг таблетки, покрытые пленочной оболочкой - Краткое описание характеристик продукта (SmPC) - (eMC)» . emc.medicines.org.uk . Архивировано из оригинала 24 декабря 2012 г.
- ^ Гринблатт, HM; Крайгер, Г.; Льюис, Т.; Силман, И.; Сассман, Дж.Л. (1999), «Структура комплекса ацетилхолинэстеразы с (-)-галантамином при разрешении 2,3 ангстрем», FEBS Letters , 463 (3): 321–326, doi : 10.1016/S0014-5793(99)01637-3 , PMID 10606746
- ^ «Реминил XL 8 мг, 16 мг и 24 мг капсулы пролонгированного действия – Краткое описание характеристик продукта (SmPC) – (eMC)» . emc.medicines.org.uk . Архивировано из оригинала 24 декабря 2012 г.
- ^ Дэни, Джон А.; Биази, Мариэлла Де (2001), «Клеточные механизмы никотиновой зависимости», Фармакология, биохимия и поведение , 70 (4): 439–446, doi : 10.1016/S0091-3057(01)00652-9 , PMID 11796143 , S2CID 12960054
- ^ Jump up to: а б с д Ранг, HP (2003), Фармакология , Эдинбург: Черчилль Ливингстон, ISBN 978-0-443-07145-4 Страница 149
- ^ XI, Чжэн-сюн; Спиллер, Криста; Гарднер, Элиот Л. (2009), «Разработка лекарств на основе механизмов для лечения никотиновой зависимости», Acta Pharmacol Sin , 30 (6): 723–739, doi : 10.1038/aps.2009.46 , PMC 3713229 , PMID 19434058 , ПроКвест 213027402
- ^ http://www.accessdata.fda.gov/drugsatfda_docs/label/2004/16968s022lbl.pdf . [ пустой URL PDF ]
- ^ Туба, Золтан; Махо, Сандор; Визи, Э. Сильвестр (2002), «Синтез и взаимосвязи структура-активность нейромышечных блокаторов», Current Medicinal Chemistry , 9 (16): 1507–1536, doi : 10.2174/0929867023369466 , PMID 12171561 , ПроКвест 215095660
- ^ «Анектин для инъекций - Краткое описание характеристик продукта (SmPC) - (eMC)» . emc.medicines.org.uk . Архивировано из оригинала 24 декабря 2012 г.
- ^ Кэрролл, Ф. Айви (2004), «Связь между структурой и активностью эпибатидина», Bioorganic & Medicinal Chemistry Letters , 14 (8): 1889–1896, doi : 10.1016/j.bmcl.2004.02.007 , PMID 15050621
- ^ Если в графах не указано иное, ссылка следующая: Таблица 10-3 в: Род Цветок; Хамфри П. Ранг; Морин М. Дейл; Риттер, Джеймс М. (2007), Фармакология Rang & Dale , Эдинбург: Черчилль Ливингстон, ISBN 978-0-443-06911-6
- ^ Матера, Карло; Папотто, Клаудио; Далланоче, Клелия; Де Амичи, Марко (август 2023 г.). «Достижения в области малых молекул, селективных лигандов для гетеромерных никотиновых рецепторов ацетилхолина» . Фармакологические исследования . 194 : 106813. doi : 10.1016/j.phrs.2023.106813 . hdl : 2434/978688 .
- ^ «Рош – Фармацевтический трубопровод» . Архивировано из оригинала 25 декабря 2009 г. Проверено 21 декабря 2009 г.
- ^ «Memory Pharmaceuticals достигла цели по включению в исследование фазы 2 MEM 3454 при когнитивных нарушениях, связанных с шизофренией» .
- ^ «Разработка лекарств» . Архивировано из оригинала 3 октября 2006 г. Проверено 21 декабря 2009 г.
- ^ «Программы — EnVivo» . Архивировано из оригинала 6 августа 2009 г. Проверено 21 декабря 2009 г.
Внешние ссылки
[ редактировать ]![]() СМИ, связанные с никотиновыми агонистами, на Викискладе?
СМИ, связанные с никотиновыми агонистами, на Викискладе?
- никотиновые + агонисты Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Список агентов MeSH 82018722