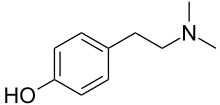
Хорденин
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 4-[2-(Диметиламино)этил]фенол | |
| Другие имена N , N -Диметилтирамин; пейокактин; Анхалин | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.920 |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 10 Н 15 Н О | |
| Молярная масса | 165.236 g·mol −1 |
| Появление | бесцветное твердое вещество |
| Температура плавления | От 116 до 117 ° C (от 241 до 243 ° F; от 389 до 390 К) |
| Точка кипения | 173 ° C (343 ° F; 446 К) при 11 мм рт. ст.; сублимируется при 140–150 °C |
| с высоким содержанием: этанола; эфир; хлороформ | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Горденин — это алкалоид класса фенэтиламинов , который в природе встречается во многих растениях и получил свое название от одного из наиболее распространенных видов — ячменя ( вид Hordeum ). Химически хорденин представляет собой N -метиловое производное и N -метилтирамина N , N - диметиловое производное хорошо известного биогенного амина тирамина , из которого он получен биосинтетически и с которым он разделяет некоторые фармакологические свойства (см. ниже). По состоянию на сентябрь 2012 г. [update]Горденин широко продается в качестве ингредиента пищевых добавок, и утверждается, что он является стимулятором центральной нервной системы и обладает способностью способствовать снижению веса за счет усиления метаболизма. У экспериментальных животных при парентеральном (инъекционном) введении достаточно больших доз горденин действительно вызывает повышение артериального давления , а также другие нарушения сердечно -сосудистой , дыхательной и нервной систем . Эти эффекты обычно не воспроизводятся при пероральном введении препарата подопытным животным, и практически не было опубликовано научных сообщений о влиянии горденина на человека.
Возникновение
[ редактировать ]Первое сообщение об выделении из природного источника соединения, которое теперь известно как горденин, было сделано Артуром Хеффтером в 1894 году, который извлек этот алкалоид из кактуса Anhalonium fissuratus (теперь реклассифицированного как Ariocarpus fissuratus ), назвав его «ангалин». [1] ) алкалоид, названный им хорденином Двенадцать лет спустя Э. Леже независимо выделил из проросших семян ячменя ( Hordeum vulgare . [2] Эрнст Шпет впоследствии показал, что эти алкалоиды идентичны, и предложил правильную молекулярную структуру этого вещества, за которым в конечном итоге было сохранено название «горденин». [3]
Хорденин присутствует в довольно широком спектре растений, особенно среди кактусов. [4] но также был обнаружен в некоторых водорослях и грибах. [5] [6] [7] Он встречается в травах и в значительно высоких концентрациях обнаруживается в проростках зерновых, таких как ячмень ( Hordeum vulgare ) (около 0,2%, или 2000 мкг/г), просо ( Panicum miliaceum ) (около 0,2%) и сорго. ( Sorghum vulgare ) (около 0,1%). [6] Рети в своем обзоре природных фенэтиламинов 1953 года отмечает, что самым богатым источником хорденина является кактус Trichocereus candicans (теперь реклассифицированный как Echinopsis candicans ), который, как было обнаружено, содержит 0,5–5,0% алкалоида. [8]
Поскольку ячмень посредством его преобразования в солод широко используется в производстве пива , пиво и солод исследовались несколькими группами исследователей на наличие горденина. Ссылаясь на исследование Макфарлейна 1965 года, [9] Пучароен сообщил, что пиво содержит ~ 12–24 мг/л, сусло — около 11–13 мг/л, а солод — около 67 мкг/г хорденина. [10] Содержание горденина в различных солодах и солодовых фракциях было тщательно изучено самим Пучароеном, который также хорошо осветил соответствующую литературу до 1983 года. Этот исследователь обнаружил среднюю концентрацию горденина в сыром ячмене. [а] около 0,7 мкг/г; в зеленом солоде (т. е. ячмене, который замачивали в воде в течение 2 дней, а затем проращивали в течение 4 дней) средняя концентрация составляла около 21 мкг/г, а в обожженном солоде (т. е. зеленом солоде, который нагревали в печи в течение 1– 2 дня), средняя концентрация составляла около 28 мкг/г. Когда исследовались только корни зеленого солода, среднее содержание хорденина в них составляло примерно 3363 мкг/г, тогда как средний уровень в корнях обожженного солода составлял около 4066 мкг/г. [10]
В ячмене уровни хорденина достигают максимума через 5–11 дней после прорастания, затем медленно снижаются, пока через месяц не останутся только следы. При этом хорденин локализуется преимущественно в корнях. [11] Поэтому при сравнении литературных значений концентрации хорденина в «ячмене» или ячменном «солоде» следует учитывать возраст и части анализируемого растения: цифра около 2000 мкг/г, приведенная в обзоре Смита, [6] например, согласуется с Пучароеном [10] цифры содержания хорденина в корнях солодового ячменя, но не в «цельном» солоде, где его цифры 21-28 мкг/г более соответствуют цифре Макфарлейна около 67 мкг/г. [9] Однако наблюдается широкий диапазон изменчивости; Исследование, проведенное Ловеттом и его коллегами на 43 различных линиях ячменя, выявило концентрацию хорденина в корнях от 1 до 2625 мкг/г сырого веса. Эти исследователи пришли к выводу, что производство горденина не находится под значительным генетическим контролем, но гораздо более восприимчиво к факторам окружающей среды, таким как продолжительность освещения. [12]
Биосинтез
[ редактировать ]Горденин биосинтезируется путем ступенчатого N -метилирования тирамина , который сначала превращается в N -метилтирамин , а тот, в свою очередь, метилируется до горденина. Первый этап в этой последовательности выполняется ферментом тирамин-N-метилтрансферазой (тираминметилфераза), но неизвестно, отвечает ли тот же фермент за второе метилирование, которое на самом деле производит горденин. [11] [13]
Химия
[ редактировать ]Основность
[ редактировать ]Поскольку молекула хорденина содержит как основную (аминную), так и кислотную (фенольную) функциональные группы, она амфотерна .
Кажущаяся (см. обсуждение в исходной статье) pK as для протонированного хорденина составляет 9,78 (фенольный H) и 10,02 (аммоний H). [14]
Обычные соли — хорденина гидрохлорид, [15] Р-НХ 3 + кл. − , т. пл. 178 °С, и сульфат хорденина, [16] (Р-НХ 3 + ) 2 ТАК 4 2− , т. пл. 211 °С.
« Метилгорденин HCl », указанный в качестве ингредиента на этикетках некоторых пищевых добавок, по всей вероятности, представляет собой просто хорденин гидрохлорид, поскольку «описание» «метилгорденина HCl», данное практически всеми оптовыми поставщиками этого вещества, соответствует тому, что для хорденина гидрохлорида (или, возможно, просто хорденина). [17] пять региоизомерных Названию «метилгорденин HCl», если его интерпретировать по правилам химической номенклатуры, соответствовали бы соединений: α-метилгорденин , β-метилгорденин , 2-метилгорденин , 3-метилгорденин и 4-О. -метилгорденин - каждый в виде его HCl-соли; N -метилгорденин более известен как природный продукт кандицин , но исключен из возможных вариантов, поскольку это четвертичная аммониевая соль , которая не может быть протонирована и, следовательно, не может образовывать гидрохлоридную соль.
Синтез
[ редактировать ]Первый синтез хорденина принадлежит Баргеру: 2-фенилэтиловый спирт сначала превратили в 2-фенилэтилхлорид с помощью PCl 5 ; этот хлорид подвергали взаимодействию с диметиламином с образованием N,N-диметилфенилэтиламина, который затем нитровали с использованием HNO 3 ; N,N-диметил-4-нитрофенэтиламин восстанавливали до N,N-диметил-4-аминофенэтиламина с помощью Sn/HCl; этот амин был окончательно превращен в горденин путем диазотирования/гидролиза с использованием NaNO 2 /H 2 SO 4 /H 2 O. [18]
Более эффективный путь синтеза был описан Чангом и его коллегами, которые также предоставили ссылки на более ранние синтезы. Этот синтез начался с п -метоксифенилэтилового спирта, который одновременно O -деметилировался и превращался в иодид при нагревании с HI; Полученный п-гидроксифенилэтилйодид затем нагревали с диметиламином, получая хорденин. [19]
Радиомеченный хорденин получен гидрированием смеси 2-[ 14 C]-тирамин и 40% формальдегид в присутствии 10% катализатора Pd-на-угле. Таким образом, меченый C в горденине представляет собой C, который является β- по отношению к N. [20]
Горденин с меткой 14 Также был получен C в положении α- к N, [21]
Фармакология
[ редактировать ]Первое зарегистрированное фармакологическое исследование горденина было проведено Хеффтером, который также был первым, кто его изолировал. Используя сульфатную соль (см. «Химия»), Хефтер ввел подкожно дозу 0,3 г кошке массой 2,8 кг (около 107 мг/кг) и не заметил никаких эффектов, кроме сильной рвоты; кот вёл себя нормально в течение 45 минут. Он также сам принял дозу 100 мг перорально, не испытав какого-либо заметного эффекта. Однако было обнаружено, что алкалоид вызывает паралич нервной системы у лягушек. [1]
Работая с сульфатом горденина Леже (см. «Происхождение»), Камю определил минимальные смертельные дозы для собаки, кролика, морской свинки и крысы (см. «Токсикология»). Сопутствующими симптомами токсичности после парентерального введения были: возбуждение, рвота, затруднение дыхания, судороги и паралич, при этом смерть наступала в результате остановки дыхания. [22] В последующей статье Камю сообщил, что внутривенное (в/в) введение нескольких сотен мг хорденинсульфата собакам или кроликам вызывало повышение кровяного давления и изменения ритма и силы сокращений сердца, отметив также, что препарат не был орально активен. [23]
Сердечно-сосудистые и другие эффекты горденина были подробно рассмотрены Райтшелем в 1937 году. [24]
Более современные исследования были проведены Фрэнком и его коллегами, которые сообщили, что внутривенное введение 2 мг/кг горденина лошадям вызывало серьезную респираторную недостаточность, увеличивало частоту дыхания на 250%, удваивало частоту сердечных сокращений и вызывало потоотделение без изменений в базальная температура тела или поведение. Все эффекты исчезли в течение 30 минут. Та же доза горденина, принимаемая перорально, не вызывала каких-либо эффектов, наблюдаемых после парентерального введения. [25]
В исследовании 1995 года Хапке и Стратманн сообщили, что у собак и крыс горденин оказывает положительное инотропное действие на сердце (т.е. увеличивает силу сокращений), повышает систолическое и диастолическое кровяное давление и увеличивает объем периферического кровотока. Движения кишечника были заторможены. Дополнительные эксперименты на изолированной ткани привели исследователей к выводу, что хорденин является адренергическим агентом косвенного действия, который оказывает свое фармакологическое действие путем высвобождения накопленного норадреналина (НЭ). [26]
Было обнаружено, что хорденин является селективным субстратом для МАО-В из печени крыс с K m = 479 мкМ и V max = 128 нМ/мг белка/ч. Он не дезаминировался МАО-А из эпителия кишечника крыс. [27]
В отличие от тирамина , хорденин не вызывал сокращения изолированных семявыносящих протоков крысы , но концентрация препарата в 25 мкМ усиливала его ответ на субмаксимальные дозы НЭ и ингибировала его ответ на тирамин. реакцию на НЭ изолированных семявыносящих протоков, взятых у крыс, хронически получавших гуанетидин Однако хорденин не влиял на . Исследователи пришли к выводу, что горденин действует как ингибитор обратного захвата NE в семявыносящих протоках крыс. [27]
Было обнаружено, что хорденин является мощным стимулятором высвобождения гастрина у крыс, будучи по существу эквивалентным N-метилтирамину : 83 нМ/кг горденина (что соответствует примерно 14 мг/кг свободного основания), усиливая высвобождение гастрина примерно на 60%. . [28]
В исследовании воздействия большого количества соединений на крысиный аминный рецептор (rTAR1), экспрессируемый в клетках HEK 293 , хорденин в концентрации 1 мкМ имел почти идентичную эффективность с активностью β-фенетиламина той же концентрации. в стимуляции продукции цАМФ посредством rTAR1. Активность тирамина в этом препарате рецепторов была немного выше, чем активность хорденина. [29]
Токсикология
[ редактировать ]LD 50 у мышей при внутрибрюшинном (IP) введении: 299 мг/кг. [30] Другие значения ЛД 50, приведенные в литературе: >100 мг/кг (мышь; ИП), [31] в виде соли HCl: 113,5 мг/кг (мышь; путь введения не указан) [32] Минимальная смертельная доза (в виде сульфатной соли): 300 мг/кг (собака; внутривенно); 2000 мг/кг (собаки, перорально); 250 мг/кг (кролик; в/в); 300 мг/кг (морская свинка; в/в); 2000 мг/кг (морская свинка; подкожно); около 1000 мг/кг (крыса; подкожно). [22]
В ходе экспериментов, направленных на выявление токсина, ответственного за возникновение двигательных нарушений («пошатывание») и быстролетального сердечного токсикоза («внезапная смерть»), периодически наблюдаемых у домашнего скота, питающегося травой Phalaris aquatica , австралийские исследователи установили, что самые низкие дозы горденина вызывало симптомы «пошатывания» у овец: 20 мг/кг внутривенно и 800 мг/кг перорально. Однако горденин не мог выявить сердечные симптомы «внезапной смерти». [33]
Хотя хорденин способен реагировать с нитрозирующими агентами (например, нитрит- ионом, NO 2 − ) с образованием канцерогена N -нитрозодиметиламина (НДМА) и исследовался как возможный предшественник значительного количества НДМА, когда-то обнаруженного в пиве. [10] в конечном итоге было установлено, что уровни хорденина, присутствующего в солоде, были слишком низкими, чтобы объяснить наблюдаемые уровни NDMA. [34]
Фармакокинетика
[ редактировать ]Фармакокинетика горденина изучалась на лошадях. Было обнаружено , что после внутривенного введения препарата Т 1/2 α-фазы составляет около 3 минут, а Т 1/2 β-фазы составляет около 35 минут. [25]
Взаимодействие с насекомыми
[ редактировать ]Было обнаружено, что хорденин действует как средство отпугивания кузнечиков ( Melanoplus bivittatus ), [35] и гусеницам Heliothis virescens и Heliothis subflexa ; расчетная концентрация хорденина, которая сокращала продолжительность кормления до 50% от контроля, составляла 0,4М для H. virescens и 0,08М для H. subflexa . [36]
Взаимодействие растений
[ редактировать ]Горденин обладает некоторыми свойствами, ингибирующими рост растений: Лю и Ловетт сообщили, что в концентрации 50 частей на миллион он уменьшал длину корешков у проростков белой горчицы ( Sinapis alba ) примерно на 7%; примесь с равным количеством грамина заметно усиливала этот ингибирующий эффект. [37]
См. также
[ редактировать ]- Тирамин
- N-Метилтирамин
- Кандицин
- N,N-диметилдофамин
- 4-гидроксимфетамин
- холедрин
- О-десметилвенлафаксин
- Венлафаксин
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Хеффтер, А. (1894). «Уэбер Пеллоте». Арх. Эксп. Патол. Фармакол . 34 :6586.
- ^ Леже, Э. (1906). «О хорденине: новый алкалоид, выделенный из зародышей ячменя, называемых накатками». Счет Возвращает. (на французском языке). 142 : 108–10.
- ^ Шпет, Э. (1919). «Об алкалоидах ангалония. I. Анхалин и мескалин». Ежемесячные журналы по химии (на немецком языке). 40 (2): 129–54. дои : 10.1007/BF01524590 . S2CID 104408477 .
- ^ «Визионерский путеводитель по кактусам» . erowid.org . Проверено 14 января 2021 г.
- ^ Уитон, штат Техас; Стюарт, И. (июнь 1970 г.). «Распределение тирамина, N-метилтирамина, хорденина, октопамина и синефрина в высших растениях». Ллойдия . 33 (2): 244–54. ПМИД 5495514 .
- ^ Jump up to: а б с Смит, Т.А. (1977). «Фенэтиламин и родственные соединения в растениях». Фитохимия . 16 :9–18. дои : 10.1016/0031-9422(77)83004-5 .
- ^ Лундстрём, январь (1989). Глава 2 β-Фенэтиламины и эфедрины растительного происхождения . Алкалоиды: химия и фармакология. Том. 35. С. 77–154. дои : 10.1016/S0099-9598(08)60123-6 . ISBN 9780124695351 .
- ^ Рети, Л. (1953). Глава 22 β-Фенэтиламины . Алкалоиды: химия и физиология. Том. 3. С. 313–338. дои : 10.1016/S1876-0813(08)60144-X . ISBN 9780124695030 .
- ^ Jump up to: а б Макфарлейн, WD (1965). «Амины и фенолы, производные тирозина, в сусле и пиве». Учеб. Европа. Заварить. Конв. : 387.
- ^ Jump up to: а б с д и Пучароен, Бунтонг (1983). Определение некоторых алкалоидов вторичных и третичных аминов в ячменном солоде (Диссертация). HDL : 1957/27227 .
- ^ Jump up to: а б Манн, Джей Д.; Мадд, С. Харви (январь 1963 г.). «Алкалоиды и обмен веществ растений» . Журнал биологической химии . 238 (1): 381–385. дои : 10.1016/S0021-9258(19)84008-5 .
- ^ Ловетт, Джон В.; Холт, Энн ХК; Кристен, Олаф (август 1994 г.). «Биологически активные вторичные метаболиты ячменя. IV. Продукция горденина разными линиями ячменя». Журнал химической экологии . 20 (8): 1945–1954. дои : 10.1007/BF02066235 . ПМИД 24242721 . S2CID 6435423 .
- ^ «Метаболизм тирозина – Эталонный путь» . Киотская энциклопедия генов и геномов – через genome.jp.
- ^ Каппе, Томас; Армстронг, Марвин Д. (май 1965 г.). «Спектры ультрафиолетового поглощения и кажущиеся константы кислотной диссоциации некоторых фенольных аминов 1». Журнал медицинской химии . 8 (3): 368–374. дои : 10.1021/jm00327a018 . ПМИД 14323148 .
- ^ Номер CAS 6027-23-2.
- ^ Номер CAS 622-64-0.
- ^ См., например: http://www.alibaba.com/showroom/methyl-hordenine-hcl.html.
- ^ Баргер, Джордж (1909). «CCXXXV. — Синтез хорденина, алкалоида ячменя» . Дж. Хим. соц., пер . 95 : 2193–2197. дои : 10.1039/CT9099502193 .
- ^ Ченг, Чао-Шин; Фербер, Клаус; Башфорд, Раймонд И.; Грилло, Джеральд Ф. (сентябрь 1951 г.). «Новый синтез горденина и других п-диалкиламиноэтилфенолов и некоторых их производных». Журнал Американского химического общества . 73 (9): 4081–4084. дои : 10.1021/ja01153a008 .
- ^ Дигенис, Джордж А.; Беркетт, JW; Мигранян, В. (апрель 1972 г.). «Удобный синтез 2 - [ 14 C] - хорденин». Журнал меченых соединений . 8 (2): 231–235. doi : 10.1002/jlcr.2590080208 .
- ^ Руссо, Калифорния; Грос, Э.Г. (август 1981 г.). «Синтез 4-|2-(диметиламино)этил-2- 14 С | фенол (горденин-α- 14 C)». Журнал меченых соединений и радиофармацевтических препаратов . 18 (8): 1185–1187. doi : 10.1002/jlcr.2580180813 .
- ^ Jump up to: а б Л. Камю (1906). «Харденин, степень его токсичности, симптомы отравления». Счет Возвращает. 142 110-113.
- ^ Л. Камю (1906), «Действие хорденинсульфата на кровообращение». Счет Возвращает. 142 237-239.
- ^ Ритшель, Ханс Георг (1 марта 1937 г.). «К фармакологии хорденина». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга (на немецком языке). 186 (2): 387–408. дои : 10.1007/BF01929674 . S2CID 37359919 .
- ^ Jump up to: а б Франк, М.; Векман, Ти Джей; Вуд, Т.; Вудс, МЫ; Тай, Чен Л.; Чанг, Ши-Линг; Юинг, А.; Блейк, JW; Тобин, Т. (ноябрь 1990 г.). «Горденин: фармакология, фармакокинетика и поведенческие эффекты у лошадей» (PDF) . Ветеринарный журнал лошадей . 22 (6): 437–441. дои : 10.1111/j.2042-3306.1990.tb04312.x . ПМИД 2269269 .
- ^ Хапке, HJ; Стратманн, W (июнь 1995 г.). «Фармакологические эффекты хорденина». Немецкий ветеринарный еженедельник (на немецком языке). 102 (6): 228–232. ОСЛК 121700602 . ПМИД 8582256 .
- ^ Jump up to: а б Барвелл, CJ; Басма, АН; Лафи, МАК; Лик, LD (12 апреля 2011 г.). «Дезаминирование горденина моноаминоксидазой и его действие на семявыносящие протоки крысы». Журнал фармации и фармакологии . 41 (6): 421–423. дои : 10.1111/j.2042-7158.1989.tb06492.x . ПМИД 2570842 . S2CID 10301433 .
- ^ Йоко, Ю.; Кода, Х.; Кусумото, А.; Наоки, Х.; Мацумото, Н.; Амачи, Т.; Сува, Ю.; Фукадзава, Х.; Исида, Х.; Цудзи, К.; Нукая, Х. (1 марта 1999 г.). «Выделение из пива и структурное определение мощного стимулятора высвобождения гастрина» . Алкоголь и алкоголизм . 34 (2): 161–168. дои : 10.1093/alcalc/34.2.161 . ПМИД 10344776 .
- ^ Бунзоу, Джеймс Р.; Сондерс, Марк С.; Арттамангкул, Сексири; Харрисон, Лаура М.; Чжан, Ге; Куигли, Дениз И.; Дарланд, Тристан; Сучленд, Кэтрин Л.; Пасумамула, Шайладжа; Кеннеди, Джеймс Л.; Олсон, Сьюзен Б.; Магенис, Р. Эллен; Амара, Сьюзен Г.; Гранди, Дэвид К. (1 декабря 2001 г.). «Амфетамин, 3,4-метилендиоксиметамфетамин, диэтиламид лизергиновой кислоты и метаболиты катехоламиновых нейротрансмиттеров являются агонистами аминных рецепторов крысиных следов». Молекулярная фармакология . 60 (6): 1181–1188. дои : 10.1124/моль.60.6.1181 . ПМИД 11723224 . S2CID 14140873 .
- ^ Шинода, Масато; Сэцуко; Такаги, Ёсинари (1977). . Радиозащитная активность соединений фенэтиламина ». Якугаку Засши (на японском языке). Исследования химических средств защиты от радиации. XVII « .дои / : 10.1248 . PMID 592104 yakushi1947.97.10_1117
- ^ Батиста, Леония Мария; Алмейда, Р. Нобрега де (1997). «Центральные эффекты компонентов Mimosa ophthalmocentra Mart. ex Benth» (PDF) . Акта Фармасьютика Бонаэренсе . 16 (2): 83–86.
- ^ Индекс Merck (10-е изд.). Рэуэй, Нью-Джерси: Merck & Co., 1983. с. 687.
- ^ Бурк, Калифорния; Кэрриган, Mj; Диксон, Р.Дж. (июль 1988 г.). «Экспериментальные доказательства того, что алкалоиды триптамина не вызывают синдром внезапной смерти Phalaris aquatica у овец». Австралийский ветеринарный журнал . 65 (7): 218–220. дои : 10.1111/j.1751-0813.1988.tb14462.x . ПМИД 3421887 .
- ^ Пучароен, Бунтонг; Барбур, Джеймс Ф.; Либби, Леонард М.; Сканлан, Ричард А. (ноябрь 1992 г.). «Предшественники N-нитрозодиметиламина в солодовом ячмене. 1. Определение горденина и грамина». Журнал сельскохозяйственной и пищевой химии . 40 (11): 2216–2221. дои : 10.1021/jf00023a033 .
- ^ Харли, КЛС; Торстейнсон, AJ (1 мая 1967 г.). «Влияние растительных химикатов на пищевое поведение, развитие и выживание двуполосого кузнечика Melanoplus bivittatus (Say), Acrididae: Orthoptera». Канадский журнал зоологии . 45 (3): 305–319. дои : 10.1139/z67-043 .
- ^ Бернейс, Э.А.; Оппенгейм, С.; Чепмен, РФ; Квон, Х.; Гулд, Ф. (1 февраля 2000 г.). «Вкусовая чувствительность травоядных насекомых к отпугивающим факторам выше у специалистов, чем у универсалов: поведенческая проверка гипотезы с двумя тесно связанными гусеницами». Журнал химической экологии . 26 (2): 547–563. дои : 10.1023/А:1005430010314 . S2CID 5695174 .
- ^ Лю, Д.Л.; Ловетт, СП (октябрь 1993 г.). «Биологически активные вторичные метаболиты ячменя. II. Фитотоксичность аллелохимических веществ ячменя». Журнал химической экологии . 19 (10): 2231–2244. дои : 10.1007/BF00979660 . ПМИД 24248572 . S2CID 8193525 .