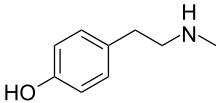
N -Метилтирамин
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 4-[2-(Метиламино)этил]фенол | |
| Другие имена Метил-4-тирамин; 4-гидрокси- N -метилфенэтиламин; п- (2-Метиламиноэтил)фенол | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.006.120 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| C9H13NC9H13NO | |
| Молярная масса | 151.209 g·mol −1 |
| Появление | бесцветное кристаллическое твердое вещество |
| Плотность | 1,03 г/мл |
| Температура плавления | От 130 до 131 ° C (от 266 до 268 ° F; от 403 до 404 К) |
| Точка кипения | 271 °C (520 °F; 544 К) (183–185 °C на расстоянии 9 мм; 135 °C на расстоянии 0,05 мм) |
| умеренно растворим в воде | |
| Опасности | |
| точка возгорания | 120 ° С (248 ° F; 393 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
N -Метилтирамин ( NMT ), также известный как 4-гидрокси- N -метилфенэтиламин , представляет собой микроэлемент человеческого амина. [1] [2] и природный фенэтиламин, алкалоид содержащийся в различных растениях. [3] Как следует из названия, это N-метиловый аналог тирамина , который является хорошо известным биогенным следовым амином, с которым NMT имеет много общих фармакологических свойств. Биосинтетически NMT производится путем N- метилирования тирамина под действием фермента фенилэтаноламин N -метилтрансферазы у человека. [1] [2] и тирамин -N -метилтрансфераза у растений. [4]
Возникновение
[ редактировать ]N-метилтирамин, по-видимому, довольно широко распространен в растениях. [3] [5]
выделен как натуральный продукт НМТ был впервые из прорастающих корней ячменя Кирквудом и Мэрионом в 1950 году. Эти химики обнаружили, что 600 г ячменя после прорастания и 10-дневного роста дали 168 мг N-метилтирамина. [6] Поскольку ячмень посредством его преобразования в солод широко используется в производстве пива , пиво и солод исследовались несколькими группами исследователей на наличие NMT. Ссылаясь на исследование Макфарлейна 1965 года, [7] Пучароен сообщил, что пиво содержит ~ 5–8 мг/л NMT. [8] Содержание NMT в различных солодах и солодовых фракциях было тщательно изучено самим Пучароеном, который также хорошо осветил соответствующую литературу до 1983 года. Этот исследователь обнаружил среднюю концентрацию NMT в сыром ячмене. [9] ~ 5 мкг/г; в зеленом солоде (т. е. ячмене, который замачивали в воде в течение 2 дней, а затем проращивали в течение 4 дней) средняя концентрация составляла ~ 21 мкг/г, а в обожженном солоде (т. е. зеленом солоде, который нагревали в печи в течение 1– 2 дня) средняя концентрация составила ~ 27 мкг/г. Когда исследовались только корни зеленого солода, среднее содержание в них НМТ составляло ~ 1530 мкг/г, тогда как средний уровень в корнях обожженного солода составлял ~ 1960 мкг/г. [8]
Исследования видов акации показали наличие значительных уровней NMT в их листьях: ~ 240-1240 ppm (или мкг/г) у A.rigidula. [10] и ~190-750 м.д. у A. berlandieri . [11] Семена A. schweinfurthii давали 440 мкг/г NMT. [12]
NMT обнаружен в горьком апельсине , Citrus aurantium , а его концентрация составляет ~ 180 мкг/г в экстракте, полученном из спелых фруктов, хотя метод получения этого экстракта не очень четко описан. [13]
Химия
[ редактировать ]Синтез
[ редактировать ]NMT синтезировали разными способами. Об одном из самых ранних синтезов сообщил Уолпол, который осуществил его с помощью следующей последовательности стадий: (i) ацетилирование 4-метоксифенэтиламина уксусным ангидридом; (ii) метилирование амида с использованием Na/метилйодида; (iii) расщепление метилового эфира до фенола с помощью HI; (iv) гидролиз N-ацетильной группы водным раствором HCl. Уолпол также описал альтернативную, но аналогичную последовательность реакций, приводящих к NMT, начиная с превращения 4-метоксифенэтиламина в его бензолсульфонамид, который затем N-метилируется и снимается защита. [15]
Другой метод получения NMT был предложен Корти, который приготовил его термическим декарбоксилированием N-метилтирозина (ратанхина) путем нагревания аминокислоты во флуорене при 250 ° C. Хотя N-метилтирозин встречается в природе, он был получен путем метилирования тирозина с помощью диметилсульфата. [16]
NMT также был получен Кирквудом и Мэрионом из 4-метоксифенэтиламина, но сначала он был преобразован в имин с помощью бензальдегида с последующим метилированием диметилсульфатом ; продукт превращали в N-метил-4-метоксифенэтиламин и, наконец, де-O-метилировали HBr с получением N-метилтирамина. [6]
Общие соли
[ редактировать ]N -метилтирамин гидрохлорид, C 9 H 13 NO.HCl: т.пл. 148,5°С; хорошо растворим в воде и этаноле. [15]
N -метилтирамин гидрооксалат, C 9 H 13 NO.C 2 H 2 O 4 : т. пл. 250°С; очень плохо растворяется в воде. [15]
Основность
[ редактировать ]Кажущаяся (обсуждение см. в исходной статье) pK as для протонированного N -метилтирамина составляет 9,76 (фенольный H) и 10,71 (аммоний H). [17]
Фармакология
[ редактировать ]НМТ является прессорным средством с эффективностью 1/140 × адреналина . [18] На основании экспериментов на собаках Хьорт описал НМТ как «очень хороший прессорный агент»: повышение артериального давления >130 мм и длительностью около 5 минут вызывалось инъекцией 1-2,5 мкМ растворов соли HCl в собаки весом ~10 кг. [19] Кэмп сообщил о прессорной реакции, которая ингибировалась предварительной обработкой резерпином на введение NMT козам. [20]
Подкожное введение мышам 10 мг/кг HCl-соли NMT увеличивало высвобождение норадреналина (NE) из сердца на 36% по сравнению с контролем, измеренное через 2 часа. Для сравнения, в этом анализе та же доза гидрохлорида тирамина вызывала высвобождение NE на 50% по сравнению с контролем. [21] Качественно аналогичное снижение содержания НЭ в сердце крыс после обработки НМТ наблюдал Кэмп. [20]
Не вдаваясь в детали эксперимента, Evans et al. сообщили, что NMT повышал кровяное давление у крыс, подавлял электрически индуцированные сокращения подвздошной кишки морской свинки, расслаблял стимулируемый ацетилхолином тонус изолированной трахеальной мышцы морской свинки и увеличивал скорость и силу сокращения изолированного предсердия морской свинки. Влияние на артериальное давление конкурентно противодействовало гуанетидину , тогда как воздействие на изолированное предсердие ингибировалось дезипрамином . Хотя дозы не были назначены, НМТ был описан как эквивалентный тирамину по воздействию на все ткани. Также было отмечено, что обращение с НМТ вызвало мигрень . у одного из исследователей [12]
Было обнаружено, что NMT является мощным стимулятором высвобождения гастрина у крыс с [[ED 50 ]] ~ 10 мкг/кг. [22] Эти исследователи использовали процедуру выделения под контролем биоанализа, чтобы показать, что NMT является компонентом пива, который отвечает за повышенное высвобождение гастрина, что, в свою очередь, повышает секрецию желудочной кислоты . Для сравнительных целей они также протестировали тирамин и N,N-диметилтирамин ( горденин ) в своем анализе, обнаружив, что 83 нМ/кг (что соответствует 12,5 мкг/кг NMT) каждого соединения усиливают высвобождение гастрина примерно на 58% для NMT. ~24% для тирамина и ~60% для хорденина.
Чтобы проверить данные более ранних исследований о том, что, как и сам тирамин, НМТ оказывает большую часть своих фармакологических эффектов за счет стимуляции высвобождения норадреналина (НЭ), Кода и его коллеги исследовали действие НМТ на α2 - адренорецепторы , которые участвуют в регулирование НЭ. Эти исследователи обнаружили, что NMT конкурирует со связыванием [ 3 H] -p-аминоклонидин к α2 - рецепторам мозга крысы с IC50 ~ 5,5×10. −6 как и другие антагонисты α 2 М. Было обнаружено, что, , NMT в внутрибрюшинных дозах 20 или 100 мг/кг ингибирует гипермобильность, индуцированную у мышей (-)- скополамином , дозозависимым образом. Те же дозы НМТ в отсутствие скополамина не оказали существенного влияния на двигательную активность мышей. [23]
Поскольку NMT является одним из компонентов горького апельсина, Citrus aurantium , Меркадер и его коллеги изучили его влияние на липолиз и обнаружили, что он ингибирует липолиз у крыс. НМТ (вместе с тирамином) также не смог стимулировать липолиз в адипоцитах человека в концентрации 10 мкг/мл (т.е. ~ 66 мкМ/л); даже при концентрации ≥ 100 мкг/мл НМТ и тирамин индуцировали только 20% липолиза, вызываемого эталонным препаратом изопреналином . [24]
НМТ является конкурентным субстратом для МАО . [25]
Известно, что он является стимулятором секреции поджелудочной железы у крыс. [26]
Было показано, что NMT является , подобно агонистом TAAR1 его исходному соединению тирамину . [27] EC 50 NMT на рецепторе TAAR1 человека составляла ~ 2 мкМ по сравнению с ~ 1 мкМ для тирамина . [28]
Фармакокинетика
[ редактировать ]Фармакокинетика НМТ изучалась на кроликах и мышах с использованием препарата, по С радиоактивно меченного тритием -3 и С-5 бензольного кольца. Концентрации в плазме измеряли у кроликов, тогда как распределение, метаболизм и выведение определяли у мышей. Было обнаружено, что после внутривенного введения кроликам Т 1/2 β-фазы α-фазы составлял 0,3 минуты, а Т 1/2 составлял 5,6 минуты. Эти цифры свидетельствовали о быстром распространении из крови в ткани и очень коротком периоде полувыведения из плазмы. В течение 2 минут после инъекции значительные уровни радиоактивности были обнаружены во всех исследованных тканях, причем самые высокие уровни были обнаружены в почках и печени. Через 30 минут в плазме не осталось обнаруживаемой радиоактивности. Некоторое количество NMT было обнаружено в мозгу мышей, получавших препарат, что указывает на то, что небольшое его количество действительно проникло через гематоэнцефалический барьер . ~ 80% введенной дозы выводилось из мочи мышей в течение 1 часа. [29]
Токсикология
[ редактировать ]LD 50 HCl соли NMT (мышь; внутрибрюшинно) = 227 мг/кг. [18] Другое исследование острой токсичности NMT (под кодом компании Sterling-Winthrop «WIN 5582») показало, что его ЛД 50 = 275 мг/кг после внутривенного введения мышам. [30]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Перейти обратно: а б с д Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Перейти обратно: а б Т. А. Смит (1977). «Фенэтиламин и родственные соединения в растениях». Фитохимия 16 9 – 18.
- ^ Метаболизм тирозина - Справочный путь. Архивировано 26 июля 2019 г. в Wayback Machine , Киотской энциклопедии генов и геномов (KEGG).
- ^ Т. А. Стюарт и И. Стюарт (1970) Ллойдия 33 244-254.
- ^ Перейти обратно: а б С. Кирквуд и Л. Мэрион (1950) J. Am. хим. Соц. 72 2522-2524.
- ^ WD Макфарлейн (1965). «Амины и фенолы, производные тирозина, всусло и пиво». Proc. Europ. Brew. Conv. 387.
- ^ Перейти обратно: а б Б. Пучароен (1983), докторская диссертация, Университет штата Орегон. http://ir.library.oregonstate.edu/xmlui/handle/1957/27227
- ^ Уровень NMT в непроросшем ячмене, как правило, незначителен, но повышается по мере прорастания (первая часть процесса «соложения»).
- ^ BA Клемент, CM Goff и TDA Forbes (1998). «Токсичные амины и алкалоиды акации жесткой ». Фитохимия 49 1377-1380.
- ^ Б. А. Клемент, К. М. Гофф и TDA Forbes (1997) Фитохимия 46 249-254.
- ^ Перейти обратно: а б К.С. Эванс, Э.А. Белл и Э.С. Джонсон (1979) Фитохимия 18, 2022–2023 гг.
- ^ BC Нельсон и др. (2007) Дж. Агрик. Фд. хим. 55 9769-9775.
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Перейти обратно: а б с Г.С. Уолпол (1910) J. Chem. Соц., Пер. 97 941-999.
- ^ UA Corti (1949) Helv. Хим. Акта 32 681-686.
- ^ Т. Каппе и доктор медицины Армстронг (1965) J. Med. хим. 8 368-374.
- ^ Перейти обратно: а б WH Hartung (1945) Индийско-англ. хим. 37 126-137.
- ^ AJ Hjort (1934) J. Pharmacol. Эксп. Там. 101-112 .
- ^ Перейти обратно: а б Би Джей Кэмп (1970) Am. Дж. Вет. Рез. 31 755-762.
- ^ JW Daly, CR Creveling и B. Witkop (1966) J. Med. хим. 9 273-280.
- ^ Ю. Йоко и др. (1999) Алкоголь и алкоголизм 34 161-168. http://alcalc.oxfordjournals.org/content/34/2/161.full.pdf+html
- ^ Х. Кода и др. (1999) Япония. Дж. Фармакол. 81 313-315.
- ^ Дж. Меркадер, Э. Ванек, Дж. Чен и К. Карпен (2011) J. Physiol. Биохим. 67 443-452.
- ^ В. Кеммерлинг (1996) З. Натурфорш. С 51 59-64.
- ^ Цуцуми, Э.; Канаи, С.; Охта, М.; Сува, Ю.; Миясака, К., Эри; Канаи, Сэцуко; Охта, Минору; Сува, Ёсихидэ; Миясака, Кёко (2010). «Стимулирующее действие N-метилтирамина, производного пива, на секрецию поджелудочной железы у находящихся в сознании крыс». Алкоголизм: клинические и экспериментальные исследования . 34 (Приложение 1): С14–С17. дои : 10.1111/j.1530-0277.2009.00893.x . ПМИД 19298333 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Линдеманн, Л.; Хонер, MC (2005). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Л. Линдеманн и др. (2005) Геномика 85 372-385.
- ^ Х. Хай, З.-Г. Го и Ж.-М. Ван (1989) Чжоугго Яо Ли Сюэ Бао (Acta Pharmacologica Sinica) 10 . http://www.chinaphar.com/1671-4083/ 10/41.pdf
- ^ AM Lands и JI Grant (1952). «Вазопрессорное действие и токсичность производных циклогексилэтиламина». Дж. Фармакол. Эксп. Там. 106 341-345.
