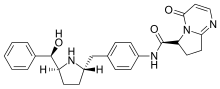
Вибегрон
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Гемтеса |
| Другие имена | КРП-114В, МК-4618, РВТ-901, УРО-901 |
| AHFS / Drugs.com | Монография |
| Данные лицензии | |
| Маршруты администрация | Через рот |
| Класс препарата | Агонист бета3-адренергических рецепторов |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Связывание с белками | От 49,6 до 51,3% связывается с белками плазмы. [4] |
| Метаболизм | Преимущественно окисление и глюкуронидация [4] |
| Период полувыведения | от 60 до 70 часов [4] |
| Экскреция | 59% фекалий (54% из них в неизмененной исходной лекарственной форме), 20% мочи (19% из них в неизмененной исходной лекарственной форме) [1] |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.210.547 |
| Химические и физические данные | |
| Формула | С 26 Н 28 Н 4 О 3 |
| Молярная масса | 444.535 g·mol −1 |
| 3D model ( JSmol ) | |
Вибегрон , продаваемый под торговой маркой Gemtesa , представляет собой препарат для лечения гиперактивного мочевого пузыря . [1] [5] [6] Вибегрон — селективный бета-3-адренорецепторов агонист . [1]
Наиболее распространенные побочные эффекты включают головную боль, инфекцию мочевыводящих путей , простуду , диарею, тошноту и инфекцию верхних дыхательных путей . [5]
Вибегрон был впервые обнаружен учеными компании Merck & Co. Inc. [7] и позже был разработан в Японии компаниями Kyorin Pharmaceutical Co., Ltd, Kissei Pharmaceutical Co., Ltd и Urovant Sciences. [8] Он был одобрен для медицинского использования в Японии в сентябре 2018 года. [8] в США в декабре 2020 года, [1] [5] [6] и в Европейском Союзе в июне 2024 года. [2]
Эффективность
[ редактировать ]Вибегрон в дозе 75 мг один раз в день приводил к значительному уменьшению частоты мочеиспусканий, эпизодов императивных позывов и позывного недержания, а также увеличивал объем мочеиспускания. [9]
Медицинское использование
[ редактировать ]Вибегрон показан для лечения гиперактивного мочевого пузыря с симптомами ургентного недержания мочи, позывов и частоты мочеиспускания у взрослых. [1] [5] [6]
Безопасность
[ редактировать ]В целом, введение агонистов β3-адренергических рецепторов, таких как вибегрон, улучшило лечение гиперактивного мочевого пузыря (ГАМП) за счет минимизации побочных эффектов, связанных с антихолинергическими препаратами. [10] Монотерапия β3-адренергическими агонистами может быть предпочтительной у пожилых пациентов, пациентов с высокой антихолинергической нагрузкой и пожилых людей с множественными сопутствующими заболеваниями. [11] Исследование амбулаторного мониторинга артериального давления показало, что лечение вибегроном не было связано с клинически значимым воздействием на артериальное давление или частоту сердечных сокращений. Лечение вибегроном также было связано с улучшением показателей качества жизни, о которых сообщали пациенты. Вибегрон в целом эффективен, безопасен и хорошо переносится, поэтому представляет собой ценный вариант лечения пациентов с ГМП. [12]
Побочные эффекты
[ редактировать ]Наиболее распространенными побочными эффектами вибегрона являются сухость во рту, запор, головная боль, назофарингит , диарея, тошнота, бронхит , инфекции мочевыводящих путей и инфекции верхних дыхательных путей . В случае задержки мочи пациенту следует прекратить применение препарата. Оценка риска применения препарата у беременных еще не оценена. [1]
Взаимодействия
[ редактировать ]Вибегрон, в отличие от других препаратов ГАМП, очень селективен и приводит к меньшей степени нежелательных побочных эффектов. Обнаружено, что вибегрон является субстратом для CYP3A4 in vivo, но фактически не индуцирует и не ингибирует ни один из ферментов цитохрома P450 и, следовательно, с меньшей вероятностью принимает участие во взаимодействиях между лекарствами (DDI). В этом отношении вибегрон отличается от предыдущего препарата мирабегрона, применяемого при гиперактивном мочевом пузыре, который, как известно, участвует в различных лекарственных взаимодействиях, ингибируя CYP2D6 или индуцируя CYP3A4, CYP2D6 и CYP2C9 в печени. [13] [4] [14] [15] [16] [17]
Использование только вибегрона (монотерапия) оказывает положительное влияние на ГМП и НМО, но комбинация с другими препаратами может иметь дополнительные эффекты. В исследовании антимускариновых препаратов большее количество DDI было исследовано на модели макак-резус. Комбинации доз вибегрона и толтеродина показали увеличение емкости мочевого пузыря, эффекты обоих препаратов в низких дозах усиливали друг друга, что известно как синергизм. Добавление дарифенацина к вибегрону вызывало большее расслабление мочевого пузыря только при использовании в высоких дозах. [18] Кроме того, одновременное применение имидафенацина приводит к увеличению емкости мочевого пузыря и объема мочеиспускания по сравнению с монотерапией. [18] лечения станет комбинация бета-3-адренергического агониста с неселективным антагонистом М2 / М3 . Возможно, наиболее распространенным вариантом [4]
Клинические исследования не выявили значимого межлекарственного взаимодействия, за исключением повышения концентрации дигоксина в сыворотке крови при приеме вибегрона. В результате DDI увеличиваются максимальные концентрации и системная экспозиция (Cmax и площадь под кривой (AUC)) дигоксина. [19] [1] Помимо отсутствия или небольшого количества DDI, вибегрон обладает дополнительным качеством безопасности, поскольку он не проникает через гематоэнцефалический барьер и, следовательно, не вызывает когнитивных нарушений. [4] Кроме того, вибегрон можно принимать независимо от приема пищи, это не влияет на концентрацию вибегрона в плазме. [1] [19]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Вибегрон – селективный агонист бета-3-адренергических рецепторов. Рецепторы расположены в почках, мочевыводящих путях и тканях мочевого пузыря. [20] При связывании рецептор β3 претерпевает конформационные изменения. Это индуцирует активацию аденилатциклазы через G-белки и тем самым способствует образованию циклического аденозинмонофосфата (цАМФ). Следствием этого каскада является повышение внутриклеточной концентрации цАМФ, что запускает активацию цАМФ-зависимой протеинкиназы А и вызывает снижение концентрации Са2+ в цитоплазме . Затем киназа фосфорилирует цепи миозина и тем самым ингибирует мышечные сокращения. [4]
Конечным эффектом вибегрона является расслабление мышц мочевого пузыря. Благодаря расслаблению мышц увеличивается емкость мочевого пузыря и уменьшаются симптомы гиперактивного мочевого пузыря. [17]
Фармакокинетика
[ редактировать ]Двумя основными метаболическими путями являются окисление и глюкуронидация вибегрона. Могут образовываться два окислительных метаболита и три глюкуронидных метаболита. Точная структура этих метаболитов еще не изучена. [4] In vitro CYP3A4 является ферментом, ответственным за метаболизм вибегрона, способствуя окислительному метаболизму. В конечном итоге большая часть немодифицированного препарата выводится через кал и мочу. [1]
История
[ редактировать ]Бета -3-адренорецептор (бета3АР) был открыт в конце 1980-х годов. [20] Первоначально агонисты бета3АР исследовались в качестве средства лечения ожирения и диабета. [21] Ряд соединений был протестирован в клинических испытаниях, но не показал достаточных преимуществ в этих областях. [21]
Глобальное исследование фазы IIb , завершенное в 2013 году с участием 1395 пациентов, из которых 89,7% составляли женщины и 63,3% ранее не лечились, продемонстрировало значительное снижение ежедневных мочеиспусканий и эпизодов ургентного недержания мочи после приема вибегрона. [22] [13]
Международное исследование III фазы с участием 506 участников, завершенное в 2019 году, выявило статистически значимую эффективность вибегрона после двух недель ежедневного приема. Частота побочных эффектов у участников, принимавших вибегрон, была сопоставима с таковой у участников, получавших плацебо. [23]
Вибегрон оценивался у пациентов с ГМП в нескольких клинических исследованиях. Крупное исследование под активным контролем под названием Empower показало благотворное влияние препарата на лечение этого заболевания и недержания мочи. [1] [4] Первичные результаты различных клинических исследований показали общее увеличение эффективности. В результате этих результатов был сделан вывод о снижении позывов к мочеиспусканию, уменьшении количества мочеиспусканий и уменьшении среднего объема мочеиспускания за одно мочеиспускание. [1] Также наблюдается улучшение симптомов при применении вибегрона в течение более длительного периода (52 недели), что позволяет сделать вывод, что он эффективен и безопасен при длительном применении. [17] У тяжелых пациентов увеличение дозы сопровождалось аналогичными положительными эффектами, когда впервые наблюдался их недостаток. [24] Улучшается качество жизни больных, в том числе уменьшается никтурия . [17]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]Вибегрон был разработан в Японии компаниями Kyorin Pharmaceutical Co., Ltd, Kissei Pharmaceutical Co., Ltd и Urovant Sciences. [8] Он был одобрен для медицинского использования в Японии в сентябре 2018 года. [8] и в США в декабре 2020 года. [1] [5] [6]
В апреле 2024 года Комитет по лекарственным средствам для применения человеком (CHMP) Европейского агентства по лекарственным средствам принял положительное заключение, рекомендовав выдать регистрационное удостоверение на лекарственный препарат Обгемса, предназначенный для симптоматического лечения взрослых с гиперактивным мочевым пузырем (OAB). ) синдром. [2] [25] Заявителем данного лекарственного средства является компания Pierre Fabre Medicament. [2] Вибегрон был одобрен для медицинского применения в Европейском Союзе в июне 2024 года. [2]
Имена
[ редактировать ]Вибегрон — международное непатентованное наименование . [26]
Ветеринарное использование
[ редактировать ]Беременным крысам ежедневно перорально вводили очень высокие дозы вибегрона в период органогенеза , и у них не было выявлено токсичности для развития эмбриона и плода вплоть до 300 мг/кг/день. Аналогичные данные были обнаружены у кроликов. Материнская токсичность наблюдалась, когда дозы превышали 100 мг/кг/день у кормящих крыс. Клинические исследования показывают, что вибегрон не токсичен, безопасен и хорошо переносится пациентами. [1]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н «Гемтеза-вибегрон таблетка, покрытая пленочной оболочкой» . ДейлиМед . Архивировано из оригинала 14 января 2021 года . Проверено 12 января 2021 г.
- ^ Jump up to: а б с д и «Обгемса ЭПАР» . Европейское агентство по лекарственным средствам . 25 апреля 2024 года. Архивировано из оригинала 5 июля 2024 года . Проверено 27 апреля 2024 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Обгемса ПИ» . Союзный реестр лекарственных средств . 28 июня 2024 г. Проверено 5 июля 2024 г.
- ^ Jump up to: а б с д и ж г час я Рехбергер Т., Врубель А. (январь 2021 г.). «Оценка вибегрона для лечения гиперактивного мочевого пузыря». Экспертное заключение по фармакотерапии . 22 (1): 9–17. дои : 10.1080/14656566.2020.1809652 . ПМИД 32993398 . S2CID 222166213 .
- ^ Jump up to: а б с д и «Снимок испытаний лекарств: Gemtesa» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 23 декабря 2020 года. Архивировано из оригинала 12 января 2021 года . Проверено 12 января 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б с д «Sumitovant Biopharma объявляет о том, что Urovant Sciences получила одобрение FDA США на таблетки Gemtesa (вибегрон) 75 мг для лечения пациентов с гиперактивным мочевым пузырем (ГМП)» (пресс-релиз). Сумитовант Биофарма. 23 декабря 2020 года. Архивировано из оригинала 5 июля 2024 года . Проверено 23 декабря 2020 г. - через GlobeNewswire.
- ^ US8247415B2 https://patents.google.com/patent/US8247415.
- ^ Jump up to: а б с д Ким С.Дж. (ноябрь 2018 г.). «Вибегрон: первое глобальное одобрение». Наркотики . 78 (17): 1835–1839. дои : 10.1007/s40265-018-1006-3 . ПМИД 30411311 . S2CID 53212220 .
- ^ Стаскин Д., Франкель Дж., Варано С., Шортино Д., Янкович Р., Мадд П.Н. (август 2020 г.). «Международное рандомизированное двойное слепое плацебо и активно контролируемое исследование III фазы для оценки безопасности и эффективности вибегрона у пациентов с симптомами гиперактивного мочевого пузыря: EMPOWUR». Журнал урологии . 204 (2): 316–324. дои : 10.1097/ju.0000000000000807 . ПМИД 32068484 . S2CID 211161769 .
- ^ Келлехер С., Хакими З., Зур Р., Сиддики Э., Маман К., Абаллеа С. и др. (сентябрь 2018 г.). «Эффективность и переносимость мирабегрона по сравнению с антимускариновой монотерапией или комбинированной терапией гиперактивного мочевого пузыря: систематический обзор и сетевой метаанализ» . Европейская урология . 74 (3): 324–333. дои : 10.1016/j.eururo.2018.03.020 . ПМИД 29699858 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Кеннелли М.Дж., Роудс Т., Гирман С.Дж., Томас Э., Шортино Д., Мадд П.Н. (ноябрь 2021 г.). «Эффективность вибегрона и мирабегрона при гиперактивном мочевом пузыре: систематический обзор литературы и непрямое сравнение лечения» . Достижения в терапии . 38 (11): 5452–5464. дои : 10.1007/s12325-021-01902-8 . ПМЦ 8520873 . ПМИД 34537953 .
- ^ Франкель Дж., Стаскин Д., Варано С., Кеннелли М.Дж., Янкович Р.А., Хааг-Молкентеллер С. (март 2022 г.). «Оценка эффективности и безопасности вибегрона при лечении гиперактивного мочевого пузыря» . Терапия и управление клиническими рисками . 18 : 171–182. дои : 10.2147/tcrm.s310371 . ПМК 8901416 . ПМИД 35264853 .
- ^ Jump up to: а б Митчесон Х.Д., Саманта С., Малдауни К., Пинто К.А., Роча Б.А., Грин С. и др. (февраль 2019 г.). «Вибегрон (RVT-901/MK-4618/KRP-114V), назначаемый один раз в день в качестве монотерапии или одновременно с толтеродином у пациентов с гиперактивным мочевым пузырем: многоцентровое рандомизированное двойное слепое контролируемое исследование фазы IIb». Европейская урология . 75 (2): 274–282. дои : 10.1016/j.eururo.2018.10.006 . ПМИД 30661513 . S2CID 58547754 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Стамбакио Х (2019). «AUA 2019: Вибегрон для приема один раз в день, новый пероральный агонист β3, не ингибирует CYP2D6, общий путь метаболизма лекарств у пациентов, принимающих ГАМП» . Архивировано из оригинала 19 июля 2021 года . Проверено 2 марта 2021 г.
- ^ Брэгг Р., Хебель Д., Вури С.М., Питлик Дж.М. (декабрь 2014 г.). «Мирабегрон: бета-3-агонист гиперактивного мочевого пузыря» . Консультант-фармацевт . 29 (12): 823–37. дои : 10.4140/TCP.n.2014.823 . ПМЦ 4605389 . ПМИД 25521658 .
- ^ Араклитис Дж., Бэйнс Дж., да Силва А.С., Робинсон Д., Кардосо Л. (11 сентября 2020 г.). «Последние достижения в лечении гиперактивного мочевого пузыря» . F1000Исследования . 9 : 1125. дои : 10.12688/f1000research.26607.1 . ПМЦ 7489273 . ПМИД 32968482 .
- ^ Jump up to: а б с д Ёсида М., Такеда М., Гото М., Ёкояма О., Какидзаки Х., Такахаши С. и др. (март 2019 г.). «Эффективность нового агониста β 3 -адренорецепторов вибегрона в отношении ноктурии у пациентов с гиперактивным мочевым пузырем: апостериорный анализ рандомизированного двойного слепого плацебо-контролируемого исследования фазы 3» . Международный журнал урологии . 26 (3): 369–375. дои : 10.1111/iju.13877 . ПМЦ 6912249 . ПМИД 30557916 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Jump up to: а б Ди Сальво Дж., Нагабукуро Х., Уикхэм Л.А., Аббади С., ДеМартино Дж.А., Фицморис А. и др. (февраль 2017 г.). «Фармакологическая характеристика нового бета-3-адренергического агониста вибегрона: оценка селективности антимускариновых рецепторов для комбинированной терапии гиперактивного мочевого пузыря» . Журнал фармакологии и экспериментальной терапии . 360 (2): 346–355. дои : 10.1124/jpet.116.237313 . ПМИД 27965369 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Jump up to: а б «Вибегрон (Rx)» . Медскейп . Архивировано из оригинала 22 мая 2022 года . Проверено 2 марта 2021 г.
- ^ Jump up to: а б Шена Дж., Каплан М.Дж. (апрель 2019 г.). «Все, что вы всегда хотели знать о β 3 -AR* (*но боялись спросить)» . Клетки . 8 (4): 357. doi : 10.3390/cells8040357 . ПМК 6523418 . ПМИД 30995798 .
- ^ Jump up to: а б Эдмондсон С.Д., Чжу С., Кар Н.Ф., Ди Сальво Дж., Нагабукуро Х., Сакре-Салем Б. и др. (январь 2016 г.). «Открытие вибегрона: мощного и селективного агониста β3-адренергических рецепторов для лечения гиперактивного мочевого пузыря». Журнал медицинской химии . 59 (2): 609–23. doi : 10.1021/acs.jmedchem.5b01372 . ПМИД 26709102 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Номер клинического исследования NCT01314872 «Исследование эффективности и безопасности вибегрона (MK-4618) у участников с гиперактивным мочевым пузырем (OAB) (MK-4618-008)» на ClinicalTrials.gov.
- ^ Номер клинического испытания NCT03583372 «Расширенное исследование по изучению безопасности и переносимости нового препарата у пациентов с симптомами гиперактивного мочевого пузыря (OAB). (Empowur)» на сайте ClinicalTrials.gov.
- ^ Ёсида М., Такеда М., Гото М., Нагай С., Куросе Т. (май 2018 г.). «Вибегрон, новый мощный и селективный агонист β 3 -адренорецепторов для лечения пациентов с гиперактивным мочевым пузырем: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3». Европейская урология . 73 (5): 783–790. дои : 10.1016/j.eururo.2017.12.022 . ПМИД 29366513 .
- ^ «Основные сведения о заседании Комитета по лекарственным препаратам для использования человеком (CHMP) 22–25 апреля 2024 г.» . Европейское агентство по лекарственным средствам (пресс-релиз). 26 апреля 2024 года. Архивировано из оригинала 5 июля 2024 года . Проверено 13 июня 2024 г.
- ^ Всемирная организация здравоохранения (2013). «Международные непатентованные наименования фармацевтических субстанций (МНН): рекомендуемое МНН: список 70». Информация ВОЗ о лекарствах . 27 (3): 318. hdl : 10665/331167 .
Внешние ссылки
[ редактировать ]- Номер клинического испытания NCT03492281 «Исследование по изучению безопасности и эффективности нового препарата у пациентов с симптомами гиперактивного мочевого пузыря (ГАМП) (Empowur)» на сайте ClinicalTrials.gov.