синефрин
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 4-[1-Гидрокси-2-(метиламино)этил]фенол | |
| Другие имена п -синефрин | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.002.092 |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| C9H13NOC9H13NO2 | |
| Молярная масса | 167.21 g/mol |
| Появление | бесцветное твердое вещество |
| Температура плавления | от 162 до 164 °C (от 324 до 327 °F; от 435 до 437 К) (R-(-)-энантиомер); 184–185 °C (рацемат) |
| растворимый | |
| Фармакология | |
| C01CA08 ( ВОЗ ) S01GA06 ( ВОЗ ), QS01FB90 ( ВОЗ ) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Синефрин , или, более конкретно, п -синефрин , представляет собой алкалоид , встречающийся в природе в некоторых растениях и животных, а также в одобренных лекарственных препаратах в качестве его м -замещенного аналога, известного как неосинефрин. [1] п -синефрин (или ранее симпатол и окседрин [ БАН ]) и м -синефрин известны своим более длительным адренергическим действием по сравнению с адреналином и норадреналином . Это вещество присутствует в очень низких концентрациях в обычных пищевых продуктах, таких как апельсиновый сок и другие апельсиновые ( цитрусовые ) продукты, как «сладкие», так и «горькие». Препараты, используемые в традиционной китайской медицине ( ТКМ ), также известные как Чжи Ши (枳实), представляют собой незрелые и высушенные целые апельсины Citrus aurantium ( Fructus Aurantii Immaturus ). Экстракты того же материала или очищенный синефрин также продаются в США, иногда в сочетании с кофеином , способствующей снижению веса, , в качестве пищевой добавки для перорального употребления. Хотя традиционные препараты использовались на протяжении тысячелетий в качестве компонента формул традиционной китайской медицины, сам по себе синефрин не является одобренным безрецептурным препаратом . В качестве фармацевтического препарата м -синефрин ( фенилэфрин ) до сих пор используется как симпатомиметик (т.е. из-за его гипертензивного и сосудосуживающего действия) . свойства), в основном путем инъекций для лечения чрезвычайных ситуаций, таких как шок , и редко перорально для лечения бронхиальных проблем, связанных с астмой и сенной лихорадкой . [а]
Существует разница между исследованиями, рассматривающими синефрин как единое химическое соединение (синефрин может существовать в форме любого из двух стереоизомеров , d- и l-синефрина, которые химически и фармакологически различны), и синефрином, который смешивается с другими лекарственными средствами и /или растительные экстракты в «добавке», а также синефрин, который присутствует только в качестве одного химического компонента в природной смеси фитохимических веществ, такой как кожура или плоды горького апельсина. Не следует предполагать, что смеси, содержащие синефрин в качестве лишь одного из своих химических компонентов (независимо от того, имеют ли они синтетическое или природное происхождение), производят точно такие же биологические эффекты, как и один только синефрин. [2]
По внешнему виду синефрин представляет собой бесцветное кристаллическое твердое вещество, растворимое в воде. Его молекулярная структура основана на фенэтиламиновом скелете и родственна структурам многих других лекарств, а также основным нейромедиаторам адреналину и норэпинефрину.
Природные явления
[ редактировать ]Синефрин, хотя уже известен как синтетическое органическое соединение , впервые был выделен как натуральный продукт из листьев различных цитрусовых деревьев, а его присутствие отмечено в различных соках цитрусовых Стюартом и его коллегами в начале 1960-х годов. [3] [4] Обзор распределения синефрина среди высших растений был опубликован в 1970 году Уитоном и Стюартом. [5] Впоследствии он был обнаружен в Эводии. [6] и виды Zanthoxylum , [7] все растения семейства Рутовые.
Следовые уровни (0,003%) синефрина также были обнаружены в высушенных листьях Pogostemon cablin ( пачули , Lamiaceae). [8] Он также встречается у некоторых видов кактусов родов Coryphantha и Dolichothele . [9]
Однако это соединение встречается преимущественно в ряде видов цитрусовых , включая сорта «горьких» апельсинов.
В Цитрусовых
[ редактировать ]Сообщалось, что экстракты незрелых плодов азиатских сортов Citrus aurantium (широко известных как «горький» апельсин), собранных в Китае, содержат уровень синефрина около 0,1–0,3%, или ~ 1–3 мг/г; [10] Анализ сухофруктов C. aurantium, выращенных в Италии, показал концентрацию синефрина ~1 мг/г, при этом в кожуре его содержится более чем в три раза больше, чем в мякоти. [11]
В сладких апельсинах сортов Тарокко, Навелин и Навель, купленных на итальянском рынке, обнаружено ~13–34 мкг/г (что соответствует 13–34 мг/кг) синефрина (при примерно равных концентрациях в соке и отделенной мякоти). ; На основании этих результатов было подсчитано, что употребление одного «среднего» апельсина Тарокко приведет к потреблению ~6 мг синефрина. [12]
Анализ 32 различных апельсиновых «джемов», происходящих в основном из США и Великобритании, но включая образцы из Франции, Италии, Испании или Ливана, показал уровни синефрина в диапазоне 0,05–0,0009 мг/г. [б] в джемах из горьких апельсинов и уровни 0,05–0,006 мг/г. [с] синефрина в джемах из сладких апельсинов. [13]
Синефрин был обнаружен в мармеладе, приготовленном из Citrus unshiu (мандарин Сацума). [14] получен в Японии в концентрации ~0,12 мг/г (или около 2,4 мг/20 г порции). [15] Большая часть апельсинового мармелада, производимого в США, производится с использованием «сладких» апельсинов ( C. sinensis ), тогда как «горькие» или севильские апельсины ( C. aurantium ) используются для изготовления более традиционных, более горьких мармеладов в Соединенном Королевстве. [16]
Было обнаружено, что образец коммерческого японского сока C. unshiu содержит ~0,36 мг/г синефрина (или примерно 360 мг/л). [15] в то время как в соковых продуктах, полученных из сорта мандарина Сацума, выращенного в Калифорнии, уровень синефрина колебался от 55 до 160 мг/л. [17]
Было обнаружено, что соки «сладких» апельсинов, купленные на бразильских рынках, содержат ~ 10–22 мг/л синефрина; Коммерческие апельсиновые безалкогольные напитки, поступающие на бразильский рынок, имели среднее содержание синефрина ~ 1 мг/л. [18] Коммерческие итальянские апельсиновые соки содержали ~ 13–32 мг/л синефрина. [12]
При исследовании более 50 цитрусовых соков, полученных в коммерческих целях или отжатых вручную из свежих фруктов, полученных на рынке США, Авула и его коллеги обнаружили, что уровни синефрина варьируются в пределах ~ 4–60 мг/л; [д] в соках грейпфрута, лайма или лимона синефрин не обнаружен. [13]
Уку и его коллеги сообщили об анализе уровней синефрина в различных цитрусовых, проведенном на соках, извлеченных из свежих очищенных фруктов, и получили следующие результаты:Сладкий апельсин Марра ( C. sinensis Tan.): ~85 мг/л; Новый мандарин ( C. reticulata Tan.): ~78 мг/л; клементин ( C. clementina Tan.): ~115 мг/л; лимон Мейера ( C. limon Tan.) ~3 мг/кг; Угли танжело ( C. reticulata × C. paradisi ) ~47 мг/кг. Синефрин не был обнаружен в: грейпфруте Rio Red ( C. paradisi Macf.); Помело красномякший ( C. grandis Tan.); или Векива танжело ( C. reticulata × C. paradisi ). [14] [19]
многочисленные дополнительные сопоставимые анализы содержания синефрина в цитрусовых В исследовательской литературе можно найти и продуктах, полученных из них.
У человека и других животных
[ редактировать ]В нормальной человеческой моче обнаружены низкие уровни синефрина. [20] [21] а также в других тканях млекопитающих. [22] [23] Чтобы снизить вероятность того, что синефрин, обнаруженный в моче, имел диетическое происхождение, испытуемые, обследованные Ибрагимом и его коллегами, воздерживались от употребления любых цитрусовых продуктов в течение 48 часов до сдачи образцов мочи. [20]
Исследование, 10 проведенное Д'Андреа и его коллегами в 2006 году, показало повышенный уровень синефрина в тромбоцитах у пациентов, страдающих мигренью, связанной с аурой (0,72 нг/ 8 тромбоциты по сравнению с 0,33 нг/10 8 тромбоциты у контрольной группы). [24] Ранее та же исследовательская группа сообщила, что нормальный в плазме крови человека составляет 0,90–13,69 нг/мл. уровень синефрина [25]
Стереоизомеры
[ редактировать ]Поскольку синефрин существует в виде одного из двух энантиомеров (см. раздел «Химия» ниже для дальнейшего обсуждения), которые не оказывают идентичных биологических эффектов (см. раздел «Фармакология» ниже), некоторые исследователи исследовали стереоизомерный состав синефрина, извлеченного из природных источников. Хотя кажется очевидным, что синефрин содержится в тех видах цитрусовых , которые изучались преимущественно в виде L-изомера, [15] [26] низкие уровни d-синефрина были обнаружены в соке и мармеладе, приготовленном из C. unshiu , [15] и низкие уровни (0,002%) были зарегистрированы в свежих плодах C. aurantium . [26] Есть указания на то, что некоторое количество d-синефрина может образовываться в результате рацемизации l-синефрина в результате обработки свежих фруктов, хотя этот вопрос до конца не выяснен. [27] [28] Однако, независимо от ситуации с цитрусовых видами выделении рацемического , Раньери и Маклафлин сообщили об (т.е. смеси равных количеств d- и l-стереоизомеров) синефрина из кактуса рода Dolichothele в условиях, которые вряд ли могли бы вызвать значительная рацемизация. [29]
Биосинтез
[ редактировать ]биосинтез синефрина у цитрусовых Считается, что происходит по пути: тирозин → тирамин → N -метилтирамин → синефрин с участием ферментов тирозиндекарбоксилазы на первом этапе, тирамин- N -метилтрансферазы на втором и N -метилтирамин-β. -гидроксилаза в третьем. [30] [31] Этот путь отличается от того, который, как считается, происходит у животных и включает октопамин : тирамин → октопамин → синефрин, где превращение тирамина в октопамин опосредовано дофамин-β-гидроксилазой , а превращение октопамина в синефрин — с помощью фенилэтаноламин- N -метилтрансферазы . [25] [30]
Присутствие в пищевых/диетических добавках
[ редактировать ]Некоторые пищевые добавки, продаваемые с целью снижения веса или обеспечения энергией, содержат синефрин в качестве одного из нескольких компонентов. Обычно синефрин присутствует в виде природного компонента Citrus aurantium («горький апельсин»), связанного с растительной матрицей, но также может иметь синтетическое происхождение или быть очищенным фитохимическим веществом (т. е. извлеченным из растительного источника и очищенным до химических веществ). однородность). [16] [35] [36] Диапазон концентраций, обнаруженный Сантаной и его коллегами в пяти различных добавках, купленных в США, составлял около 5–14 мг/г. [35]
Фармацевтическое использование
[ редактировать ]Как синтетический препарат синефрин впервые появился в Европе в конце 1920-х годов под названием Симпатол . Одна из первых статей, описывающих его фармакологические и токсикологические свойства, была написана Лэшем, который получил его от венской компании Syngala. [37] К 1930 году Симпатол уже назывался продуктом компании Boehringer. [38] в то время как один из первых патентов США, описывающих его приготовление и использование, был передан компании Frederick Stearns & Co. в 1933 году. [39] Несмотря на дату этого патента, клинические и фармакологические исследования синефрина, полученного от Frederick Stearns & Co, к 1930 году проводились в США. [40] [41] В 1931 году Хартунг сообщил, что в 1930 году Совет по фармации и химии Американской медицинской ассоциации принял синефрин для включения в свой список «новых и неофициальных средств лечения» в качестве средства для лечения пероральным или парентеральным введением. , «приступов сенной лихорадки, астмы, кашля, спазмов астмы и коклюша (коклюша)». [42] [43] Однако синефрин был исключен из списка совета в 1934 году, а его очевидная повторная реклама в качестве нового препарата компанией Stearns десять лет спустя вызвала резкий комментарий со стороны редакторов журнала Американской медицинской ассоциации. [44] В третьем издании (1965 г.) «Фармакологии в медицине Дрилла» с оговорками говорилось, что синефрин «рекламировался как антигистаминное средство, используемое при лечении простуды...», под торговым названием «Тартрат синефрина» и указано, что доза составляла 100 мг внутримышечно или подкожно. [45] Опубликованный в 1966 году « Учебник органической медицинской и фармацевтической химии» описывал синефрин (в форме его рацемического тартрата) как симпатомиметический агент, который был «менее эффективен, чем адреналин», и который использовался для лечения хронической гипотонии , коллапса из-за шоку и другим состояниям, приводящим к гипотонии . [46] В более позднем учебнике (1972 г.) синефрин был описан как препарат, продаваемый в Европе и применяемый в ситуациях, связанных с шоком, например, хирургическим или бактериемическим шоком, а также шоком, связанным с спинальной анестезией . Рекомендуемая доза здесь составляла 25–50 мг при внутривенном, внутримышечном или подкожном введении. [47]
Синефрин не упоминается ни в изданиях Drill's Pharmacology in Medicine позднее третьего, ни в « Справочнике врачей» 2012 года , ни в текущей FDA «Оранжевой книге» нет никаких упоминаний о синефрине .
Один текущий справочный источник описывает синефрин как сосудосуживающее средство, которое назначали пациентам с гипотонией перорально или путем инъекций в дозах 20–100 мг. [48]
На одном веб-сайте медицинской медиа-компании, доступ к которому был получен в феврале 2013 г., окседрин упоминается как показанный при гипотензивных состояниях в пероральных дозах 100–150 мг три раза в день и как « конъюнктивальное противоотечное средство» для местного применения в виде 0,5% раствора. . [49] Однако никаких подтверждающих ссылок не предоставлено.
Имена
[ редактировать ]Была некоторая путаница в отношении биологических эффектов синефрина из-за сходства этого названия без префикса с названиями м-синефрин , мета-синефрин и неосинефрин , которые относятся к родственному препарату и встречающемуся в природе амину , более известному. как фенилэфрин . Хотя между синефрином и фенилэфрином существует химическое и фармакологическое сходство, тем не менее это разные вещества. Путаница усугубляется тем фактом, что синефрин продается как лекарственное средство под множеством различных названий, включая Симпатол , Симпатол , Синтенат и окседрин , а фенилэфрин также называют м-Симпатолом . Синефрин, о котором идет речь в этой статье, иногда называют п-синефрином, чтобы отличить его от его позиционных изомеров, м -синефрина и о -синефрина. Полный список альтернативных названий синефрина можно найти в статье ChemSpider (см. Chembox справа). Существует путаница в различиях между п- и м -синефрин. [50] Однако изучение ссылок, приведенных в поддержку этого утверждения, показывает, что все доказательства присутствия м -синефрина в C. aurantium взяты из отчета Пензака и его сотрудников. [51] В реферате которой говорится, что м -синефрин был обнаружен в C. aurantium , тогда как внимательное прочтение текста самой статьи показывает, что авторы (хотя, по-видимому, не уверены в том, какой регио-изомер синефрина был обнаружен в растении более ранними исследователями) были осознавая, что их аналитическая техника не позволяла различать м- и п -синефрин, и не утверждала, что м -синефрин присутствует. Таким образом, Аннотация противоречит экспериментальным данным, приведенным в полном тексте статьи, но эта ошибка распространилась в последующих публикациях.}} Даже название « п -синефрин» не является однозначным, поскольку оно не определяет стереохимию. Единственные совершенно однозначные названия синефрина: ( R )-(-)-4-[1-гидрокси-2-(метиламино)этил]фенол (для l-энантиомера); ( S )-(+)-4-[1-гидрокси-2-(метиламино)этил]фенол (для d-энантиомера); и ( R , S )-4-[1-гидрокси-2-(метиламино)этил]фенол (для рацемата или d,l-синефрина) (см. «Химия» раздел ).
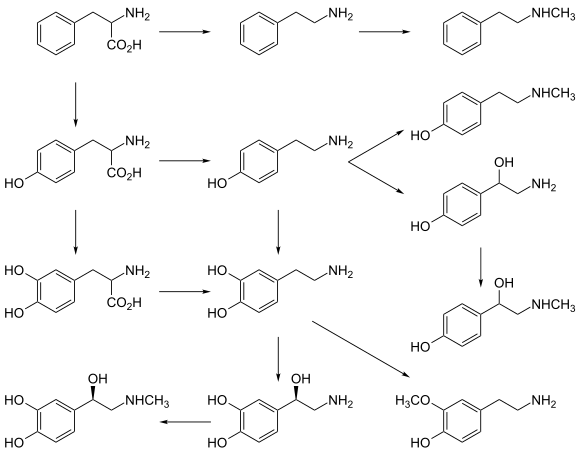
Химия
[ редактировать ]Характеристики
[ редактировать ]С точки зрения молекулярной структуры синефрин имеет фенэтиламиновый скелет с фенольной гидроксигруппой , спиртовой гидроксигруппой и N -метилированной аминогруппой . Альтернативно, синефрин можно описать как фенилэтаноламин с N -метильным и п -гидрокси-заместителем. Аминогруппа придает молекуле основные свойства, тогда как фенольная группа –OH является слабокислотной: кажущиеся (обсуждение см. в исходной статье) значения pK a s для протонированного синефрина составляют 9,55 (фенольный H) и 9,79 (аммоний H). [52]
Обычными солями рацемического синефрина являются его гидрохлорид , C 9 H 13 NO 2 .HCl, т. пл. 150–152°, [53] оксалат 2 (C 9 H 13 NO 2 ) 2 .C 2 H O , т. пл . 4 221–222 °С, [3] и тартрат (Симпатол), (C 9 H 13 NO 2 ) 2 .C 4 H 6 O 6 , т.пл. 188–190°С. [46] [54]
Наличие гидроксигруппы на бензильном С молекулы синефрина создает хиральный центр , поэтому соединение существует в форме двух энантиомеров , d- и l-синефрина, или в виде рацемической смеси , d,l-синефрина. Правовращающий -конфигурации d-изомер соответствует ( S )-конфигурации , а левовращающий L-изомер — ( R ) . [55]
Рацемический синефрин растворяли с помощью 3-бромкамфор-8-сульфоната аммония. [11] [55] Энантиомеры не были охарактеризованы как свободные основания, а были преобразованы в гидрохлоридные соли со следующими свойствами: [55]
( S )-(+)-C 9 H 13 NO 2 ·HCl: т. пл. 178°С; [α] = +42,0°, с 0,1 (H 2 O); ( R )-(-)-C 9 H 13 NO 2 ·HCl: т. пл. 176°С; [α] = −39,0°, c 0,2 (H 2 O)
(-)-Синефрин, как свободное основание, выделенное из источника цитрусовых , имеет температуру плавления 162–164 °C (с разложением). [3] [4] [ мертвая ссылка ]
рентгеноструктурная структура синефрина. Определена [55]
Синтез
[ редактировать ]Ранние и, казалось бы, неэффективные синтезы синефрина обсуждались Пристли и Монессом в 1940 году. [56] Эти химики оптимизировали путь, начинающийся с O -бензоилирования п -гидроксифенацилхлорида с последующей реакцией полученного O -защищенного хлорида с N -метилбензиламином с образованием аминокетона. Это промежуточное соединение затем гидролизовали смесью HCl/спирт до п -гидроксиаминокетона, а затем продукт каталитически восстанавливали с образованием (рацемического) синефрина.
Более поздний синтез, осуществленный Бергманном и Зульцбахером, начался с O -бензилирования п -гидроксибензальдегида с последующей реакцией Реформатского защищенного альдегида с этилбромацетатом/Zn с получением ожидаемого β-гидроксиэфира. Это промежуточное соединение превращали в соответствующий ацилгидразид с помощью гидразина, затем ацилгидразид реагировал с HNO 2 , в конечном итоге получая п -бензилоксифенилоксазолидон. Его N -метилировали с использованием диметилсульфата , затем гидролизовали и O -дебензилировали при нагревании с HCl с получением рацемического синефрина. [57]
Структурные отношения
[ редактировать ]В литературе (как непрофессиональной, так и профессиональной) было сделано много упоминаний о структурном родстве синефрина с эфедрином или с фенилэфрином , часто подразумевая, что предполагаемое сходство в структуре должно привести к сходству в фармакологических свойствах. Однако с химической точки зрения синефрин также связан с очень большим количеством других лекарств, структура которых основана на фенэтиламиновом скелете, и хотя некоторые свойства являются общими, другие нет, что делает неуместными неквалифицированные сравнения и обобщения.
Так, замена N - метильной группы в синефрине на атом водорода дает октопамин ; замена β -гидроксигруппы в синефрине на атом Н дает N- метилтирамин ; 4-OH группы синефрина замена фенольной на –H дает галостахин .
Если фенольная 4-ОН-группа синефрина сдвигается в мета- или 3-положение бензольного кольца, образуется соединение, известное как фенилэфрин (или м -синефрин, или «неосинефрин»); если та же группа сдвигается в орто- или 2-положение на кольце, образуется о -синефрин.
Добавление еще одной фенольной группы –OH к 3-положению бензольного кольца приводит к образованию нейромедиатора адреналина ; присоединение метильной группы к α-положению боковой цепи синефрина дает оксилофрин (метилсинефрин). Для этого вещества возможны четыре стереоизомера (две пары энантиомеров).
-метилового заместителя синефрина Удлинение N на одну метиленовую единицу до N - этила дает экспериментальный гипотензивный препарат «Стерлинг №573»/ «Аэтил-Симпатол». [58] [59]
Все вышеперечисленные структурные взаимоотношения включают изменение в одном положении молекулы синефрина, и возможны многочисленные другие подобные изменения, многие из которых уже изучены. Однако структура эфедрина отличается от структуры синефрина в двух разных положениях: эфедрин не имеет заместителя в фенильном кольце, где синефрин имеет 4-ОН-группу, а эфедрин имеет метильную группу в положении α- к N в боковой части. -цепь, где синеприн имеет только атом H. Более того, «синефрин» существует в виде одного из двух энантиомеров, тогда как «эфедрин» существует в виде одного из четырех различных энантиомеров; кроме того, существуют рацемические смеси этих энантиомеров.
Основными отличиями изомеров синефрина по сравнению, например, с эфедринами, являются гидроксизамещения в бензольном кольце. Синефрины являются прямыми симпатомиметиками, тогда как эфедрины являются как прямыми, так и непрямыми симпатомиметиками. Одной из основных причин этих дифференциальных эффектов является очевидно повышенная полярность гидроксизамещенных фенилэтиламинов, что делает их менее способными проникать через гематоэнцефалический барьер, как показано в примерах с тирамином и аналогами амфетамина. [60]
Фармакология
[ редактировать ]Краткое содержание
[ редактировать ]Классические фармакологические исследования на животных и изолированных тканях животных показали, что основные действия парентерально введенного синефрина включают повышение кровяного давления, расширение зрачков и сужение периферических кровеносных сосудов.
Сейчас имеется достаточно доказательств (какие доказательства?) что синефрин оказывает большую часть своих биологических эффектов, действуя как агонист (т.е. стимулируя) адренергические рецепторы, с явным предпочтением подтипа α1 по сравнению с α2 подтипом . Однако активность синефрина в отношении этих рецепторов относительно низкая (т.е. для их активации требуются относительно большие концентрации препарата). Активность синефрина на адренорецепторах β-класса (независимо от подтипа) значительно ниже, чем на α-рецепторах. Есть некоторые свидетельства того, что синефрин также обладает слабой активностью в отношении 5-НТ-рецепторов и что он взаимодействует с TAAR1 (рецептор 1, связанный с следовым амином).
Как и практически все другие простые фенилэтаноламины (β-гидроксифенилэтиламины), ( R )-(-)- или l-энантиомер синефрина более эффективен, чем ( S )-(+)- или d-. , энантиомер в большинстве, но не во всех изученных препаратах. Однако большинство исследований было проведено с рацемической смесью двух энантиомеров.
Поскольку подробности, касающиеся таких переменных, как тестируемые виды, источник рецепторов, путь введения, концентрация лекарства и стереохимический состав, важны, но часто неполны в других обзорах и рефератах исследовательских публикаций, многие из них представлены в более техническом обзоре ниже, чтобы как можно полнее поддержите общие заявления, сделанные в этом обзоре.
Фармакологические исследования
[ редактировать ]Фармакологические исследования синефрина относятся к концу 1920-х годов, когда было замечено, что введенный синефрин повышает кровяное давление, сужает периферические кровеносные сосуды, расширяет зрачки, стимулирует матку и расслабляет кишечник у экспериментальных животных. [37] [61] [62] Представительницей этой ранней работы является статья Тейнтера и Зайденфельда, которые были первыми исследователями, которые систематически сравнивали различные эффекты двух энантиомеров синефрина, d- и l-синефрина, а также рацемата d,l-синефрина. в различных исследованиях на животных. [41] В экспериментах на анестезированных кошках Тейнтер и Зайденфельд подтвердили более ранние сообщения о повышении артериального давления, вызванном внутривенным введением синефрина, показав, что средние прессорные дозы для изомеров составляли: l-синефрин: 0,5 мг/кг; d,l-синефрин: 1,0 мг/кг; и d-синефрин: 2–20 мг/кг. Эти эффекты длились 2–3 минуты, достигая максимума примерно через 30 секунд после приема. Таким образом, l-синефрин оказался более мощным энантиомером, примерно в 1/60 раз превышающим эффективность стандартного прессорного l-адреналина в том же анализе.Более позднее исследование, проведенное Лэндсом и Грантом, показало, что доза ~0,6 мг/кг рацемического синефрина, введенная внутривенно анестезированным собакам, вызывала повышение артериального давления на 34 мм рт. ст., продолжающееся 5–10 минут, и подсчитали, что эта прессорная активность было примерно в 1/300 раза больше, чем адреналина. [63]
Используя кошек и собак, Тейнтер и Зайденфельд наблюдали, что ни d-, ни l-синефрин не вызывают никаких изменений тонуса нормальных бронхов даже in situ в «максимальных» дозах. Более того, выраженная брохоконстрикция, вызванная инъекциями гистамина, не была устранена ни l-синефрином, ни d,l-синефрином. [41]
В экспериментах с изолированной сонной артерией овцы d-, l- и d,l-синефрин продемонстрировал некоторую сосудосуживающую активность: l-синефрин был самым мощным, вызывая сильные сокращения в концентрации 1:10000. [и] d-синефрин был примерно вполовину слабее L-изомера, но d,l-синефрин (который, как ожидалось, имел бы эффективность, равную 1/2 эффективности l-синефрина, даже если бы d-изомер был полностью неактивен) ) не вызывал значительных и нерегулярных сокращений до концентрации 1:2500. [ф] было достигнуто, что подразумевает ингибирующее взаимодействие между двумя энантиомерами. [41]
Качественно аналогичные результаты были получены при применении препарата из ушей кролика: 25 мг l-синефрина вызывали значительную (50%) вазоконстрикцию, в то время как такая же концентрация d-синефрина практически не вызывала ответа. Напротив, d,l-синефрин не вызывал никакого сужения до 25 мг, но дозы 25–50 мг вызывали расслабление кровеносных сосудов, что еще раз свидетельствовало о том, что d-изомер мог ингибировать действие l-изомера. [41]
кролика Эксперименты на полосках двенадцатиперстной кишки показали, что l-синефрин вызывает умеренное уменьшение сокращений в концентрации 1:17000. [г] но эффекты d- и d,l-форм были гораздо слабее. [41]
Было обнаружено, что рацемический синефрин, вводимый внутримышечно или путем закапывания, значительно уменьшает воспаление, вызванное закапыванием горчичного масла в глаза кроликов. [41]
Сообщалось, что подкожная инъекция рацемического синефрина кроликам вызывала значительное повышение уровня сахара в крови . [43]
В экспериментах на анестезированных кошках Папп и Секерес обнаружили, что синефрин (стереохимия не уточнена) повышает пороги фибрилляции предсердий и желудочков , что указывает на его антиаритмические свойства. [64]
Доказательства того, что синефрин может иметь некоторые центральные эффекты, получены в результате исследования Сонга и его коллег, которые изучали эффекты синефрина на моделях мышей. [час] антидепрессивной активности. [65] Эти исследователи заметили, что пероральные дозы рацемического синефрина 0,3–10 мг/кг были эффективны для сокращения продолжительности неподвижности. [я] вырабатывался в анализах, но не вызывал изменений спонтанной двигательной активности в отдельных тестах. Этой характерной неподвижности можно противодействовать предварительным назначением празозина . [Дж] Последующие эксперименты с использованием отдельных энанатиомеров синефрина показали, что, хотя d-изомер значительно уменьшал продолжительность неподвижности в тесте с подвешиванием за хвост, при пероральной дозе 3 мг/кг l-изомер не оказывал эффекта в той же дозе.У мышей, предварительно обработанных резерпином , [к] пероральная доза d-синефрина 0,3 мг/кг значительно устраняла гипотермию , тогда как для эффективности l-синефрина требовалась доза 1 мг/кг.Эксперименты со срезами коры головного мозга крыс показали, что d-синефрин ингибирует поглощение [ 3 Н]-норадреналин с IC 50 = 5,8 мкМ; L-синефрин был менее активным (IC 50 = 13,5 мкМ).d-синефрин также конкурентно ингибирует связывание низоксетина. [л] на срезы коры головного мозга крысы с K i = 4,5 мкМ; L-синефрин был менее активным (K i = 8,2 мкМ).В экспериментах по выделению [ 3 H]-норадреналин из срезов коры головного мозга крысы, однако l-изомер синефрина был более мощным усилителем высвобождения (EC 50 = 8,2 мкМ), чем d-изомер (EC 50 = 12,3 мкМ). Это усиленное высвобождение l-синефрина блокировалось низоксетином. [66]
Бурген и Иверсен, изучая влияние широкого спектра препаратов на основе фенэтиламина на 14 С]-норадреналина в изолированном сердце крысы обнаружено, что рацемический синефрин [м] был относительно слабым ингибитором (IC 50 = 0,12 мкМ) поглощения. [67]
Другое рецепторно-ориентированное исследование, проведенное Викбергом, показало, что синефрин ( стереохимия не уточнена) является более сильным агонистом -рецепторов аорты альфа- 1 морской свинки (pD 2 = 4,81), чем альфа - 2 -рецепторов подвздошной кишки (pD 2 = 4,48), с относительным коэффициентом сродства. α 2 /α 1 = 0,10. Хотя это явно указывает на селективность синефрина в отношении α1 - рецепторов, его активность в отношении этого подкласса рецепторов все еще относительно низка по сравнению с фенилэфрином (pD2 при α1 = 6,32). [68]
Браун и его коллеги исследовали влияние отдельных энантиомеров синефрина на α1 - крысы рецепторы аорты и на α2 - вены кролика рецепторы подкожной . При препарате аорты l-синефрин давал pD 2 = 5,38 (активность относительно норэпинефрина = 1/1000), тогда как d-синефрин имел pD 2 = 3,50 (активность относительно норэпинефрина = 1/50 000); для сравнения, у l-фенилэфрина pD 2 = 7,50 (активность относительно норадреналина ≃ 1/6). Никакого антагонизма норэпинефрину не вызывали концентрации l-синефрина до 10 −6 М. В подкожном анализе кроликов pD 2 l-синефрина составлял 4,36 (эффективность относительно норэпинефрина ≃ 1/1700), а d-синефрина была <3,00; для сравнения, у l-фенилэфрина pD 2 = 5,45 (активность относительно норадреналина ≃ 1/140). Никакого антагонизма норэпинефрину не вызывали концентрации l-синефрина до 10 −5 М. [69]
Исследование воздействия синефрина (стереохимия не уточнена) на полоски аорты морской свинки и на стимулированную полем подвздошную кишку морской свинки показало, что синефрин обладает агонистической активностью -logK a = 3,75 в анализе на аорте. Для сравнения, активность адреналина составляла -logK a = 5,70. Не наблюдалось существенного влияния на подвздошную кишку при концентрациях синефрина примерно до 2 × 10. −4 М, что указывает на селективность в отношении рецептора α1 , но относительно низкую эффективность. [70]
В экспериментах по связыванию с центральными адренергическими рецепторами с использованием препарата коры головного мозга крыс l-синефрин имел pIC 50 = 3,35, а d-синефрин имел pIC 50 = 2,42 в конкуренции с [ 3 H]- празозин (стандартный α 1 лиганд); против [ 3 H] -йохимбин (стандартный α2 - лиганд), l-синефрин показал pIC 50 = 5,01, а d-синефрин показал pIC 50 = 4,17. [69]
Эксперименты, проведенные Хибино и его коллегами, также показали, что синефрин (стереохимия не указана) вызывает дозозависимое сужение изолированных полосок аорты крыс в диапазоне концентраций 10 −5 –3 × 10 −6 M. Было обнаружено, что этому сужению конкурентно противодействуют празозин (стандартный антагонист α 1 ) и кетансерин . [н] при этом празозин является более сильным антагонистом (pA 2 = 9,38 по сравнению с pA 2 = 8,23 для кетансерина). Сужениям синефрина также противодействовал BRL-15,572 . [the] но не SB-216,641 (используемый здесь в качестве селективного антагониста 5-HT 1B ) или пропранолола (обычный антагонист β). [71]
морских свинок В исследованиях предсердий и трахеи Джордан и его коллеги также обнаружили, что синефрин оказывает незначительную активность на рецепторы β 1 и β 2 , будучи примерно в 40 000 раз менее эффективным, чем норадреналин. [72]
Эксперименты с культивированными белыми жировыми клетками нескольких видов животных, включая человека, проведенные Карпене и его коллегами, показали, что рацемический синефрин оказывает липолитическое действие, но только в высоких концентрациях (0,1-1 мМ). Активность синефрина, выраженная через pD 2, у этих видов была следующей: крыса: 4,38; хомяк: 5,32; морская свинка: 4,31; человек: 4,94. Для сравнения, изопреналин имел pD 2 = 8,29, а норэпинефрин имел pD 2 = 6,80 в белых жировых клетках человека. Липолитическому эффекту 1 мМ/л синефрина на белые жировые клетки крыс противодействовали различные β-антагонисты со следующими ингибирующими концентрациями (IC50 ) : бупранолол : [п] 0,11 мкМ; CGP-20,712A (антагонист β 1 ): 6,09 мкМ; ICI-118,551 (антагонист β2 ) : 3,58 мкМ; SR-5923A ( β 3 ): 17 мкМ. антагонист [73]
Было исследовано связывание рацемического синефрина с клонированными адренергическими рецепторами человека: Ма и его коллеги обнаружили, что синефрин связывается с α 1A , α 2A и α 2C с низким сродством (pK i = 4,11 для α 1A ; 4,44 для α 2A ; 4,61). для α2C ) . Синефрин действовал как частичный агонист рецепторов α1A подтипов , но как антагонист и α2C . α2A [74]
Было показано, что рацемический синефрин агонистом TAAR1 является . [75] хотя его эффективность в отношении человеческого TAAR1 относительно низка (EC 50 = 23700 нМ; E max = 81,2%). [76]
Фармакокинетика
[ редактировать ]Фармакокинетику синефрина изучали Хенгстманн и Аулепп, которые сообщили о достижении максимальной концентрации в плазме через 1–2 часа с периодом полувыведения (Т 1/2 ) ~ 2 часа. [77]
Метаболизм
[ редактировать ]Исследования метаболизма синефрина моноаминоксидазами, полученными из митохондрий головного мозга крыс , показали, что синефрин является субстратом для дезаминирования как МАО-А, так и МАО-В , с K m = 250 мкМ и V max = 32,6 нМ/мг белка/30 минут. ; были некоторые свидетельства преимущественного дезаминирования МАО-А. [78]
Эффекты на людях
[ редактировать ]Этот раздел нуждается в более надежных медицинских справках для проверки или слишком сильно полагается на первоисточники . ( январь 2014 г. ) |  |
Ряд исследований воздействия синефрина на человека, большинство из которых были посвящены его сердечно-сосудистым свойствам, был проведен с момента его появления в качестве синтетического препарата примерно в 1930 году. [40] [79] [80] [81] [82] [83] Статья Стоктона и его коллег является показательной, в ней описываются эффекты рацемического синефрина на человека, при этом особое внимание уделяется различиям, возникающим в результате разных путей введения. Так, этими исследователями было показано, что внутримышечные инъекции (средняя эффективная доза = 200 мг) препарата вызывают повышение систолического артериального давления и частоты пульса, не влияя на диастолическое давление. Повышение артериального давления достигло максимума (~25 мм рт.ст.) через 5 минут после инъекции, затем постепенно нормализовалось в течение 1 часа. Дозы препарата более 200 мг вызывали побочные эффекты, такие как учащенное сердцебиение, головная боль, потливость и чувство тревоги. введении При внутривенном дозы 25–50 мг было достаточно для достижения среднего максимального повышения артериального давления на 29 мм рт. ст. за 2 минуты и возврата к исходному уровню в течение 30 минут. Во время этих экспериментов дыхание обычно не затрагивалось. Подкожное введение синефрина в дозах ≤ 200 мг не оказывало влияния на артериальное давление и частоту пульса. Пероральные дозы 500–1500 мг препарата не влияли на артериальное давление и дыхание, но частота пульса увеличивалась примерно на 12%, а самые высокие дозы вызывали тошноту и рвоту. [40]
Внутримышечное введение 75–500 мг синефрина не купировало острые приступы астмы , что противоречит более раннему утверждению. [84] Однако местное применение 1–3% растворов препарата на слизистую оболочку носа у больных синуситом вызывало благоприятное сужение без местного раздражения. [40]
Введение синефрина путем непрерывной внутривенной инфузии со скоростью 4 мг/мин значительно повышало среднее артериальное и систолическое давление, но диастолическое давление и частота сердечных сокращений не менялись; [83] дальнейшие подробности этого расследования изложены в обзоре Фуг-Бермана и Майерса. [85]
Существует ряд исследований, ссылки на многие из которых можно найти в обзоре Стокса и соавторов. [86] борьба с эффектами пищевых добавок и растительных препаратов, которые содержат синефрин как лишь один из многих различных химических ингредиентов. Это выходит за рамки настоящей статьи (см. также « Безопасность/Эффективность/Споры подраздел »).
Токсикология
[ редактировать ]Острая токсичность рацемического синефрина у различных животных, описанная в терминах «максимально переносимая доза» после подкожного введения, была следующей: мыши: 300 мг/кг; крыса: 400 мг/кг; морская свинка: 400 мг/кг. «Смертельные дозы», вводимые подкожно, составили: мышь: 400 мг/кг; крыса: 500 мг/кг; морская свинка: 500 мг/кг. [37] Другое исследование этого соединения, [д] при внутривенном введении мышам LD 50 = 270 мг/кг. [63]
«Субхроническая токсичность» синефрина была признана низкой у мышей после перорального приема доз 30 и 300 мг/кг в течение 28 дней. В целом такое лечение не приводило к значительным изменениям биохимических или гематологических параметров, а также относительной массы органов, но были отмечены некоторые изменения в концентрации глутатиона (GSH) и активности глутатионпероксидазы (GPx). [87]
Безопасность/эффективность/спорность
[ редактировать ]Существуют серьезные разногласия по поводу безопасности и/или эффективности препаратов, содержащих синефрин , которые часто путают только с синефрином, иногда с м -синефрином. [16] [50] [86] [88] [89] [90] [91] [92] [93] [94] [95] [96] Кроме того, в этой литературе речь идет о смесях, содержащих синефрин только в качестве одного из нескольких биологически активных компонентов, даже в некоторых случаях без явного подтверждения присутствия синефрина.
Беспозвоночные
[ редактировать ]Было обнаружено, что у насекомых синефрин является очень сильным агонистом для многих препаратов рецепторов октопамина у беспозвоночных и даже более эффективен, чем октопамин, для нервно-мышечных препаратов саранчи ( Schistocerca americana gregaria ). [97] Синефрин (рацемический) также более эффективен, чем октопамин (рацемический), в индуцировании светового излучения в органе света светлячка ( вида Photinus ). [98] Синефрин демонстрирует столь же высокую эффективность в стимуляции активности аденилатциклазы и в уменьшении времени свертывания крови в гематоцитах омара ( Homarus americanus ). [99] Было обнаружено, что рацемический синефрин увеличивает цАМФ в эпидермисе брюшной полости кровососущего клопа Rhodnius prolixus . [100] Рачинский сообщил, что синефрин был равносилен октопамину в стимуляции высвобождения ЮГ ( ювенильного гормона ) в аллата телах медоносной пчелы ( Apis mellifera ). [101] но Вудринг и Хоффманн обнаружили, что синефрин не влияет на синтез JH III в препаратах in vitro из сверчка Gryllus bimaculatus . [102]
Сноски
[ редактировать ]- ^ Однако синефрин не фигурирует в текущей «Оранжевой книге» FDA или в «Справочнике врачей» за 2012 год .
- ^ Около 1,0–0,02 мг на порцию, исходя из размера порции ~ 20 г.
- ^ Около 1,0–0,1 мг/порцию.
- ^ Соответствует примерно 1–15 мг/порцию, исходя из размера порции 1 чашка или 250 мл.
- ^ ~ 5 х 10 −4 М.
- ^ ~ 2 х 10 −3 М.
- ^ ~ 3 × 10 −4 М.
- ^ Подвеска хвоста и принудительное плавание.
- ^ Якобы коррелирует с антидепрессивной активностью.
- ^ Адренергический антагонист, селективный в отношении α1 - рецепторов.
- ^ Обращение лекарственного препарата к гипотермии, вызванной резерпином, является классическим тестом на потенциальные антидепрессивные свойства.
- ^ Селективный ингибитор переносчика норадреналина .
- ^ Здесь именуется «окседрин».
- ^ Препарат, часто используемый в качестве селективного антагониста 5-НТ 2А .
- ^ Используется здесь как селективный антагонист 5-HT 1D .
- ^ Используется в качестве неселективного β-антагониста.
- ^ Называется «Симпатол».
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ SA, HCI Solutions. «Нео-синефрина HCl — сборник.ч» . компендиум.ч . Архивировано из оригинала 25 июля 2020 г. Проверено 6 марта 2016 г.
- ^ Вагнер Х., Ульрих-Мерцених Г. (2009). «Исследование синергии: подход к фитофармацевтике нового поколения». Фитомедицина . 16 (2–3): 97–110. doi : 10.1016/j.phymed.2008.12.018 . ПМИД 19211237 . S2CID 25766699 .
- ^ Jump up to: а б с Стюарт И., Ньюхолл В.Ф., Эдвардс Г.Дж. (1964). «Выделение и идентификация синефрина в листьях и плодах цитрусовых» . Ж. Биол. Хим . 239 (3): 930–932. дои : 10.1016/S0021-9258(18)51679-3 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б [1] [ мертвая ссылка ]
- ^ Уитон Т.А., Стюарт И. (1970). «Распределение тирамина, N-метилтирамина, хорденина, октопамина и синефрина в высших растениях». Ллойдия . 33 (2): 244–254. ПМИД 5495514 .
- ^ Ко ХК, Чен К.Т., Чен К.Ф., Су Дж.П., Чен К.М., Ван Г.Дж. (2006). «Химические и биологические сравнения Эводии с двумя родственными видами из разных мест и условий». Журнал этнофармакологии . 108 (2): 257–263. дои : 10.1016/j.jep.2006.05.020 . ПМИД 16824714 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Свинхарт Дж. А., Штермиц Ф. Р. (1980). «Бишорденинилтерпеновые алкалоиды и другие компоненты Zanthoxylum culantrillo и Z. coriaceum ». Фитохимия . 19 (6): 1219–1223. Бибкод : 1980PChem..19.1219S . дои : 10.1016/0031-9422(80)83087-1 .
- ^ Ким С.П., Мун Э., Нам Ш., Фридман М. (2012). «Состав водного экстракта Herba Pogostemonis и защита инфицированных мышей от повреждения печени и смертности, вызванных Salmonella typhimurium, путем стимуляции клеток врожденного иммунитета». Журнал сельскохозяйственной и пищевой химии . 60 (49): 12122–12130. дои : 10.1021/jf304466t . ПМИД 23186318 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Шульгин, Александр; Шульгин, Анна (1997). Тихкаль: Продолжение . Беркли: Transform Press. п. 671. ИСБН 0-9630096-9-9 .
- ^ Кусу Ф., Ли Х.-Д., Такамура К. (1992). «Определение синефрина и N-метилтирамина в жиши и жике (незрелых цитрусовых) методом высокоэффективной жидкостной хроматографии с электрохимическим детектированием» . Химический и фармацевтический вестник . 40 (12): 3284–3286. дои : 10.1248/cpb.40.3284 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Пеллати Ф., Бенвенути С., Мелегари М. (2005). «Энантиоселективный ЖХ-анализ синефрина в натуральных продуктах на хиральной стационарной фазе на основе белка». Журнал фармацевтического и биомедицинского анализа . 37 (5): 839–849. дои : 10.1016/j.jpba.2004.09.008 . ПМИД 15862657 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Маттоли Л., Канги Ф., Майдекки А., Гиара К., Тубаро М., Тральди П. (2005). «Метод быстрой жидкостной хроматографии с ионизацией и масс-спектрометрией электрораспылением для оценки синефрина в Citrus aurantium образцах L.». Журнал сельскохозяйственной и пищевой химии . 53 (26): 9860–9866. дои : 10.1021/jf051270+ . ПМИД 16366666 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Авула Б., Уппарапалли С.К., Хан И.А. (2007). «Одновременный анализ адренергических аминов и флавоноидов в джемах из кожуры цитрусовых и фруктовых соках методом жидкостной хроматографии: часть 2» . Журнал AOAC International . 90 (3): 633–40. дои : 10.1093/jaoac/90.3.633 . ПМИД 17580614 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б «Перекрестная ссылка на цитрусовых виды и общие названия » . Plantnames.unimelb.edu.au . Проверено 10 декабря 2013 г.
- ^ Jump up to: а б с д Кусу Ф., Мацумото К., Арай К., Такамура К. (1996). «Определение энантиомеров синефрина в пищевых продуктах и конъюгированного синефрина в моче методом высокоэффективной жидкостной хроматографии с электрохимическим обнаружением». Аналитическая биохимия . 235 (2): 191–194. дои : 10.1006/abio.1996.0111 . ПМИД 8833327 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с «Американский ботанический совет: корка горького апельсина и синефрин» (PDF) . Abc.herbalgram.org . Проверено 27 января 2022 г.
- ^ Драгулл К., Брекса А.П., Каин Б. (2008). «Содержание синефрина в соке мандаринов Сацума ( Citrus unshiu Marcovitch.)». Журнал сельскохозяйственной и пищевой химии . 56 (19): 8874–8878. дои : 10.1021/jf801225n . ПМИД 18771270 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Виейра С.М., Теодоро К.Х., Глория MBA (2007). «Профиль и уровень биоактивных аминов в апельсиновом соке и апельсиновых безалкогольных напитках». Пищевая химия . 100 (3): 895–903. doi : 10.1016/j.foodchem.2005.10.050 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Уку Р.М., Джаяпракаша Г.К., Нельсон С.Д., Патил Б.С. (2011). «Быстрое одновременное определение аминов и органических кислот в цитрусовых с использованием высокоэффективной жидкостной хроматографии». Таланта . 83 (3): 948–54. дои : 10.1016/j.talanta.2010.10.063 . ПМИД 21147342 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Ибрагим К.Е., Коуч М.В., Уильямс К.М., Бадд М.Б., Йост Р.А., Мидгли Дж.М. (1984). «Количественное измерение октопаминов и синефринов в моче с использованием капиллярной колоночной газовой хроматографии и масс-спектрометрии с химической ионизацией отрицательных ионов». Аналитическая химия . 56 (9): 1695–1699. дои : 10.1021/ac00273a037 . ПМИД 6435479 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ван Р., Ван Л., Ли Ц., Лю С., Хуан Ю. (2007). «Хемилюминесценция синефрина на основе системы церий (IV) – родамин Б». Люминесценция . 22 (2): 140–146. дои : 10.1002/bio.937 . ПМИД 17089346 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Уотсон Д.Г., Мидгли Дж.М., Чен Р.Н., Хуан В., Бейн Г.М., Макдональд Н.М., Рид Дж.Л., МакГи CNJ (1990). «Анализ биогенных аминов и их метаболитов в биологических тканях и жидкостях методом газовой хроматографии - масс-спектрометрии с химической ионизацией отрицательных ионов (GC-NICIMS)». Журнал фармацевтического и биомедицинского анализа . 8 (8–12): 899–904. дои : 10.1016/0731-7085(90)80139-г . ПМИД 2100639 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ибрагим К.Е., Коуч М.В., Уильямс К.М., Фрегли М.Дж., Мидгли Дж.М. (1985). « М -октопамин: нормальное явление с п -октопамином в симпатических нервах млекопитающих». Журнал нейрохимии . 44 (6): 1862–1867. дои : 10.1111/j.1471-4159.1985.tb07180.x . ПМИД 3921667 . S2CID 7376144 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Д'Андреа Г., Гранелла Ф., Леоне М., Перини Ф., Фарруджио А., Буссоне Г. (2006). «Аномальные профили следов аминов тромбоцитов при мигрени с аурой и без нее» . Цефалгия . 26 (8): 968–972. дои : 10.1111/j.1468-2982.2006.01141.x . ПМИД 16886933 . S2CID 43823090 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Д'Андреа Г., Терраццино С., Фортина Д., Фарруджио А., Ринальди Л., Леон А. (2003). «Электрохимическое обнаружение следовых аминов с помощью ВЭЖХ в плазме и тромбоцитах человека и экспрессия транскриптов мРНК рецепторов следовых аминов в циркулирующих лейкоцитах». Письма по неврологии . 346 (1–2): 89–92. дои : 10.1016/s0304-3940(03)00573-1 . ПМИД 12850555 . S2CID 1673803 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Пеллати Ф., Бенвенути С., Мелегари М., Фиренцуоли Ф. (2002). «Определение адренергических агонистов из экстрактов и растительных продуктов Citrus aurantium L. var. amara методом LC». Журнал фармацевтического и биомедицинского анализа . 29 (6): 1113–1119. дои : 10.1016/s0731-7085(02)00153-x . ПМИД 12110397 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Пеллати Ф., Каннацца Г., Бенвенути С. (2010). «Исследование рацемизации синефрина с помощью внеколоночной хиральной высокоэффективной жидкостной хроматографии». Журнал хроматографии А. 1217 (21): 3503–3510. дои : 10.1016/j.chroma.2010.03.026 . ПМИД 20399443 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кусу Ф., Мацумото К., Такамура К. (1995). «Прямое разделение и определение энантиомеров синефрина методом высокоэффективной жидкостной хроматографии с электрохимическим детектированием» . Химический и фармацевтический вестник . 43 (7): 1158–1161. дои : 10.1248/cpb.43.1158 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Раньери Р.Л., Маклафлин Дж.Л. (1976). «Алкалоиды кактуса. XXVIII. β-фенэтиламин и тетрагидроизохинолиновые алкалоиды из мексиканского кактуса Dolichothele longimamma ». Журнал органической химии . 41 (2): 319–323. дои : 10.1021/jo00864a030 .
- ^ Jump up to: а б Уитон Т.А., Стюарт И. (1969). «Биосинтез синефрина в цитрусовых». Фитохимия . 8 (1): 85–92. Бибкод : 1969PChem...8...85W . дои : 10.1016/s0031-9422(00)85799-4 .
- ^ Бартли А. П. Брекса III, Исида Б. К. (2010). «ПЦР-амплификация и клонирование тирозиндекарбоксилазы, участвующей в биосинтезе синефрина в цитрусовых». Новая биотехнология . 27 (4): 308–316. дои : 10.1016/j.nbt.2010.04.003 . ПМИД 20403465 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Jump up to: а б Сантана Дж., Шарплесс К.Е., Нельсон BC (2008). «Определение позиционных изомеров парасинефрина и метасинефрина в пищевых добавках, содержащих горький апельсин, методами ЖХ/УФ и ЖХ/МС/МС». Пищевая химия . 109 (3): 675–682. doi : 10.1016/j.foodchem.2007.12.076 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Халлер, Калифорния; Беновиц, Нидерланды; Джейкоб п, 3-е место (2005). «Гемодинамические эффекты добавок для похудания без эфедры у людей». Американский медицинский журнал . 118 (9): 998–1003. doi : 10.1016/j.amjmed.2005.02.034 . ПМИД 16164886 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Jump up to: а б с Лэш Ф (1927). «О фармакологии симпатола, нового адреналиноподобного вещества. (Одновременно вклад в вопрос химического строения и фармакодинамических эффектов)». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга . 124 (3–4): 231–244. дои : 10.1007/bf01861902 . S2CID 24160900 .
- ^ Хохрейн М., Келлер Дж. (1930). «О влиянии адреналина и связанных с адреналином тел (симпатол и эфетонин) на систему кровообращения». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга . 156 :37–63. дои : 10.1007/bf01859312 . S2CID 28747772 .
- ^ Х. Легерлотц, патент США 1932347 (24 октября 1933 г.).
- ^ Jump up to: а б с д Стоктон А.Б., Пейс П.Т., Тейнтер М.Л. (1931). «Некоторые клинические действия и терапевтическое применение рацемического синефрина». Журнал фармакологии и экспериментальной терапии . 41 : 11–20.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж г Тейнтер М.Л., Зайденфельд М.А. (1930). «Сравнительное действие симпатомиметических соединений: изомеров синефрина и -кетона». Дж. Фармакол. Эксп. Там . 40 : 23–42.
- ^ «Совет по фармации и химии». Журнал Американской медицинской ассоциации . 94 (18): 1404. 1930. doi : 10.1001/jama.1930.02710440042013 .
- ^ Jump up to: а б Хартунг В. (1931). «Адреналин и родственные соединения: влияние структуры на физиологическую активность». Химические обзоры . 9 (3): 389–468. дои : 10.1021/cr60034a002 .
- ^ Редакционная (1944). «Симпатол-Стернс – триумф медицинской дезинформации для врачей». Журнал Американской медицинской ассоциации . 124 (14): 988. дои : 10.1001/jama.1944.02850140034013 .
- ^ JR DiPalma (ред.) (1965), Фармакология Дрилла в медицине, 3-е изд. , с.494, МакГроу-Хилл, Нью-Йорк.
- ^ Jump up to: а б К. Уилсон, О. Гисволд и Р. Ф. Дорж (ред.) (1966). Учебник органической медицинской и фармацевтической химии, 5-е изд., стр. 438, Липпинкотт, Филадельфия.
- ^ DM Авиадо (ред.), 1972. Фармакологические принципы медицинской практики Кранца и Карра, 8-е изд. , с.526, Williams & Wilkins, Балтимор.
- ^ RC Базелт (2008). Удаление токсичных лекарств и химикатов у человека (8-е изд.), стр. 1471–2, Biomedical Publications, Фостер-Сити, Калифорния. ISBN 978-0-9626523-7-0 .
- ^ https://www.mims.com/USA/drug/info/oxedrine/?type=full&mtype=generic [ постоянная мертвая ссылка ]
- ^ Jump up to: а б Россато Л.Г., Коста В.М., Лимбергер Р.П., де Лурдес Бастос М., Ремиан Ф. (2011). «Синефрин: от следовых концентраций до массового потребления для снижения веса». Пищевая и химическая токсикология . 49 (1): 8–16. дои : 10.1016/j.fct.2010.11.007 . ПМИД 21075161 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Пензак С.Р., Янн М.В., Колд Дж.А., Хон YY, Десаи HD, Герли БиДжей (2001). «Севильский (кислый) апельсиновый сок: содержание синефрина и сердечно-сосудистые эффекты у взрослых с нормальным давлением». Журнал клинической фармакологии . 41 (10): 1059–1063. дои : 10.1177/00912700122012652 . ПМИД 11583473 . S2CID 32631329 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Каппе Т., Армстронг, доктор медицины (1965). «Спектры ультрафиолетового поглощения и кажущиеся константы кислотной диссоциации некоторых фенольных аминов». Журнал медицинской химии . 8 (3): 368–374. дои : 10.1021/jm00327a018 . ПМИД 14323148 .
- ^ Бергманн Э.Д., Зульцбахер М. (1951). «Новый синтез 1-( м- и п- гидроксифенил)-2-метиламиноэтанола ( м- и п -симпатола)». Журнал органической химии . 16 : 84–89. дои : 10.1021/jo01141a013 .
- ^ Индекс Merck, 10-е изд. (1983), с. 1295, Merck & Co., Рэуэй, Нью-Джерси.
- ^ Jump up to: а б с д Дж. М. Миджли, К. М. Тонур, А. Ф. Дрейк, К. М. Уильямс, А. Е. Козиол и Г. Дж. Паленик (1989). «Разрешение и абсолютная конфигурация изомерных октопаминов и синефринов с помощью рентгеновской кристаллографии». Дж. Хим. Soc., Перкин Транс. 2 963-969.
- ^ Пристли Х.М., Монесс Э. (1940). «Исследование промежуточных продуктов получения симпатола». Дж. Орг. Хим . 40 (4): 355–361. дои : 10.1021/jo01210a004 .
- ^ Бергманн Э.Д., Зульцбахер М. (1951). «Новый синтез 1-( м- и п- гидроксифенил)-2-метиламиноэтанола ( м- и п -симпатола)». Журнал органической химии . 16 : 84–89. дои : 10.1021/jo01141a013 .
- ^ Лэндс А.М., Рикардс Э.Э., Нэш В.Л., Хупер К.З. (1947). «Фармакология вазодепрессорных соединений, структурно связанных с симпатомиметическими аминами». Журнал фармакологии и экспериментальной терапии . 89 (4): 297–305. ПМИД 20295509 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Унна К (1951). «Фармакологические исследования новых производных симпатола». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга . 213 : 207–234. дои : 10.1007/bf02432757 . S2CID 30482120 .
- ^ Маккалок Дж., Дешмух В.Д., Харпер А.М. (1978). «Непрямые симпатомиметики, мозговой кровоток и метаболизм». Европейский журнал фармакологии . 47 (1): 11–8. дои : 10.1016/0014-2999(78)90368-0 . ПМИД 412682 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Эхрисманн О., Малофф Г. (1928). «О двух ядах группы адреналина ( п- оксифенилэтанолметиламин и его кетон». Архив Наунин-Шмидебергс по экспериментальной патологии и фармакологии . 136 (3–4): 172–184. doi : 10.1007/bf01862149 . S2CID 21414110 .
- ^ Г. Кущинский (1930)). «Исследования Симпатола, адреналинового тела». Архив экспериментальной патологии и фармакологии Наунина-Шмидебергса 156 290–308.
- ^ Jump up to: а б Лэндс А.М., Грант Дж.И. (1952). «Вазопрессорное действие и токсичность производных циклогексилэтиламина». Журнал фармакологии и экспериментальной терапии . 106 (3): 341–345. ПМИД 13000630 .
- ^ Папп Л. Секерес (1968). «Аритмогенное действие симпатомиметических аминов». Европейский журнал фармакологии . 3 (1): 4–14. дои : 10.1016/0014-2999(68)90042-3 . ПМИД 4968334 .
- ^ Сон Д.-К., Су Х.-В., Юнг Ж.-С., Ви М.-Б., Сон К.-Х., Ким Й.-Х. (1996). «Антидепрессантоподобные эффекты п -синефрина в мышиных моделях тестов на неподвижность». Письма по неврологии . 214 (2–3): 107–110. дои : 10.1016/0304-3940(96)12895-0 . ПМИД 8878095 . S2CID 28440606 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ким К.-В., Ким Х.-Д., Юнг Дж.-С., Ву Р.-С., Ким Х.-С., Су Х.-В., Ким Й.-Х., Сон Д.-К. (2001). «Характеристика антидепрессантоподобных эффектов стереоизомеров п -синефрина». Архив фармакологии Наунина-Шмидеберга . 364 (1): 21–26. дои : 10.1007/s002100100416 . ПМИД 11485034 . S2CID 12625027 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бурген АСВ, Иверсен ЛЛ (1964). «Ингибирование поглощения норадреналина симпатомиметическими аминами в изолированном сердце крысы» . Британский журнал фармакологии и химиотерапии . 25 (1): 34–49. дои : 10.1111/j.1476-5381.1965.tb01754.x . ПМЦ 1510671 . ПМИД 19108208 .
- ^ Викберг Дж.Э.С. (1978). «Фармакологическая классификация адренергических α-рецепторов морской свинки». Природа . 273 (5658): 164–166. Бибкод : 1978Natur.273..164W . дои : 10.1038/273164a0 . ПМИД 25390 . S2CID 4278917 .
- ^ Jump up to: а б Браун СМ, МакГрат Дж. К., Мидгли Дж. М., Мьюир А.Г.Б., О'Брайен Дж. В., Тонур СМ, Уильямс СМ, Уилсон В. Г. (1988). «Активность стереоизомеров октопамина и синефрина на α-адренорецепторы» . Британский журнал фармакологии . 93 (2): 417–429. дои : 10.1111/j.1476-5381.1988.tb11449.x . ПМЦ 1853804 . ПМИД 2833972 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Руффоло Р.Р., Уодделл Дж.Э. (1983). «Ароматическое и бензильное гидроксильное замещение имидазолинов и фенилэтиламинов: различия в активности альфа-1 и альфа-2 адренергических рецепторов». Журнал фармакологии и экспериментальной терапии . 224 (3): 559–566. ПМИД 6131121 .
- ^ Хибино Т., Юзурихара М., Касе Ю., Такеда А. (2009). «Синефрин, компонент Evodiae Fructus, сужает изолированную аорту крысы через адренергические и серотонинергические рецепторы» . Журнал фармакологических наук . 111 (1): 73–81. дои : 10.1254/jphs.09077fp . ПМИД 19721332 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джордан Р., Мидгли Дж. М., Тонур СМ, Уильямс СМ (1987). «Бета-адренергическая активность стереоизомеров октопамина и синефрина на изолированных предсердиях и трахее морских свинок». Дж. Фарм. Фармакол . 39 (9): 752–754. дои : 10.1111/j.2042-7158.1987.tb06986.x . ПМИД 2890747 . S2CID 38557968 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Карпене К., Галицки Дж., Фонтана Э., Атжи К., Лафонтан М., Берлан М. (1999). «Селективная активация β3-адренорецепторов октопамином: сравнительные исследования в жировых клетках млекопитающих». Архив фармакологии Наунина-Шмидеберга . 359 (4): 310–321. дои : 10.1007/pl00005357 . ПМИД 10344530 . S2CID 34370879 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ма Г., Бавадека С.А., Шанеберг Б.Т., Хан И.А., Феллер Д.Р. (2010). «Влияние синефрина и бета-фенилэфрина на подтипы альфа-адренорецепторов человека». Планта Медика . 76 (10): 981–986. дои : 10.1055/s-0029-1240884 . ПМИД 20217639 . S2CID 41387315 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Линдеманн, Лотар; Хенер, Мариус К. (2005). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–81. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Уэйнскотт Д.Б., Литтл С.П., Инь Т., Ту Ю., Рокко В.П., Хе Дж.К., Нельсон Д.Л. (2007). «Фармакологическая характеристика клонированного человеческого рецептора 1, связанного с следовым амином (TAAR1), и доказательства видовых различий с крысиным TAAR1». Журнал фармакологии и экспериментальной терапии . 320 (1): 475–485. дои : 10.1124/jpet.106.112532 . ПМИД 17038507 . S2CID 10829497 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Хенгстманн Дж. Х., Аулеп Х. (1978). «Фармакокинетика и метаболизм 3 H-синефрин». Drug Research . 28 : 2326–2331.
- ^ Судзуки О., Мацумото Т., Оя М., Кацумата Ю. (1979). «Окисление синефрина моноаминоксидазой типа А и типа В». Эксперименты . 35 (10): 1283–1284. дои : 10.1007/bf01963957 . ПМИД 499398 . S2CID 6129913 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ У. фон Эйлер и Г. Лильестранд (1929). Скандал. Арх. Физиол. 55 1.
- ^ Поле Ф., Сарр Х. (1940). «Механизм действия нового агента периферического кровообращения по сравнению с веритолом и симпатолом у людей». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга . 196 (2–5): 408–430. дои : 10.1007/bf01861124 . S2CID 34593711 .
- ^ Дом Ф (1948). «Об эффективности симпатола в отношении артериального давления у людей после предварительного лечения эфедрином, веритолом и первитином». Архив экспериментальной патологии и фармакологии Наунина-Шмидеберга . 205 (4–5): 470–479. дои : 10.1007/bf00246173 . S2CID 25139273 .
- ^ Натансон М.Х., Миллер Х. (1950). «Влияние новых препаратов на ритмическую функцию сердца» . Калифорния, Мед . 72 (4): 215–221. ПМЦ 1520549 . ПМИД 18731684 .
- ^ Jump up to: а б Хофстеттер, Р.; Кройдер, Дж.; Бернут, Г. (1985). «Влияние окседрина на левый желудочек и периферическое сосудистое сопротивление». Исследования наркотиков . 35 (12): 1844–6. ПМИД 4096743 .
- ^ Тифензее К (1932). «Терапия бронхиальной астмы адреналином и производными адреналина эфедрином и симпатолом». Журнал аллергии . 4 : 81. дои : 10.1016/s0021-8707(32)90053-7 .
- ^ Фуг-Берман, Адриан; Майерс, Адам (2004). «Citrus aurantium, ингредиент пищевых добавок, продаваемых для снижения веса: текущее состояние клинических и фундаментальных исследований». Экспериментальная биология и медицина . 229 (8): 698–704. дои : 10.1177/153537020422900802 . ПМИД 15337824 . S2CID 35942851 .
- ^ Jump up to: а б Стохс С.Дж., Пройсс Х.Г., Шара М. (2011). «Безопасность Citrus aurantium (горький апельсин) и его основного протоалкалоида п -синефрина». Фитотерапевтические исследования . 25 (10): 1421–1428. дои : 10.1002/ptr.3490 . ПМИД 21480414 . S2CID 32789083 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Арбо М.Д., Шмитт Г.К., Лимбергер М.Ф., Чаран М.Ф., Моро А. М., Рибейро Г.Л., Даллегрейв Э., Гарсия С.С., Леал М.Б., Лимбергер Р.П. (2009). «Субхроническая токсичность экстракта Citrus aurantium L. (Rutaceae) и п -синефрина у мышей». Нормативная токсикология и фармакология . 54 (2): 114–117. дои : 10.1016/j.yrtph.2009.03.001 . ПМИД 19275924 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Насир Дж. М., Дёрнинг С. Дж., Фергюсон М., Барольд Х. С., Хейни MC (2004). «Обморок, вызванный физической нагрузкой, связанный с удлинением интервала QT и ксенадрин без эфедры» . Труды клиники Мэйо . 79 (8): 1059–1062. дои : 10.4065/79.8.1059 . ПМИД 15301335 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бушар Н., Хоффман Р.С. (2004). «Синефрин — это не неосинефрин» . Труды клиники Мэйо . 79 (12): 1589–1590. дои : 10.4065/79.12.1589-б . ПМИД 15595351 .
- ^ Бент С., Падула А., Нойхаус Дж. (2004). «Безопасность и эффективность Citrus aurantium для похудения». Американский журнал кардиологии . 94 (10): 1359–1361. дои : 10.1016/j.amjcard.2004.07.137 . ПМИД 15541270 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бушар, Северная Каролина, Хоуленд, Массачусетс, Греллер Х.А., Хоффман Р.С., Нельсон Л.С. (2005). «Ишемический инсульт, связанный с использованием пищевой добавки без эфедры, содержащей синефрин» . Труды клиники Мэйо . 80 (4): 541–545. дои : 10.4065/80.4.541 . ПМИД 15819293 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фиренцуоли Ф., Гори Л., Галапай К. (2005). «Побочная реакция на адренергический экстракт трав ( Citrus aurantium )». Фитомедицина . 12 (3): 247–248. doi : 10.1016/j.phymed.2004.02.005 . ПМИД 15830849 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Хааз С., Фонтейн К.Р., Каттер Г., Лимди Н., Перумин-Чейни С., Эллисон Д.Б. (2006). « Citrus aurantium и алкалоиды синефрина в лечении избыточного веса и ожирения: обновленная информация». Обзоры ожирения . 7 (1): 79–88. дои : 10.1111/j.1467-789x.2006.00195.x . ПМИД 16436104 . S2CID 13842012 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Томас Дж. Э., Мунир Дж. А., Макинтайр П. З., Фергюсон М. А. (2009). «ИМпST у 24-летнего мужчины после приема синефринсодержащей пищевой добавки: описание случая и обзор литературы» . Журнал Техасского института сердца . 36 (6): 586–90. ПМК 2801940 . ПМИД 20069086 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Томас Дж. Э., Мунир Дж. А., Макинтайр П. З., Фергюсон М. А. (2010). «Отсутствие доказательств того, что п -синефрин ответственен за ИМпST» . Журнал Техасского института сердца . 37 (3): 383–384. ПМК 2879205 . ПМИД 20548833 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Стохс С.Дж. (2010). «Оценка отчетов о нежелательных явлениях, связанных с Citrus aurantium (горький апельсин) с апреля 2004 г. по октябрь 2009 г.». Журнал функциональных продуктов питания . 2 (4): 235–239. дои : 10.1016/j.jff.2010.10.003 .
- ^ Эванс П.Д. (1981). «Несколько типов рецепторов октопамина у саранчи» . Журнал физиологии . 318 : 99–122. дои : 10.1113/jphysicalol.1981.sp013853 . ПМЦ 1245480 . ПМИД 6275071 .
- ^ Карлсон А.Д. (1968). «Влияние лекарств на люминесценцию личинок светлячков». Журнал экспериментальной биологии . 49 (1): 195–199. дои : 10.1242/jeb.49.1.195 . ПМИД 4386272 .
- ^ Баттель А., Кравиц Э.А. (1978). «Цели действия октопамина на омаров: изменения циклических нуклеотидов и физиологические эффекты в гемолимфе, сердце и экзоскелетных мышцах». Дж. Фармакол. Эксп. Там . 205 (2): 438–448. ПМИД 347053 .
- ^ Барретт М., Орчард И. (1990). «Вызванное серотонином повышение уровня цАМФ в эпидермисе кровососущего клопа Rhodnius prolixus ». Журнал физиологии насекомых . 36 (9): 625–633. дои : 10.1016/0022-1910(90)90066-о .
- ^ Рачинский А (1994). «Влияние октопамина и серотонина на активность тел аллата личинок медоносных пчел ( Apis mellifera )». Журнал физиологии насекомых . 40 (7): 549–554. дои : 10.1016/0022-1910(94)90141-4 .
- ^ Вудринг Дж., Хоффманн К.Х. (1994). «Влияние октопамина, дофамина и серотонина на синтез ювенильных гормонов, In vitro, у сверчка Gryllus bimaculatus ». Журнал физиологии насекомых . 40 (9): 797–802. дои : 10.1016/0022-1910(94)90009-4 .