4-гидроксимфетамин
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Гидроксиамфетамин, Паредрин |
| Другие имена | гидроксиамфетамин ( США, США ) |
| Маршруты администрация | Глазные капли |
| код АТС |
|
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.002.866 |
| Химические и физические данные | |
| Формула | C9H13NC9H13NO |
| Молярная масса | 151.209 g·mol −1 |
| 3D model ( JSmol ) | |
| |
| |
| (проверять) | |
4-Гидроксиамфетамин ( 4HA ), также известный как гидроксиамфетамин , гидроксиамфетамин , оксамфетамин , норфоледрин , пара -гидроксиамфетамин и α-метилтирамин , представляет собой препарат, который стимулирует симпатическую нервную систему .
В медицине его используют в виде глазных капель для расширения зрачка (процесс, называемый мидриазом ), чтобы можно было осмотреть заднюю часть глаза. также является основным метаболитом амфетамина Он и некоторых замещенных амфетаминов .
Медицинское использование
[ редактировать ]4-Гидроксиамфетамин используется в глазных каплях для расширения зрачка (процесс, называемый мидриазом ), чтобы можно было осмотреть заднюю часть глаза. Это диагностический тест на синдром Горнера . У пациентов с синдромом Горнера наблюдается анизокория, вызванная поражением нервов, которые соединяются с назоцилиарной ветвью глазного нерва . [1] Нанесение 4-гидроксиамфетамина на глаз может указать, является ли поражение преганглионарным или постганглионарным, в зависимости от реакции зрачка. Если зрачок расширяется, поражение преганглионарное. Если зрачок не расширяется, поражение постганглионарное. [1]
4-гидроксиамфетамин имеет некоторые ограничения при использовании в качестве диагностического инструмента. Если он предназначен для немедленного наблюдения за другим мидриатическим препаратом ( кокаином или апраклонидином ), то пациенту придется подождать от дня до недели, прежде чем можно будет ввести 4-гидроксиамфетамин. [2] [3] Он также имеет тенденцию к ошибочной локализации поражений. Ложная локализация может возникнуть в случаях острого начала; в случаях, когда имеется постганглионарное поражение, но нерв еще реагирует на остаточный норадреналин; или в случаях, когда несвязанное повреждение нервов маскирует наличие преганглионарного поражения. [1] [2]
Фармакология
[ редактировать ]Как и амфетамин, 4-гидроксиамфетамин является агонистом человеческого TAAR1 . [4] 4-Гидроксиамфетамин действует как непрямой симпатомиметик и вызывает высвобождение норадреналина из нервных синапсов, что приводит к мидриазу (расширению зрачков). [3] [5]
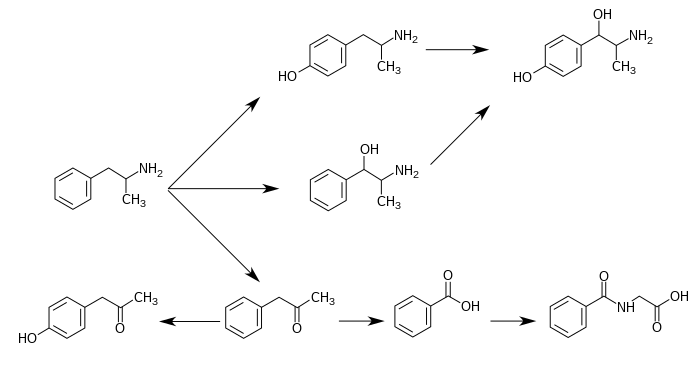
Он снижает метаболизм серотонина (5-гидрокситриптамина) и некоторых других моноаминов путем ингибирования активности семейства ферментов, называемых моноаминоксидазами (МАО), особенно типа А ( МАО-А ). [ нужна ссылка ] Ингибирование МАО-А предотвращает метаболизм серотонина и катехоламинов в пресинаптической терминали и, таким образом, увеличивает количество нейротрансмиттеров, доступных для высвобождения в синаптическую щель . [6] является основным метаболитом амфетамина 4- Гидроксиамфетамин и второстепенным метаболитом метамфетамина . У людей амфетамин метаболизируется до 4-гидроксиамфетамина с помощью CYP2D6 , который является членом суперсемейства цитохрома P450 и обнаруживается в печени. [7] [8] Затем 4-гидроксиамфетамин метаболизируется дофамин-бета-гидроксилазой в 4-гидроксинорэфедрин или выводится с мочой. [5]
Метаболические пути амфетамина у человека [источники 1] |
Коммерциализация
[ редактировать ]Гидроксиамфетамин является компонентом двух контролируемых (только по рецепту) известных офтальмологических мидриатиков: Паредрина и Паремида . Паредрин представляет собой 1% раствор гидробромида гидроксиамфетамина. [20] : 543 в то время как Паремид состоит из комбинации 1% гидробромида гидроксиамфетамина и 0,25% тропикамида . [21] В 1990-е годы права на торговые марки, патенты и новые заявки на лекарства (NDA) для этих двух препаратов были обменены между несколькими различными производителями после нехватки сырья, необходимого для их производства, что привело к тому, что оба препарата были сняты с производства на неопределенный срок. рынок. [22] Примерно в 1997 году компания Akorn, Inc. получила права на Паредрин и Паремид. [23] а в 2002 году компания вновь представила на рынке Паремид как быстродействующий офтальмологический мидриатический препарат. [21] [24] [25]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ 4-гидроксиамфетамин Было показано, что метаболизируется в 4-гидроксинорэфедрин под действием дофамин-бета-гидроксилазы (DBH) in vitro , и предполагается, что он метаболизируется аналогичным образом in vivo . [10] [15] Данные исследований, в которых измерялось влияние концентраций DBH в сыворотке крови на метаболизм 4-гидроксиамфетамина у людей, позволяют предположить, что другой фермент может опосредовать превращение 4-гидроксиамфетамина в 4-гидроксинорэфедрин ; [15] [17] однако другие данные исследований на животных позволяют предположить, что эта реакция катализируется DBH в синаптических везикулах норадренергических нейронов головного мозга. [18] [19]
Справочные примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ а б с Уолтон К.А., Буоно Л.М. (декабрь 2003 г.). «Синдром Горнера». Современное мнение в офтальмологии . 14 (6): 357–63. дои : 10.1097/00055735-200312000-00007 . ПМИД 14615640 . S2CID 11262166 .
- ^ а б Даваньянам И., Фрейзер К.Л., Мишкиэль К., Дэниел К.С., Plant GT (март 2013 г.). «Синдром Горнера взрослых: комбинированный клинический, фармакологический и визуализирующий алгоритм» . Глаз . 27 (3): 291–8. дои : 10.1038/eye.2012.281 . ПМЦ 3597883 . ПМИД 23370415 .
- ^ а б Лепор Ф.Э. (1985). «Диагностическая фармакология ученика». Клиническая нейрофармакология . 8 (1): 27–37. дои : 10.1097/00002826-198503000-00003 . ПМИД 3884149 .
- ^ Левин А.Х., Миллер ГМ, Гилмор Б. (декабрь 2011 г.). «Рецептор 1, связанный с следовым амином, представляет собой стереоселективный сайт связывания соединений класса амфетаминов» . Биоорганическая и медицинская химия . 19 (23): 7044–7048. дои : 10.1016/j.bmc.2011.10.007 . ПМК 3236098 . ПМИД 22037049 .
- ^ а б Чо А.К., Райт Дж. (февраль 1978 г.). «Пути метаболизма амфетамина и родственных соединений». Науки о жизни . 22 (5): 363–72. дои : 10.1016/0024-3205(78)90282-5 . ПМИД 347211 .
- ^ Накагавасаи О., Араи Ю., Сато С.Е., Сато Н., Неда М., Ходзуми М. и др. (январь 2004 г.). «Моноаминоксидаза и реакция подергивания головы у мышей. Механизмы действия альфа-метилированных производных субстрата». Нейротоксикология . 25 (1–2): 223–32. дои : 10.1016/S0161-813X(03)00101-3 . ПМИД 14697897 .
- ^ Марковиц Дж.С., Патрик К.С. (2001). «Фармакокинетические и фармакодинамические взаимодействия лекарств при лечении синдрома дефицита внимания и гиперактивности». Клиническая фармакокинетика . 40 (10): 753–72. дои : 10.2165/00003088-200140100-00004 . ПМИД 11707061 . S2CID 20884365 .
- ^ Хэфели В., Бартолини Г., Плетчер А. (1976). «Моноаминергические препараты: общая фармакология». Фармакология и терапия Б . 2 (1): 185–218. дои : 10.1016/0306-039x(76)90030-1 . ПМИД 817330 .
- ^ «Информация о назначении Adderall XR» (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Shire US Inc., декабрь 2013 г., стр. 12–13 . Проверено 30 декабря 2013 г.
- ^ а б Гленнон Р.А. (2013). «Стимуляторы фенилизопропиламина: агенты, связанные с амфетамином» . В Лемке Т.Л., Уильямс Д.А., Рош В.Ф., Зито В. (ред.). Принципы медицинской химии Фоя (7-е изд.). Филадельфия, США: Wolters Kluwer Health/Lippincott Williams & Wilkins. стр. 646–648. ISBN 9781609133450 .
Простейший незамещенный фенилизопропиламин, 1-фенил-2-аминопропан или амфетамин, служит общей структурной матрицей для галлюциногенов и психостимуляторов. Амфетамин оказывает центральное стимулирующее, аноректическое и симпатомиметическое действие и является прототипом этого класса (39). ... Фаза 1 метаболизма аналогов амфетамина катализируется двумя системами: цитохромом P450 и флавинмонооксигеназой. ... Амфетамин также может подвергаться ароматическому гидроксилированию до п -гидроксиамфетамина. ... Последующее окисление в бензильном положении DA-β-гидроксилазой дает п- гидроксинорэфедрин. Альтернативно, прямое окисление амфетамина DA-β-гидроксилазой может дать норэфедрин.
- ^ Тейлор КБ (январь 1974 г.). «Дофамин-бета-гидроксилаза. Стереохимический ход реакции» (PDF) . Журнал биологической химии . 249 (2): 454–458. дои : 10.1016/S0021-9258(19)43051-2 . ПМИД 4809526 . Проверено 6 ноября 2014 г.
Дофамин-β-гидроксилаза катализирует удаление атома водорода про- R и образование 1-норэфедрина, (2S , 1R ) -2-амино-1-гидроксил-1-фенилпропана из d -амфетамина.
- ^ Крюгер С.К., Уильямс Д.Э. (июнь 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура/функция, генетический полиморфизм и роль в метаболизме лекарств» . Фармакология и терапия . 106 (3): 357–387. doi : 10.1016/j.pharmthera.2005.01.001 . ПМК 1828602 . ПМИД 15922018 .
Таблица 5: N-содержащие препараты и ксенобиотики, оксигенированные FMO - ^ Кэшман-младший, Сюн Ю.Н., Сюй Л., Яновский А. (март 1999 г.). «N-оксигенация амфетамина и метамфетамина человеческой флавинсодержащей монооксигеназой (форма 3): роль в биоактивации и детоксикации». Журнал фармакологии и экспериментальной терапии . 288 (3): 1251–1260. ПМИД 10027866 .
- ^ Сантагати Н.А., Феррара Г., Марраццо А., Ронсисвалле Г. (сентябрь 2002 г.). «Одновременное определение амфетамина и одного из его метаболитов методом ВЭЖХ с электрохимическим обнаружением». Журнал фармацевтического и биомедицинского анализа . 30 (2): 247–255. дои : 10.1016/S0731-7085(02)00330-8 . ПМИД 12191709 .
- ^ а б с Сьердсма А., фон Штудниц В. (апрель 1963 г.). «Активность дофамин-бета-оксидазы у человека при использовании гидроксиамфетамина в качестве субстрата» . Британский журнал фармакологии и химиотерапии . 20 (2): 278–284. дои : 10.1111/j.1476-5381.1963.tb01467.x . ПМК 1703637 . ПМИД 13977820 .
Гидроксиамфетамин вводили перорально пяти людям... Поскольку превращение гидроксиамфетамина в гидроксинорэфедрин происходит in vitro под действием дофамин-β-оксидазы, предложен простой метод измерения активности этого фермента и действия его ингибиторов на человека. . ... Отсутствие эффекта от введения неомицина одному пациенту свидетельствует о том, что гидроксилирование происходит в тканях организма. ... основная часть β-гидроксилирования гидроксиамфетамина происходит в тканях, не относящихся к надпочечникам. К сожалению, в настоящее время нельзя быть полностью уверенным в том, что гидроксилирование гидроксиамфетамина in vivo осуществляется тем же ферментом, который превращает дофамин в норадреналин.
- ^ Баденхорст К.П., ван дер Слюс Р., Эразмус Э., ван Дейк А.А. (сентябрь 2013 г.). «Глициновая конъюгация: значение в метаболизме, роль глицин-N-ацилтрансферазы и факторы, влияющие на межиндивидуальные вариации». Экспертное заключение по метаболизму и токсикологии лекарственных средств . 9 (9): 1139–1153. дои : 10.1517/17425255.2013.796929 . ПМИД 23650932 . S2CID 23738007 .
Рисунок 1. Глициновая конъюгация бензойной кислоты. Путь конъюгации глицина состоит из двух этапов. Сначала бензоат лигируется с CoASH с образованием высокоэнергетического тиоэфира бензоил-КоА. Эта реакция катализируется лигазами среднецепочечная кислота HXM-A и HXM-B:CoA и требует энергии в виде АТФ. ... Бензоил-КоА затем конъюгируется с глицином с помощью GLYAT с образованием гиппуровой кислоты, высвобождая CoASH. В дополнение к факторам, перечисленным в рамках, уровни АТФ, КоАСГ и глицина могут влиять на общую скорость пути конъюгации глицина.
- ^ Хорвиц Д., Александр Р.В., Ловенберг В., Кейзер Х.Р. (май 1973 г.). «Дофамин-β-гидроксилаза сыворотки человека. Связь с гипертонией и симпатической активностью». Исследование кровообращения . 32 (5): 594–599. дои : 10.1161/01.RES.32.5.594 . ПМИД 4713201 . S2CID 28641000 .
Биологическое значение различных уровней активности DβH в сыворотке изучали двумя способами. Во-первых, способность in vivo β-гидроксилировать синтетический субстрат гидроксиамфетамин сравнивали у двух субъектов с низкой активностью DβH в сыворотке и у двух субъектов со средней активностью. ... В одном исследовании гидроксиамфетамин (паредрин), синтетический субстрат DβH, вводили субъектам с низким или средним уровнем активности DβH в сыворотке. Процент препарата, гидроксилированного до гидроксинорэфедрина, был сопоставим у всех испытуемых (6,5–9,62) (табл. 3).
- ^ Фриман Джей Джей, Сульсер Ф (декабрь 1974 г.). «Образование п-гидроксинорэфедрина в головном мозге после внутрижелудочкового введения п-гидроксиамфетамина». Нейрофармакология . 13 (12): 1187–1190. дои : 10.1016/0028-3908(74)90069-0 . ПМИД 4457764 .
У видов, у которых основным путем метаболизма является ароматическое гидроксилирование амфетамина, п- гидроксиамфетамин (POH) и п- гидроксинорэфедрин (PHN) могут вносить вклад в фармакологический профиль исходного препарата. ... Расположение реакций p- гидроксилирования и β-гидроксилирования важно для видов, у которых ароматическое гидроксилирование амфетамина является преобладающим путем метаболизма. После системного введения амфетамина крысам ПОН был обнаружен в моче и плазме.
Наблюдаемое отсутствие значительного накопления PHN в головном мозге после внутрижелудочкового введения (+)-амфетамина и образование заметных количеств PHN из (+)-POH в ткани головного мозга in vivo подтверждает точку зрения, что ароматическое гидроксилирование амфетамина после его системное введение происходит преимущественно на периферии, и затем POH транспортируется через гематоэнцефалический барьер, поглощаясь норадренергическими нейронами головного мозга, где (+)-POH преобразуется в везикулах-хранилищах под действием дофамин-β-гидроксилазы в PHN. - ^ Мацуда Л.А., Хэнсон Г.Р., Гибб Дж.В. (декабрь 1989 г.). «Нейрохимические эффекты метаболитов амфетамина на центральные дофаминергические и серотонинергические системы». Журнал фармакологии и экспериментальной терапии . 251 (3): 901–908. ПМИД 2600821 .
Метаболизм p -OHA в p -OHNor хорошо известен, и дофамин-β-гидроксилаза, присутствующая в норадренергических нейронах, может легко превращать p -OHA в p -OHNor после внутрижелудочкового введения.
- ^ Сламовиц Т.Л., Глейзер Дж.С. (1999). «Ученики и жилье». В Глейзере Дж.С. (ред.). Нейроофтальмология . Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс. ISBN 978-0781717298 .
- ^ а б «Гидроксиамфетамина гидробромид; тропикамид» . Оранжевая книга: Утвержденные лекарственные препараты, прошедшие оценку терапевтической эквивалентности . Архивировано из оригинала 4 марта 2016 года.
- ^ «Akorn приобретает паредрин — специальный офтальмологический диагностический продукт от Pharmics, Inc» . Пресс-релиз Акорна . 24 марта 1999 года. Архивировано из оригинала 16 сентября 2018 года . Проверено 9 декабря 2014 г.
- ^ «Пресс-релиз Акорн» . [ постоянная мертвая ссылка ]
- ^ «Хронология Акорна» . Архивировано из оригинала 26 июня 2019 года . Проверено 9 декабря 2014 г.
- ^ Луркотт Р. (1 декабря 2002 г.). «Уникальный мидриатический эффект: комбинированная формула способствует повышению эффективности потока пациентов» . Управление офтальмологии .
Внешние ссылки
[ редактировать ]- п-гидроксиамфетамин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)